不饱和脂肪酸对肝癌移植瘤小鼠P21、P53、P13K及PKB/Akt蛋白表达的影响*
朱喜春 张永兴 俞发荣
(1.甘肃省药品检验研究院,兰州 730070)(2.中国农业科学院兰州兽医研究所,家畜疫病病原生物学国家重点实验室,兰州 730046) (3.甘肃政法大学公安分院,兰州 730070)
人类疾病实验动物模型在生物科学、医药化学和生命健康等领域得到了广泛的应用[1],是研究疾病的发生、发展和病理机制的有效工具[2]。严重联合免疫缺乏(severe combined immune deficiency,SCID)小鼠因缺乏腺苷脱氨酶(adenosine deaminase,ADA)导致B细胞、T细胞功能缺失,从而表现出严重的联合免疫缺陷症状。SCID小鼠是继裸鼠(免疫缺陷动物、先天无胸腺和缺乏T淋巴细胞)出现之后,人类发现的又一种十分有价值的免疫缺陷动物。SCID小鼠已应用于人类免疫学、肿瘤学、生理学、药理学等方面的研究,能接受人体肿瘤组织的移植,进行人体肿瘤学方面的实验研究。研究证明,高等动物乃至人类组织细胞的正常生长受到不同信号传导系统的调控,其中磷脂酰肌醇-3激酶/蛋白激酶B(PI3K-Akt)信号传导通路与细胞分裂增殖关系尤为密切[3]。 有研究[4]发现,细胞生长或抑制受PI3K-Akt信号传导通路的调节和控制,PI3K-Akt信号传导通路在细胞内发挥重要的作用,参与了许多生理和病理活动。体外研究显示,采用PI3K-Akt信号传导通路抑制剂可以逆转肿瘤细胞的耐药性[5]和提高抗肿瘤药物的药效[6],PI3K-Akt信号传导通路可能是肿瘤治疗的潜在靶点[7]。为了探索不饱和脂肪酸对肿瘤增殖的抑制作用及PI3K-Akt信号传导通路调控作用机制,将甘肃猫儿眼(euphorbia kansui)不饱和脂肪酸给予荷肝癌组织的SCID小鼠,探索不饱和脂肪酸对肝癌增殖的抑制作用,为不饱和脂肪酸进一步研究开发和临床应用提供理论依据,为预防和治疗肿瘤探索新的作用靶点,提供新的药物资源。
1 材料和方法
1.1 材料
1.1.1实验动物:SPF级SCID小鼠50只,雌雄各半,体质量 20~22 g,来源中国农业科学院兰州兽医研究所实验动物中心【SCXK (甘)2020-0002】。全部实验在甘肃省药品检验研究院实验动物实验室【SYXK (甘)2020-0006】完成。动物实验通过甘肃省药品检验研究院动物伦理委员会审核批准(GYJY-2021-006),对动物实验进行了科学合理的设计,优化实验,遵守“3R”原则。从动物的购买、运输,动物使用过程中规范饲养管理,善待动物,规范实验操作技术,动物实验结束采用安乐死,让动物在整个实验过程中享受人文关怀。
1.1.2肝癌组织:甘肃省肿瘤医院肿瘤外科提供。肝癌组织来源:患者男性,56岁,HCC/Ⅲa/T3N0M0,Child-Pugh A/B, PS 0~2。所有患者知情同意。
1.1.3试剂与仪器:不饱和脂肪酸(兰州大学天然植物研究所),甘肃猫儿眼(euphorbia kansui)块根(中国科学院兰州化学物理研究所); 5-氟尿嘧啶(5-FU)(上海旭东海普药业有限公司);抗癌基因P53、磷酸肌醇3激酶(P13K)、 细胞周期素依赖性激酶抑制因子(P21)、蛋白激酶B(PKB/Akt)试剂盒(上海生物科技开发公司)。
1.2 方法
1.2.1肝癌组织移植:选取8周龄SPF级SCID小鼠50只,雌雄各半。全部动物在SPF级实验室独立送回风净化笼具(individal ventilation cages,IVC)饲育盒内饲养,自由饮水进食,人工光照 12 h。实验室温度20~22 ℃,IVC内温度 22.2 ℃,湿度55%~65%,适应7 d。将手术切取2 h内肝癌组织放入超净台中,用Hanks液反复冲洗,剔去坏死组织和非癌组织后,将瘤组织切成1~2 mm3小块,用粗针穿刺移植于SCID小鼠右侧腋窝皮下,IVC饲育盒中饲养。
1.2.2荷瘤 SCID 小鼠分组和给药 :按照预实验方法,待移植瘤长到6~7 mm时,荷肝癌组织的 SCID 小鼠随机分为5组,每组 10只。根据人体用药量和小鼠体表面积换算,计算得出不饱和脂肪酸给药量为:低、中、高剂量组腹腔注射不饱和脂肪酸50 mg/(kg·d)、100 mg/(kg·d)和200 mg/(kg·d);五氟尿嘧啶(5-FU)组腹腔注射5-FU 100 mg/(kg·d),模型组腔注射蒸馏水2 mL/(kg·d),连续给药21 d。
1.2.3肿瘤组织检测分析:末次给药后次日乙醚吸入无痛麻醉,手术切开肿瘤周围皮肤,剥取肿瘤组织,用游标卡尺测量移植瘤长(a)、宽(b)和高(c),用体积计算公式V=πabc/6[8]计算移植瘤体积,用天平称移植瘤质量,比较肿瘤生长情况。用万分之一分析天平称取各组瘤组织500 mg,用匀浆研磨器研磨,以 2 000 r/min 离心 15 min,取上清,用酶标仪在 450 nm 波长下测定吸光度(A)。
1.2.4直线回归方程制作:取标准品 50 μL,加入酶标板,用酶标仪在 450 nm 波长下测定吸光度(A)。以标准品的浓度为横坐标,对应的吸光度(A)为纵坐标,制作出标准曲线的直线回归方程。
1.3 统计学分析
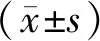
2 结果
2.1 SCID小鼠肿瘤模型建立及不饱和脂肪酸对肝癌移植瘤生长的影响
将肝癌组织分别移植于50只SCID小鼠右侧腋窝皮下,肝癌组织生长正常,肿瘤模型建立成功。将不饱和脂肪酸和5-FU给予荷肝癌组织的 SCID 小鼠,第22天比较各组动物移植瘤生长情况,见图1;不饱和脂肪酸低、中、高剂量组和5-FU组肝癌移植瘤体积和质量显著小于模型组(P<0.01),不饱和脂肪酸低、中剂量组肝癌移植瘤体积和质量与5-FU组无明显差异(P>0.05),高剂量组肝癌移植瘤体积和质量显著小于5-FU组(P<0.01),见表1。
表1 不饱和脂肪酸对肝癌移植瘤生长的影响Table 1 Effect of unsaturated fatty acids on the growth of liver cancer transplanted n=10)
2.2 不饱和脂肪酸对肝癌移植瘤蛋白表达水平的影响
2.2.1不饱和脂肪酸对肝癌移植瘤P53蛋白表达水平的影响:以P53标准品的浓度为横坐标,吸光度(A)为纵坐标作标准曲线的直线回归方程,见图2。

注: A:正常组;B:不饱和脂肪酸低剂量组;C:不饱和脂肪酸中剂量组;D:不饱和脂肪酸高剂量组;E:5-FU组;F:模型组Note: A: normal group; B:unsaturated fatty acid low dose group; C: unsaturated fatty acids medium dose group;D: unsaturated fatty acid high dose group; E:5-FU group; F:model group图1 不饱和脂肪酸对肝癌移植瘤生长的影响Fig.1 Effects of unsaturated fatty acids on the growth of liver cancer transplanted tumor

图2 P53标准曲线的直线回归方程Fig.2 Linear regression equation of P53 standard curve
与模型组相比,不饱和脂肪酸低、中、高剂量组和5-FU组肝癌移植瘤P53蛋白表达水平明显降低(P<0.05,P<0.01),不饱和脂肪酸低、中剂量组肝癌移植瘤P53蛋白表达水平与5-FU组无明显差异(P>0.05),高剂量组肝癌移植瘤P53蛋白表达水平显著低于5-FU组(P<0.01),见图3。

注:与模型组相比,*P<0.05,**P<0.01;与5-FU组相比, #P<0.01;Note:Compared with model group, *P<0.05,**P<0.01; Compared with 5-FU group, #P<0.01图3 不饱和脂肪酸对肝癌移植瘤P53蛋白表达水平的影响Fig.3 Effect of unsaturated fatty acids on expression level of P53 protein in liver cancer transplantation tumor
2.2.2不饱和脂肪酸对肝癌移植瘤P21蛋白表达水平的影响:以P21标准品的浓度为横坐标,吸光度(A)为纵坐标作标准曲线的直线回归方程,见图4。

图4 P21标准曲线的直线回归方程Fig.4 Linear regression equation of P21 standard curve
与模型组相比,不饱和脂肪酸低、中、高剂量组和5-FU组肝癌移植瘤P21蛋白表达水平明显升高(P<0.05,P<0.01),不饱和脂肪酸低、中剂量组肝癌移植瘤P21蛋白表达水平与5-FU组无明显差异(P>0.05),高剂量组肝癌移植瘤P21蛋白表达水平显著高于5-FU组(P<0.01),见图5。
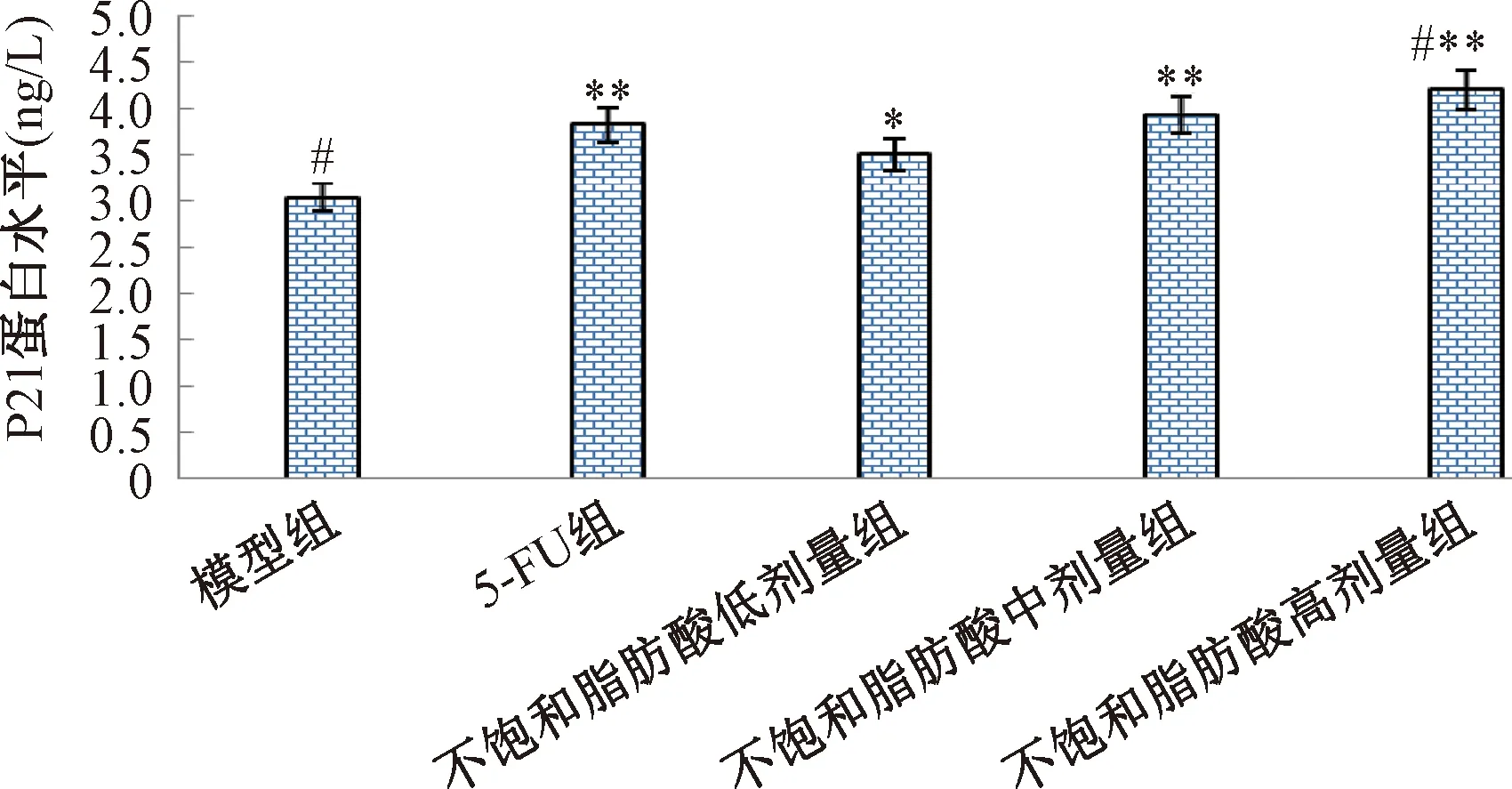
注:与模型组相比,*P<0.05,**P<0.01;与5-FU组相比, #P<0.01;Note:Compared with model group, *P<0.05,**P<0.01; Compared with 5-FU group, #P<0.01图5 不饱和脂肪酸对肝癌移植瘤P21蛋白表达水平的影响Fig.5 Effect of unsaturated fatty acids on expression level of P21 protein in liver cancer transplantation tumor
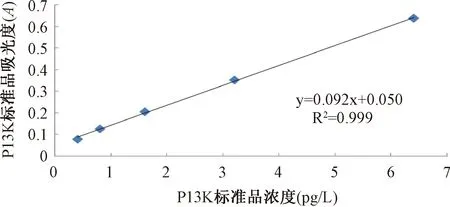
图6 P13K标准曲线的直线回归方程Fig.6 Linear regression equation of P13K standard curve
2.2.3不饱和脂肪酸对肝癌移植瘤P13K蛋白表达水平的影响:以P13K标准品的浓度为横坐标,吸光度(A)为纵坐标作标准曲线的直线回归方程,见图6。
与模型组相比,不饱和脂肪酸低、中、高剂量组和5-FU组肝癌移植瘤P13K蛋白表达水平明显降低(P<0.05,P<0.01),不饱和脂肪酸低、中剂量组肝癌移植瘤P13K蛋白表达水平与5-FU组无明显差异(P>0.05),高剂量组肝癌移植瘤P13K蛋白表达水平显著低于5-FU组(P<0.01),见图7。

注:与模型组相比,*P<0.05,**P<0.01;与5-FU组相比, #P<0.01;Note:Compared with model group, *P<0.05,**P<0.01; Compared with 5-FU group, #P<0.01图7 不饱和脂肪酸对肝癌移植瘤P13K蛋白表达水平的影响Fig.7 Effect of unsaturated fatty acids on expression level of P13K protein in liver cancer transplantation tumor
2.2.4不饱和脂肪酸对肝癌移植瘤PKB/Akt蛋白表达水平的影响:以PKB/Akt标准品的浓度为横坐标,吸光度(A)为纵坐标作标准曲线的直线回归方程,见图8。
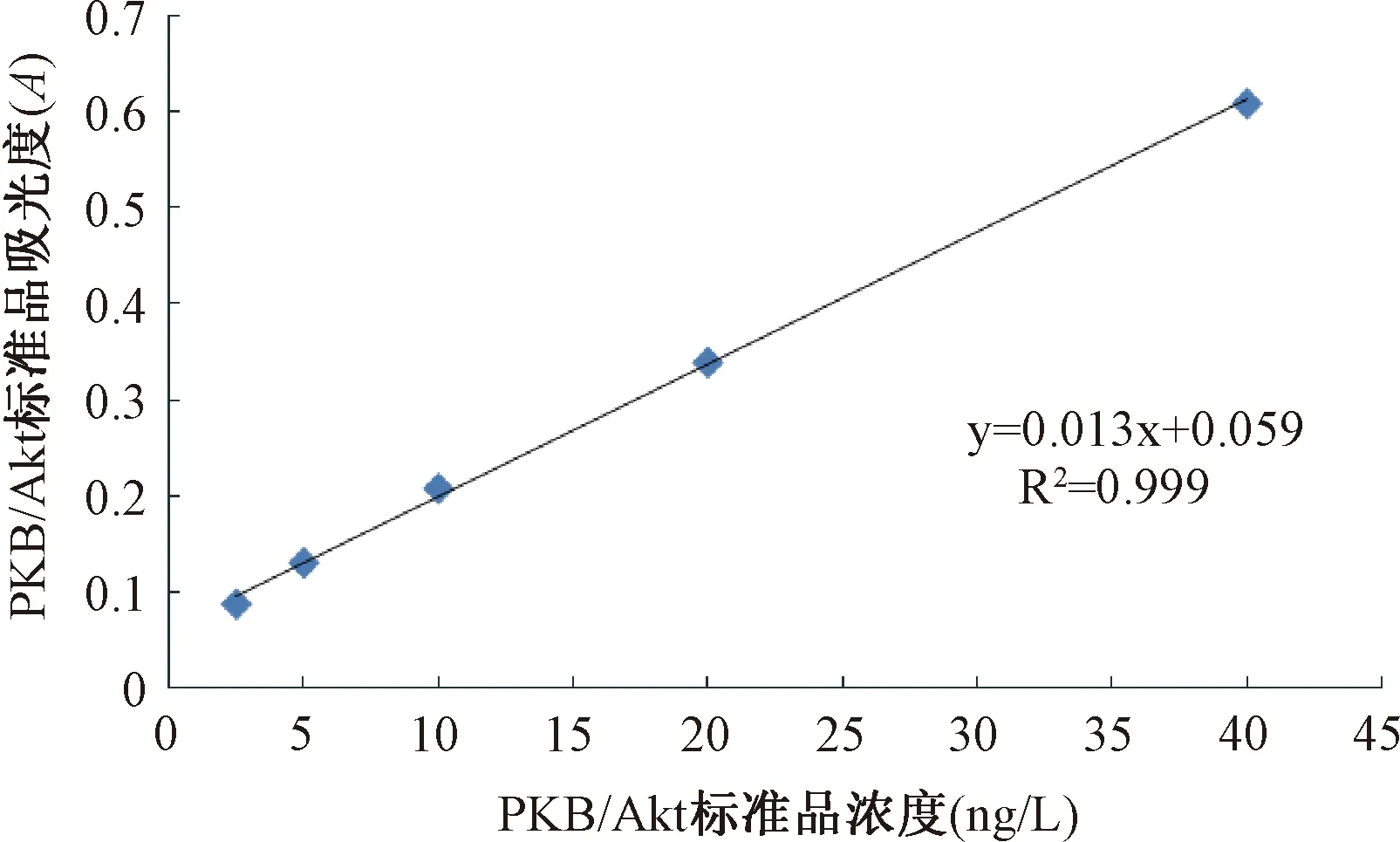
图8 PKB/Akt标准曲线的直线回归方程Fig.8 Linear regression equation of PKB/Akt standard curve
与模型组相比,不饱和脂肪酸低、中、高剂量组和5-FU组肝癌移植瘤PKB/Akt蛋白表达水平明显降低(P<0.05,P<0.01),不饱和脂肪酸低、中剂量组肝癌移植瘤PKB/Akt蛋白表达水平与5-FU组无明显差异(P>0.05),高剂量组肝癌移植瘤PKB/Akt蛋白表达水平显著低于5-FU组(P<0.01),见图9。
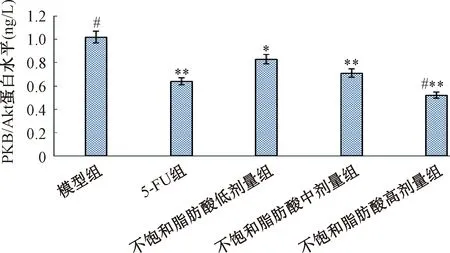
注:与模型组相比,*P<0.05,**P<0.01;与5-FU组相比, #P<0.01Note:Compared with model group, *P<0.05,**P<0.01; Compared with 5-FU group, #P<0.01图9 不饱和脂肪酸对肝癌移植瘤PKB/Akt蛋白表达水平的影响Fig.9 Effect of unsaturated fatty acids on expression level of PKB/Akt protein in liver cancer transplantation tumor
3 讨论
严重联合免疫缺陷(SCID)小鼠已广泛用于膀胱癌[10]、皮肤瘢痕[11]、食管癌[12]、肝癌[13]、乳腺癌[14]、结肠癌[15]等疾病发生、发展、转移和预防治疗的实验研究。不饱和脂肪酸作为被广泛研究的免疫营养物质,不仅在调节机体免疫功能、脂质代谢等方面有着重要作用,而且在肿瘤预防和治疗方面也有着重要作用。研究表明,不饱和脂肪酸具有诱导多种肿瘤细胞凋亡[16]、抑制肿瘤细胞增殖[17]、转移[18]等作用,并能抑制相关癌症基因编码蛋白表达[19],调控信号传导通路[20],降低癌细胞的侵袭力[21],从而起到抗肿瘤的作用[22]。研究发现,肿瘤生长或抑制受PI3K/Akt信号通路的调节和控制[23]。PI3K-Akt信号通路在肿瘤血管生成和细胞生长、增殖、新陈代谢、迁移、分化和凋亡过程中起着至关重要的作用[24]。PI3K-Akt 信号通路被激活时,促进肿瘤细胞增殖[25],PI3K-Akt 信号通路被抑制时,促进肿瘤细胞凋亡,发挥其抗肿瘤效应[26]。在PI3K-Akt信号传导通路中,p53、p21基因起着重要的调控作用。在正常生理条件下,体内外环境因子与细胞膜受体结合,激活p53基因使之表达,P53蛋白与p21基因直接作用调控P21蛋白的表达[27],促使P21与二磷酸鸟苷(Guanosine diphosphate,GDP)分离而与三磷酸鸟苷 (Guanosine triphosphate, GTP)结合,形成P21-GTP复合体,使细胞内信号传导系统开放,细胞开始分裂和增殖;P21具有GTP酶活性,可水解GTP为GDP,P21与GDP结合而失活,使细胞内信号传导系统处于关闭状态,调控正常的细胞分裂增殖。实验结果发现,给予荷人肝癌SCID 小鼠不饱和脂肪酸,肝癌移植瘤生长受到抑制;P53、P13K和PKB/Akt水平下调,从而降低P13K-Akt信号通路活性及下游相关分子的表达,抑制瘤细胞的增殖;P21水平升高,水解GTP为GDP,P21与GDP结合而失活,关闭细胞内信号传导系统。这与文献[28-29]结果一致。实验结果提示,在P13K-Akt信号传导通路中,p21、P53、P13K和PKB/Akt蛋白水平起着主要的调控作用,可作为临床肿瘤治疗的潜在靶点。

