植物根际促生菌发酵液中植物激素含量的液液萃取-高效液相色谱测定法
刘晓婷,姚 拓,马亚春,柴加丽
(甘肃农业大学草业学院, 甘肃 兰州 730070)
植物激素是植物体内产生的一种微量的天然有机小分子化合物,能从产生部位运往作用部位,在细胞分裂、分化与种子萌发、休眠以及植物生长、生殖、成熟和衰老等方面起着重要作用[1-2]。自然界中不仅植物可以产生植物激素,许多细菌也能产生植物激素[3]。研究表明,植物根际促生菌产生的植物激素在调节植物生长发育方面发挥着巨大的作用,促生菌既可以通过分泌植物激素改良作物株型,提高作物产量,又可以通过分泌植物激素参与调控作物对各种生物或非生物胁迫的适应性而增加作物产量[4-5]。在过去的30 年中,化肥在农业增产增效中的作用显而易见,但长期不合理施用化肥也带来土壤肥力下降、农产品品质低下、农作物病虫害增加、生态环境被破坏等一系列不良后果。微生物肥料作为一种新型肥料,以其促进植物生长、增强植物抗逆性、改良土壤等优点而被开发应用[6-7]。高效多功能促生菌资源是研制微生物肥料的重要原料。然而,与固氮、溶磷菌不同,分泌植物激素菌目前还没有特定的选择性培养基,其分离过程往往不是定向的,而是通过其他促生菌筛选的[8-9],因此,准确检测植物根际促生菌中植物激素的含量,是筛选分泌植物激素菌的重要前提,而这就要求发展准确高效的定性定量分析方法。
植物根际促生菌产生的植物激素含量极低,性质不稳定,对提取环境较敏感,而且菌株发酵产物中含有大量的细菌次生代谢产物,直接检测会受到色素、次生代谢物等干扰物的影响,影响分析结果的准确性,因此选择合适的样品前处理方法及分离检测方法对测定植物激素极其重要[10-12]。近年来,高效液相色谱检测技术在植物激素分析领域中应用广泛,具有对目标物分离效率高、定性定量准确、检测灵敏度高、仪器维护成本低等优点,是目前植物激素分析检测中的常用方法[13-16]。关于植物根际促生菌中植物激素的检测分析,有研究使用固相萃取和免疫亲和纯化等对植物根际促生菌发酵液中的植物激素进行提取纯化[17-18],而针对改进的液-液萃取技术对植物根际促生菌中的植物激素进行提取富集的研究较少。鉴于此,为快速准确测定植物根际促生菌发酵产物中的植物激素含量,本研究采用液液萃取-高效液相色谱法,建立一种同时测定植物根际促生菌中吲哚乙酸、赤霉素、玉米素3 种植物激素含量的分析方法,以期增进对植物根际促生菌中植物激素作用机制的了解,并为丰富我国的菌种资源库提供参考。
1 试验设计
1.1 仪器、试剂与材料
Agilent 1260 高效液相色谱仪(美国Agilent 公司);YJCY-202T 叠加摇床(上海跃进医疗器械有限公司);H1850R 高速离心机(长沙高新技术产业开发区湘仪离心机仪器有限公司);RVC 2-25 真空离心浓缩仪(北京五洲东方科技发展有限公司);AK-ROUP-250 超纯水制备仪(成都唐氏康宁科技发展有限公司);225D-1CN 精密电子天平(北京赛多利斯科学仪器有限公司);0.45 μm 一次性微孔滤器(甘肃艾尔维科学仪器有限公司)。
吲哚乙酸、玉米素标准品(纯度≥ 98%)、赤霉素标准品(纯度≥ 90%) 均购自北京索莱宝科技有限公司;甲醇、乙酸乙酯(色谱纯,甘肃艾尔维科学仪器有限公司)、冰乙酸(色谱纯,天津市凯信化学工业有限公司);试验所有用水均为超纯水;其他试剂均为国产分析纯。
供试菌株MBM5 (Pseudomonas sesame)、PAM12(Pseudomonas mohnii)是甘肃农业大学草业学院草地微生物多样性课题组前期从红原高寒草地优势牧草毛稃羊茅(Festuca kirilowii)根际分离的2 株优良植物根际促生菌,现保存于甘肃农业大学草业学院草地微生物多样性实验室。
1.2 标准溶液配制
准确称取上述标准品各20 mg 分别置于100 mL容量瓶中,用甲醇溶解并定容至刻度线,配制成质量浓度为200 μg·mL-1的标准品储备液,于4 ℃冰箱中避光保存。分别准确吸取适量上述标准品储备液,用甲醇稀释成系列混合标准工作溶液。
1.3 样品前处理
将2 株促生菌菌株经活化后接种于King 氏培养基[19](已灭菌)中,每个菌株3 个重复,15 ℃、180 r·min-1摇床中培养7 d。吸取20 mL 各菌株培养液,4 ℃、10 000 r·min-1离心20 min,弃掉菌体收集上清液,加入等体积超纯水和两倍体积的乙酸乙酯重复萃取两次。合并乙酸乙酯层,经真空离心浓缩仪浓缩至近干,以甲醇溶解,经0.45 μm 一次性微孔滤器过滤后注入2 mL 棕色样品瓶中,待高效液相色谱分析。
1.4 色谱条件
色 谱 柱:Agilent ZORBAX Eclipse Plus C18 柱(4.6 mm × 250 mm,5 μm);流动相采用体积比为45 ∶ 55的甲醇-水(含0.2%冰乙酸);柱温30 ℃;检测波长254 nm;流速0.8 mL·min-1;进样体积10 μL。
2 结果与分析
2.1 色谱条件的选择
2.1.1 检测波长选择
取3 种植物激素标准品储备液,依据文献[17]选择在190~400 nm 进行紫外光谱扫描。结果显示,吲哚乙酸的最大吸收波长为255 nm,赤霉素的最大吸收波长为239 nm,玉米素在205 nm 和254 nm处各有一个特征吸收峰,且254 nm 处吸收峰大于205 nm 处的吸收峰。综合分析,3 种植物激素在254 nm波长下均有良好吸收,因此选取254 nm 波长用于吲哚乙酸、玉米素、赤霉素含量的测定。
2.1.2 流动相的选择
流动相的选择会对样品中激素的分离度以及峰形产生重要影响。考察了流动相对植物激素分离的影响,直接以甲醇-水溶液作为流动相时,3 种植物激素的混合标准样品峰形较差,色谱峰拖尾严重。由于3 种植物激素均为弱酸性物质,较易电离,因此在流动相中添加少量酸可抑制其离子化,改善吲哚乙酸、玉米素、赤霉素在色谱柱上的分离度和色谱峰峰形。当水溶液中加入体积分数为0.2%的冰乙酸时,植物激素分离效果好且色谱峰峰形良好。因此, 流动相最终确定为流动相A 为甲醇,流动相B 为含0.2% (体积分数)的冰乙酸水溶液,以进一步提高色谱分离度。在选定的色谱条件下,3 种植物激素标准溶液在254 nm 检测波长下的色谱图如图1所示。
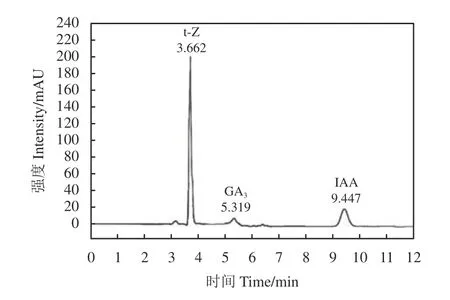
图1 混合激素标准溶液的色谱图Figure 1 Chromatogram of the standard mixture of hormones
2.2 线性范围、检出限和定量限
在选定的条件下,对3 种植物激素的混合标准工作溶液进行测定,记录峰面积。以峰面积为纵坐标(y),对应的质量浓度为横坐标(x,μg·mL-1),作线性回归方程。结果显示:赤霉素、吲哚乙酸、玉米素分别在26.68~111.11、10.67~44.44、10.67~44.44 μg·mL-1质量浓度内呈良好线性关系,相关系数均大于0.997。以信噪比(S/N)为3 确定各植物激素的检出限(limits of detection, LOD),以S/N 为10 确定各植物激素的定量限(limits of quantitative, LOQ)。结果表明:该方法中3 种植物激素的LOD 为0.01~0.75 μg·mL-1,LOQ 为0.03~2.50 μg·mL-1(表1)。

表1 植物激素的线性方程、线性范围、相关系数及检出限和定量限Table 1 Linear equations, linear ranges, correlation coefficients, limits of detection (LOD),and limits of quantitative (LOQ) of plant hormones
2.3 精密度试验
取1.2 中混合标准品溶液,按选定的色谱条件连续进样测定6 次,记录峰面积。结果显示,赤霉素、吲哚乙酸、玉米素峰面积相对标准偏差分别为2.77%、2.53%和1.92%,表明仪器精密度良好。
2.4 稳定性试验
随机选取按1.3 中方法制备好的样品溶液一份,按选定的色谱条件分别在0、2、4、8、12 和24 h进样测定,记录峰面积。结果显示,赤霉素、吲哚乙酸、玉米素峰面积相对标准偏差分别为1.54%、1.80%和0.48%,表明供试样品溶液中3 种植物激素在24 h 内稳定性良好。
2.5 重复性试验
随机选取一个促生菌菌株,按1.3 中方法平行制备6 份,按选定的色谱条件进样分析。结果显示,供试样品溶液中赤霉素、吲哚乙酸、玉米素的相对标准偏差分别为1.34%、1.68% 和0.35%,表明该方法重复性良好。
2.6 加标回收率试验
准确量取菌株发酵液样品各6 份,其中3 份添加一定量的混合标准溶液,另外3 份不加混合标准溶液,经1.3 中方法处理后,按选定的色谱条件进样测定,记录峰面积,计算平均加标回收率及相对标准偏差。结果表明,各植物激素的回收率存在差异,同一激素在不同植物根际促生菌中的回收率也有所不同。3 种植物激素的平均回收率在88.02%~108.40%,其相对标准偏差为0.02%~6.51% (表2),表明该方法准确可靠,满足植物根际促生菌中3 种植物激素的检测要求。

表2 植物激素的添加回收率和相对标准偏差(n = 3)Table 2 Recovery and relative standard deviation of 3 plant hormones (n = 3)
2.7 实际样品测定
采用上述高效液相色谱法测定2 株促生菌MBM5 和PAM12 中的3 种植物激素分泌量。色谱图显示,促生菌中3 种激素可完全分离,峰形良好(图2)。2 株促生菌株均能产生植物激素,菌株MBM5 的赤霉素、吲哚乙酸、玉米素分泌量分别为13.20、1.76 和1.77 μg·mL-1,菌株PAM12 的赤霉素、吲哚乙酸、玉米素分泌量分别为24.78、1.79 和2.44 μg·mL-1。菌株MBM5 和PAM12 中3 种植物激素含量差异较大,赤霉素的含量明显高于吲哚乙酸和玉米素的含量,因此这2 株促生菌菌株可以作为优良的产赤霉素的菌种资源。
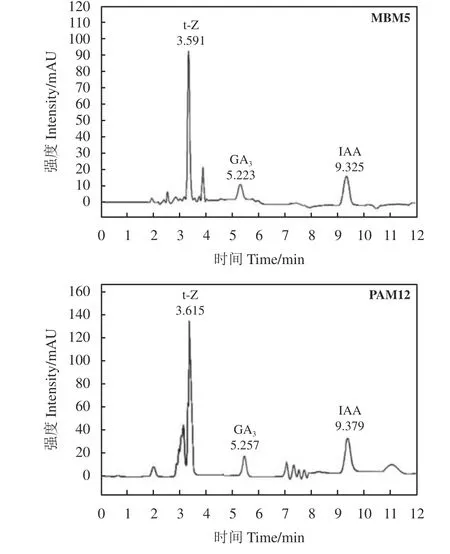
图2 测定实际样品促生菌MBM5 和PAM12 的色谱图Figure 2 Chromatograms of the MBM5 strain and PAM12 strain
3 讨论与结论
样品前处理是植物激素分析中的关键步骤之一,直接影响后续检测方法的准确性和精密度。由于植物根际促生菌分泌的植物激素含量极低,又含有色素、中间代谢产物等杂质的干扰,分析前选择适当的纯化和富集方法对植物激素进行准确定量至关重要[20]。关于植物激素的前处理方法,有研究采用固相萃取技术,该技术具有溶剂消耗少,而且可供选择的固定相种类较多、快速可靠等优点。采用固相萃取小柱虽然能对目标化合物进行纯化和富集,但也存在前处理方法操作耗时、萃取小柱容易堵塞等不足,而且洗脱液的酸度和溶剂的比例很大程度上决定了洗脱液的洗脱能力,如果不能进行合理选择和优化,难以保证目标化合物被最大限度的洗脱,损失较大[21-23]。本研究的前处理方法不需要通过固相萃取柱,经萃取、真空离心浓缩,用甲醇复溶后过滤膜即可直接上机进样分析,可以满足样品处理过程简单、方便的分析要求,而且还极大地缩短了样品前处理所需的时间。
目前,关于植物根际促生菌中植物激素的检测方法有免疫分析法、电化学分析法、高效液相色谱法、气相色谱-质谱联用、液相色谱-质谱联用等技术[24]。高效液相色谱法是植物激素测定中的一种常用方法,它结合了质谱的高灵敏度及色谱分离效率高等优点,大大提高了检测的灵敏度与准确性,而且其仪器维护成本低,可实现多种植物激素的同时检测[25-26]。与免疫分析法相比,高效液相色谱法准确度更高,对激素的提纯精度更高,同时可避免分析过程中一些放射性元素对操作者身体造成的损伤及次生代谢物与抗体出现交叉反应影响定量分析结果的准确性与重现性[27-28]。与色谱质谱联用技术相比,高效液相色谱法避免了较为繁琐的衍生化处理过程,大大简化了样品前处理过程中的工作量[29]。通过对电化学分析法研究发现,在促生菌发酵产物中其本身的pH 及溶液性质会对分析结果产生很大的影响[30],而高效液相色谱法则能在很大程度上减少这方面的不足,成为被普遍认可和接受的植物激素检测手段。综上所述,液液萃取-高效液相色谱法可以为植物根际促生菌中植物激素的同时测定提供一种快速、准确、简单的方法。
本研究建立了高效液相色谱法同时测定植物根际促生菌中3 种植物激素分泌量的分析方法。该方法快速简单,灵敏度高,3 种植物激素的平均回收率为88.02%~108.40%,相对标准偏差为0.02%~6.51%,可以实现植物根际促生菌中植物激素分泌量的准确测定。应用建立的方法,进行了精密度、稳定性、重复性验证和评价,均满足检测分析要求。2 株促生菌菌株均具有较高的产赤霉素能力,可为今后微生物肥料的研制应用提供优良菌种资源。

