甘草AQPs 基因家族的鉴定及表达分析
张亚丽,王 楠,张 岗,何懿菡,颜永刚,高 静
(1. 陕西中医药大学药学院, 陕西 西安 712046;2. 陕西中医药大学陕西中药资源产业化省部共建协同创新中心 /秦药特色资源研究与开发国家重点实验室(培育), 陕西 咸阳 712083)
水通道蛋白(aquaporins, AQPs),属于膜内在蛋白MIP (major intrinsic protein)家族,介导细胞与介质之间水分快速运输,在维持细胞膨压调节水分平衡中起重要作用[1]。除此之外,AQPs 还可以通过选择性跨膜转运甘油、尿素、硼酸、氨和CO2等物质,在植物种子萌发、细胞分化及抵御逆境等过程中起到调节作用[2-3]。自Maurel 等[4]在拟南芥(Arabidopsis thaliana)中分离出第一个植物水通道蛋白γ-TIP,迄今,已在玉米(Zea mays)[5]和水稻(Oryza sativa)[6]等多个植物中发现并被鉴定。植物水通道蛋白基因可以分为4 个亚家族,即质膜内在蛋白(plasma membrane intrinsic proteins, PIPs)、液泡膜内在蛋白(tonoplast membrane intrinsic proteins, TIPs)、类NOD26 膜内在蛋白(nodulin26-like intrinsic proteins, NIPs)和小分子碱性膜内在蛋白(small basic intrinsic proteins, SIPs)[7]。不同亚组水通道蛋白均由4 个单体组成,每个单体由6 个跨膜螺旋段(TM1-TM6)和2 个短螺旋段中的Asn-Pro-Ala (NPA)序列组成。其中跨膜结构氨基酸链在膜两侧形成5 个环形结构(LA-LE),并且NPA 中存在芳香族化合物/精氨酸(aromatic/arg,Ar/R)模体结构[8],该模体分别由螺旋2 (TM2)和螺旋5 (TM5)上各一个氨基酸残基以及E 环上的两个氨基酸残基(LE1 和LE2) 组成。Froger 等[9]还发现AQPs 中存在(P1-P5) 5 个关键残基位置(Froger 位点),其在决定运输水分子或甘油分子中起重要作用。也有研究表明NPA 和Ar/R 可作为两个“滤器”,能通过控制水孔大小及疏水性决定底物的特异性[8]。
植物在生长发育中会受到干旱、盐、低温和金属离子等非生物胁迫[10]。AQPs 作为多功能蛋白可以通过调节水分吸收、分布及其他营养物质的运输来提高耐受性[2,11],从而应对胁迫产生的负面影响。研究表明,香蕉(Musa acuminata)MaPIP1;1在拟南芥中异源表达后,通过降低膜损害、提高离子浓度以及维持渗透平衡等方式增加植株对干旱和盐胁迫的耐受性[12];黄瓜(Cucumis sativus)CsPIP1;2和CsPIP2;4以及烟草(Nicotiana tabacum)NtPIP1;1和NtPIP2;1在干旱胁迫后都下调表达,用以抵御水分胁迫[13]。除此之外,GmPIP1;6可以使处于盐胁迫条件下大豆(Glycine max)的抗盐能力有所提高[14]。有报道显示,大多数植物AQPs可以通过响应非生物胁迫信号来影响基因的表达,利用信号转导通路改变通道分子的开关、活性、转运和富集从而维持植物体内水分平衡,提高植物抗逆性[15]。
甘草(Glycyrrhiza uralensis)是常用的大宗药材,为豆科(Leguminosae)植物多年生草本。研究表明,甘草的核心产区为宁夏、内蒙古、甘肃和新疆等西北干旱和盐碱地带[16]。其中干旱、盐胁迫、低温胁迫是影响甘草品质和产量的重要因素,因此本研究利用已公布的甘草基因组信息筛选出GuAQPs基因家族成员,对其进行生物信息学和逆境胁迫下基因的表达模式分析,为进一步深入研究甘草抗逆机理并挖掘潜在的抗性基因提供参考。
1 材料与方法
1.1 试验材料及处理条件
甘草种子采购于新疆乌拉尔,经陕西中医药大学黄文静副教授鉴定为甘草。将种子用30%过氧化氢消毒30 min 后置于25 ℃气候箱中催芽,一周后挑选生长健康、大小一致的幼苗移栽于采用霍格兰营养液(Hoagland)培养的装置中,采用Hoagland 全营养液(成分:硝酸钙945 mgˑL-1、硫酸钾607 mgˑL-1、磷酸二氢氨115 mgˑL-1、硫酸镁493 mgˑL-1、EDTA 铁钠盐20 mgˑL-1、硫酸亚铁2.86 mgˑL-1、硼 砂4.5 mgˑL-1、硫 酸 锰2.13 mgˑL-1、硫 酸 铜0.05 mgˑL-1、硫 酸 锌0.22 mgˑL-1和 硫 酸 铵0.02 mgˑL-1)培养30 d。然后,用Hoagland 全营养液为溶剂配处理液:15% 聚乙二醇(polyethylene glycol 6000, PEG-6000)溶 液、150 mmolˑL-1氯 化 钠(sodium chloride,NaCl)溶液、60 μmolˑL-1脱落酸(abscisic acid, ABA)溶液分别模拟干旱胁迫、盐胁迫、ABA 处理,将Hoagland 全营养液培养的甘草置于10 ℃气候箱模拟低温处理,以Hoagland 全营养液室温培养为对照组。于处理0 h、24 h、48 h 和7 d 时间点取干旱胁迫(PEG)、盐胁迫(NaCl)、ABA 和低温处理后的甘草根和叶,用灭菌水冲洗后液氮速冻,置-80 ℃冰箱保存备用,其中各处理组分别设3 个生物学重复。
1.2 GuAQPs 基因家族的鉴定
根据日本研究者Mochida 等[17]发表的甘草基因组序列,对甘草AQPs基因家族进行筛选鉴定。甘草基因组序列原始数据已保存在日本DNA 数据库(DDBJ),其生物工程ID 为PRJDB3943。基因组组装和注释数据集可在http://ngs-data-archive.psc.riken.jp/Gur-genome/download.pl 下载。从数据库DDBJ 下载甘草基因组数据作为本地Blast 数据库,在https://www.arabidopsis.org/下载拟南芥AQPs 序列作为查询序列进行比对,初步获得GuAQPs家族成员候选序列,候选序列采用Pfam (http://pfam.xfam.org/)数据库进行保守结构域预测后筛去不含保守结构域的基因,最终鉴定到43 个GuAQPs基因家族成员。
1.3 GuAQPs 系统进化分析与命名
利用ClustalW 算法将甘草和拟南芥的AQPs 蛋白序列进行比对,用MEGA7.0 软件采用Maximum Likelihood 方法构建进化树[18]。根据系统进化分析结果,参考拟南芥、水稻以及玉米的AQPs 命名法[5-6,19]对GuAQPs 蛋白命名,将GuAQPs 分为PIPs、TIPs、NIPs 和SIPs 4 类。
1.4 GuAQPs 蛋白特征及保守性分析
GuAQPs 蛋白质理化性质及二级结构采用Protparam(http://web.expasy.org/protparam/)进行分析。GuAQPs蛋白跨膜结构用TMHMM (http://www.cbs.dtu.dk/ser vices/TMHMM/)在线网站预测。利用Cell-PLoc 2.0(http://www.csbio.sjtu.edu.cn/bioinf/plant-multi/)进行亚细胞定位预测。使用Net phos 3.1server (http://www.cbs.dtu.dk/services/NetPhos/)对磷酸化位点进行预测。通过与拟南芥的蛋白多序列比对结果及参考其他植物AQPs 多序列比对推测两个NPA 基序、Ar/R滤器及Froger 位点(P1-P5)的氨基酸残基[6,20]。
1.5 GuAQPs 基因结构、Motif 及顺式作用元件
从甘草基因组中提取GuAQPs基因结构信息,利用在线软件TBtools 绘制基因结构图。使用MEME (http://meme.Nbcr.net/meme)网站分析氨基酸序列,得到GuAQPs 蛋白保守基序。通过Plant CARE网站(http://bioinformatics.psb.ugent.be/webtools/plantc are/html/)预测GuAQPs顺式作用元件[21]。
1.6 非生物胁迫下GuAQPs 转录组分析
以陕西省中管局“秦药”研发重点实验室药用植物生理生态课题组前期获得的甘草在高盐(150 mmolˑL-1NaCl)和干旱(15% PEG-6000)胁迫处理7 d后的地上部分和地下部分转录组数据为基础[22]。转录组数据用HTSeq-count 软件统计每个样品比对到每个基因上的reads count,对reads count 进行均一化处理采用的是RPKM (reads per kilobase per million mapped reads)法,使用union 模型对各样品进行基因表达水平分析,筛选出GuAQPs基因,用对照组与处理组之间的差异表达倍数Log2FC (fold change)值运用TBtools 工具绘制热图。
1.7 不同处理下GuAQPs 表达分析
GuAQPs基因家族的CDS 序列从甘草数据库中获得,qRT-PCR 所用引物由生工生物工程股份有限公司(上海)设计并合成(表1)。甘草RNA 的提取采用多糖多酚植物RNA 提取试剂盒(天根,北京),用琼脂糖凝胶电泳法和NanoDrop One 核酸蛋白浓度检测仪(赛默飞)检测RNA 质量和浓度。采用FastKing RT Kit (With gDNase)试剂盒(天根,北京)合成互补DNA 的第一链(cDNA),采用SuperReal PreMix Plus(SYBR Green)试剂盒(天根,北京) 和qTOWER2.0实时PCR 系统(德国)进行qRT-PCR。Actin为内参基因[23],采用2-ΔΔCT计算GuAQPs基因相对表达量[24]。

表1 本研究中所用的引物Table 1 Primers used in this study
1.8 数据处理
数据统计与整理使用Excel 2013,方差分析和显著性检验采用SPSS 26,并使用Graphpad 8.0 绘图。
2 结果与分析
2.1 GuAQPs 基因的鉴定和系统进化分析
利用Pfam 从初步得到的甘草AQPs 中进一步筛选出具有水通道蛋白典型保守结构域MIP 的蛋白(图1),最终从甘草全基因组中鉴定到43 个AQPs家族成员(GuAQPs),通过与拟南芥AQPs 蛋白多序列比对,将43 个GuAQPs 分为4 类,包括11 个PIPs、15 个TIPs、11 个NIPs 以 及6 个SIPs,其 中PIPs 亚家族被聚类为PIPs1 和PIPs2 两个分支(图2)。依据此结果,参考其他植物水通道蛋白命名法,对其命名如表2 所示。

图2 拟南芥和甘草AQPs 家族成员系统进化树Figure 2 Phylogenetic tree of AQPs of Arabidopsis thaliana and Glycyrrhiza uralensis
2.2 GuAQPs 蛋白特征与保守性氨基酸残基的分析
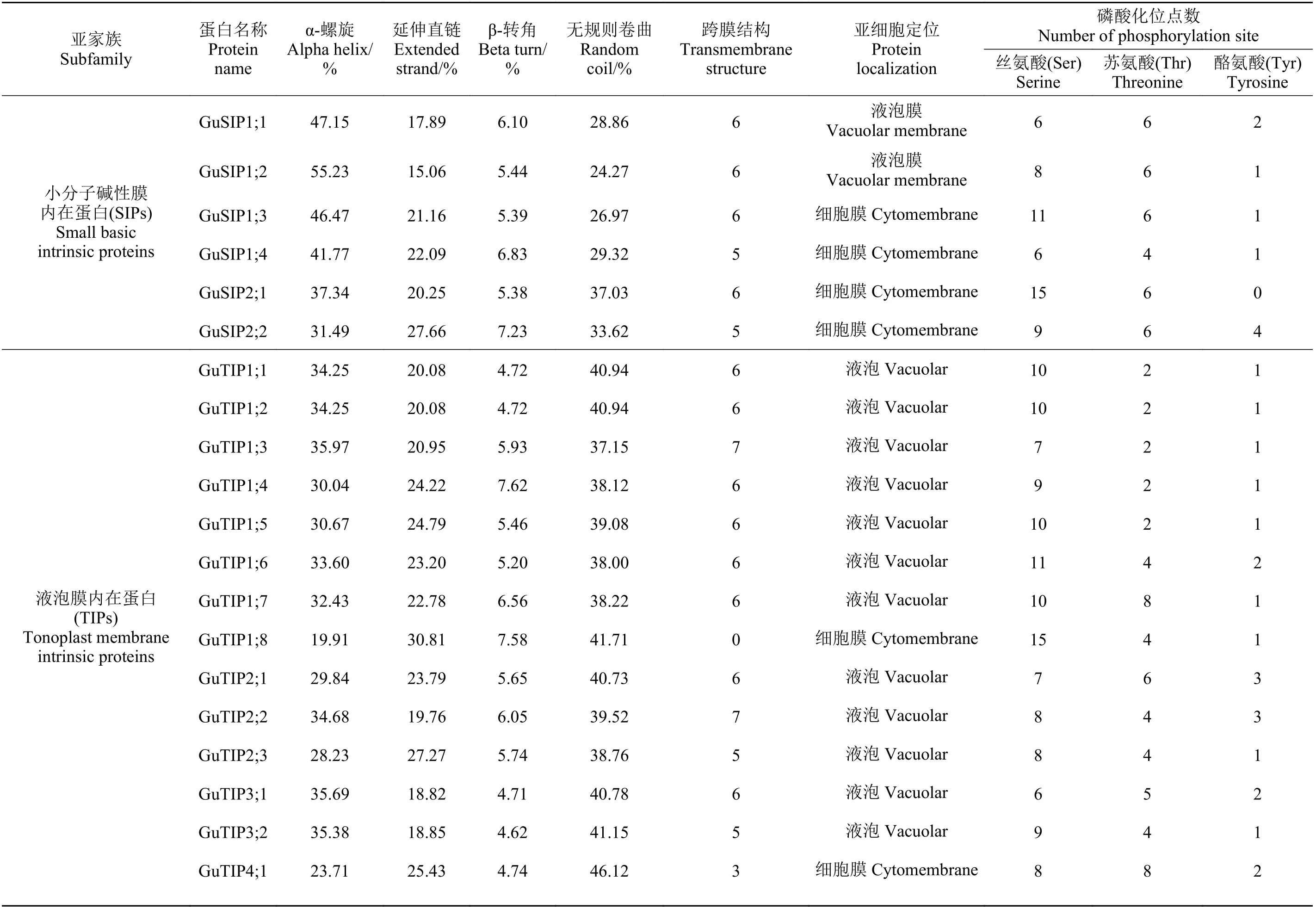
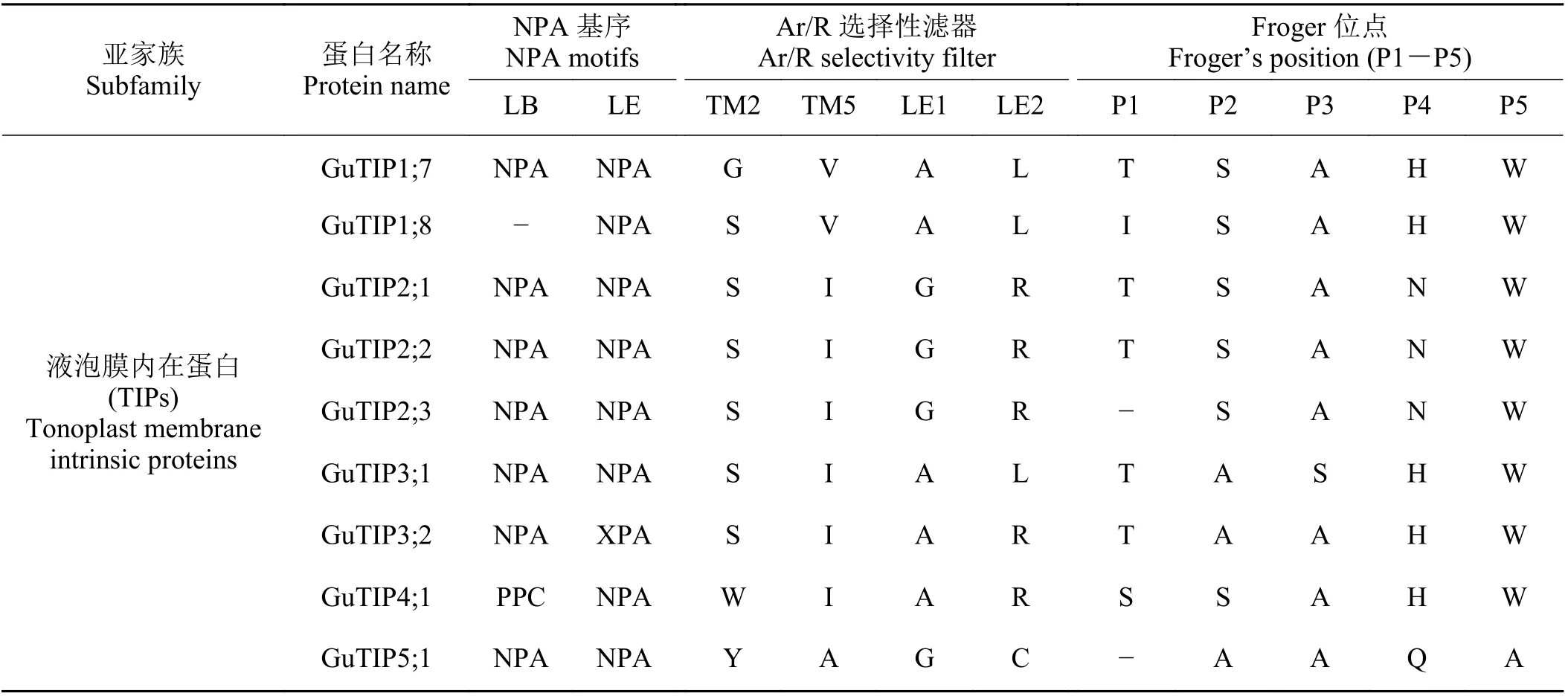
GuAQPs 蛋白氨基酸长度介于106 (GuPIP2;6)~789 aa (GuPIP7;1) (表2),其分子量大小介于11.28(GuPIP2;6)~87.82 kD (GuPIP7;1)。等电点(pI) 值最大为10.09 (GuSIP1;3),最小为4.46 (GuTIP2;3)。TIPs亚家族中除GuTIP3;2 和GuTIP4;1 外,其等电点均小于7。不稳定系数除GuTIP5;1 外均小于40,脂肪系数都在100 左右,总平均亲水性除GuNIP7;1 和GuTIP1;8 外均大于0,说明GuAQPs 多为疏水性稳定蛋白。GuAQPs 二级结构和亚细胞定位及磷酸化位点预测表明(表3),甘草TIPs 亚家族大多定位于液泡,NIPs、PIPs 和SIPs 亚家族大多定位于细胞膜,其中GuNIP7;1 定位于叶绿体膜。GuAQPs 蛋白二级结构中α-螺旋所占比例介于19.91%~55.23%,β-转角介于2.09%~8.33%,无规则卷曲介于24.27%~50.94%。磷酸化位点预测显示,GuAQPs 蛋白磷酸化位点发生在丝氨酸(serine, Ser)、苏氨酸(threonine,Thr)以及酪氨酸(tyrosine, Tyr) 3 种氨基酸残基上,其中发生在丝氨酸(Ser)位点的磷酸化个数较其他两个氨基酸残基多。GuAQPs 一般具有6 个左右的跨膜结构(表3),其中GuNIP2;1 含有12 个,GuTIP1;8不含跨膜结构。另外,GuAQPs 的Ar/R 滤器及P1-P5 的氨基酸残基以及LB 和LE 的两个NPA 基序均具有一定的保守性(表4)。

表2 GuAQPs 家族理化性质Table 2 Physicochemical properties of GuAQPs family genes

续表2Table 2 (Continued)

表3 GuAQPs 二级结构及磷酸化位点预测Table 3 Secondary structure and phosphorylation site prediction of GuAQPs
续表3Table 3 (Continued)

表4 GuAQPs 的NPA 基序、Ar/R 选择性滤器及Froger 位点氨基酸残基Table 4 NPA motifs and amino acid residues found in Ar/R selectivity filter and Froger’s position of GuAQPs
续表4Table 4 (Continued)
2.3 GuAQPs 基因结构和motif 分析
对GuAQPs基因家族成员的基因结构分析(图3 C),结果表明,GuAQPs基因家族的内含子有0~12个不等,除GuSIP1;3、GuSIP2;2和GuPIP2;6基因不含内含子外,其余40 个基因均具有内含子,多数含有2~4 个内含子,其中16 个基因含有两个内含子,11 个基因含有3 个内含子,5 个基因含有4 个内含子。进一步分析得GuNIP1;1、GuNIP1;2、GuNIP2;1、GuSIP2;1、GuSIP1;4和GuSIP1;1具有较长内含子,整体看,甘草PIPs 和TIPs 亚家族基因长度均在4 000 bp 以内,比NIPs 和SIPs 亚家族短。
通过MEME 在线工具对GuAQPs 进行Motif分析(图3B),结果表明,同一亚家族Motif 的分布较为一致,SIPs 亚家族所含Motif 数量最少,平均5 个Motif,另外3 个亚家族都含有较多的Motif,平均8~9 个Motif。进一步分析得出(图3D),93%的GuAQPs 都含有质膜水通道蛋白的特征信号序列TGINPARSLGAA (用 红 框 标 出),76.7% 的GuAQPs都含有MIP 家族的信号序列SGXHXNPAVT (用蓝框标出)。Motif 3 和Motif 9 为PIPs 亚家族特有基序,并且PIPs 亚家族不含Motif 7。此外,每个亚家族的保守基序在种类和所在位置上保持高度相似,从侧面印证了系统发育分析的可靠性,而存在于不同亚家族之间特异的保守基序可能与GuAQPs 功能的多样性有关。

图3 GuAQPs 基因家族系统发育树(A)、保守基序分布(B)、基因结构(C)和保守氨基酸序列(D)Figure 3 Phylogenetic tree (A), conserved motif distribution (B), gene structure (C),and conserved amino acid sequence (D) of GuAQPs family genes
2.4 GuAQPs 启动子顺式作用元件及转录组基因表达模式分析
利用Plant CARE 对启动子前2 000 bp 序列进行分析(图4A),检测到多种与植物生长、激素以及环境相关的顺式作用元件。将近97%的GuAQPs都参与光应答,含有与厌氧诱导、栅栏叶肉细胞分化调控、分生组织调控、胚乳应答及细胞周期调控有关的GuAQPs分别占88%、9%、49%、27%和6%;能响应ABA、茉莉酸甲酯(methyl jasmonate, MeJA)、水杨酸(salicylic acid, SA)、赤霉素(gibberellin, GA)和生长素(auxin, IAA)的GuAQPs分别占总GuAQPs的81%、60%、56%、44% 和23%;近32% 和39% 的GuAQPs分别参与低温应答和防御和胁迫应答。除此之外,TIPs 亚家族所含有的元件数相对其他家族多,PIPs亚家族含有较多低温响应元件,SIPs 亚家族所含元件种类和数量都最少。
GuAQPs基因在干旱胁迫后地上部分上调表达基因有27 个,3 个基因下调表达(图4B),地下部分有13 个基因上调表达,下调表达基因有16 个。在盐胁迫下地上部分有17 个基因上调表达,4 个下调表达。地下部分有13 个基因上调,11 个表达下调。GuNIP4;2、GuNIP7;1、GuSIP2;1、GuTIP1;1、GuTIP1;4、GuTIP1;5、GuTIP1;8、GuTIP3;1和GuTIP5;1这9 个基因在干旱和盐胁迫下其表达量在地下部分中都没有显著变化(P >0.05)。其中GuNIP1;1、GuNIP1;2及GuTIP3;2在PEG 处理下地上部分表达量显著升高(P< 0.05),GuTIP1;1和GuTIP1;2所含启动子种类和数目差不多,但GuTIP1;2在盐处理和干旱处理下表达较为显著(P< 0.05),这可能和GuTIP1;2含有一个响应防御和胁迫的元件有关。
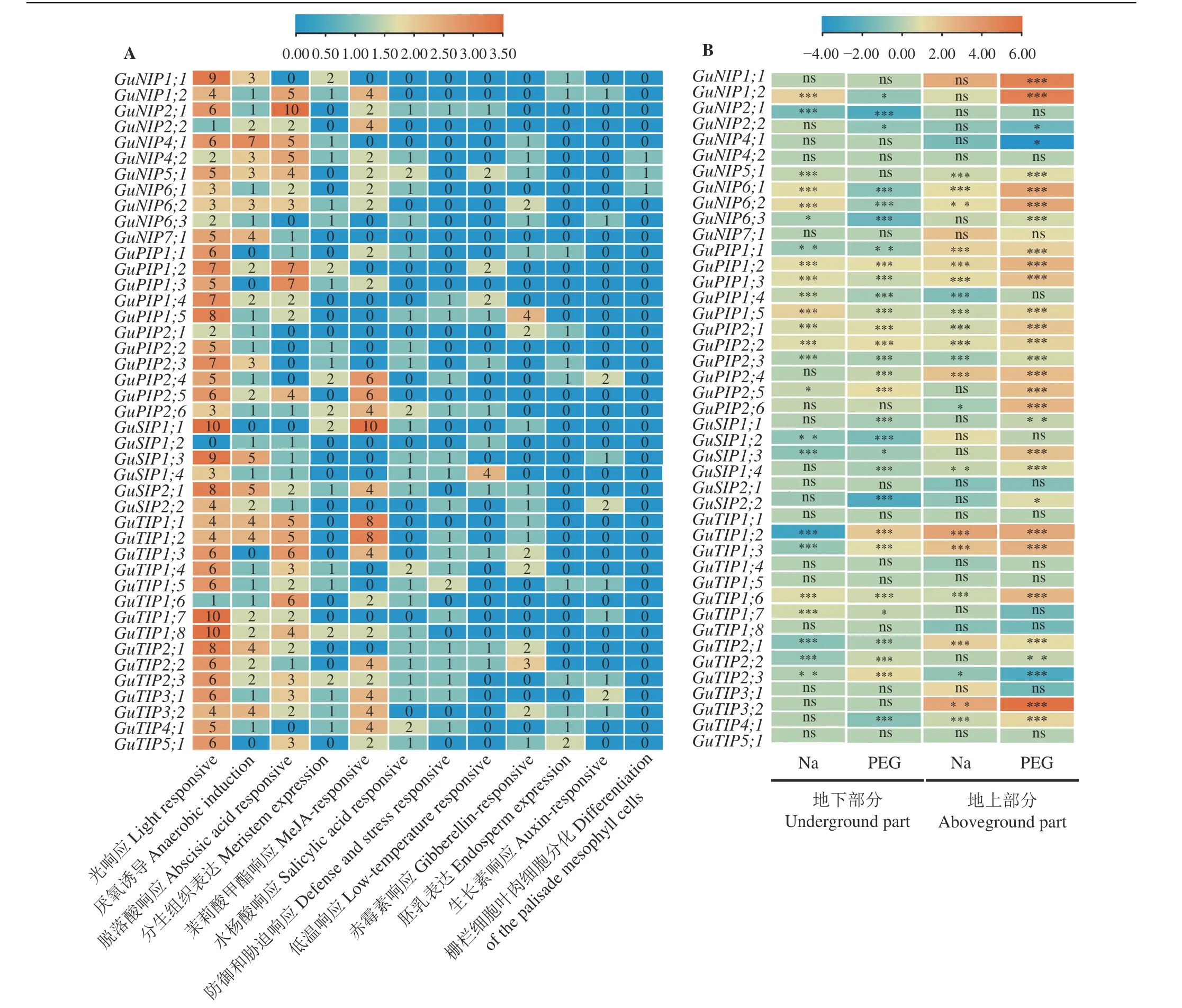
图4 GuAQPs 基因启动子顺式作用元件分析及逆境处理下的表达Figure 4 Cis-acting element analysis of GuAQPs gene promoters and their expression under stress treatment
2.5 不同处理下6 个GuAQPs 基因表达分析
6 个GuAQPs基因在不同处理下表达表明(图5、图6),在干旱处理24 h 后GuTIP2;3在叶和根中都显著上调表达(P< 0.05),48 h 只在叶中表达上调;在干旱处理7 d 后GuSIP1;4在根和叶中均显著上调表达,而GuPIP2;3只在叶中显著上调表达。
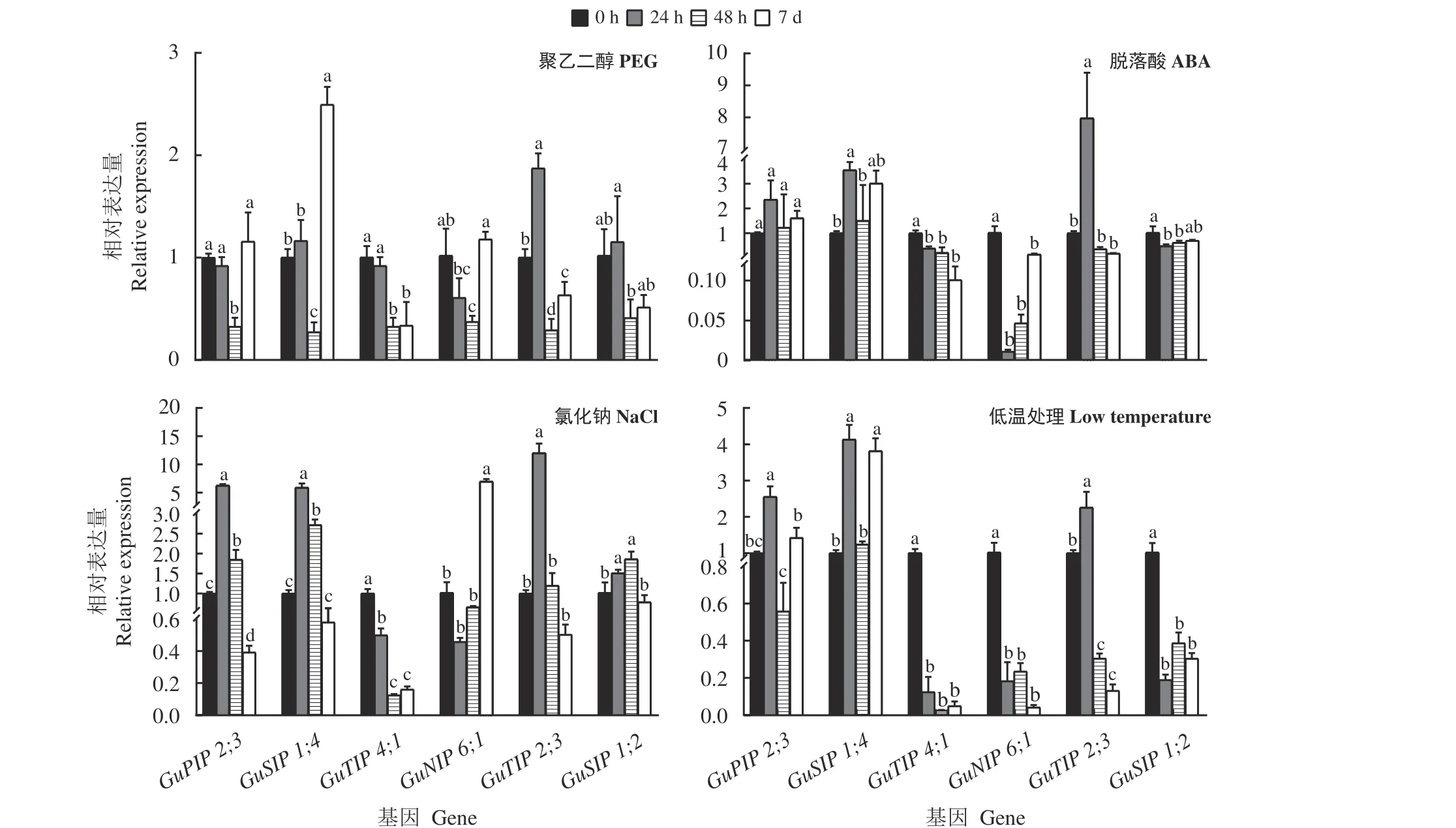
图5 不同处理下根中GuAQPs 的相对表达量Figure 5 Relative expression levels of GuAQPs in roots under different treatments

图6 不同处理下叶中GuAQPs 的相对表达量Figure 6 Relative expression levels of GuAQPs in leaves under different treatments
ABA 处理24 h 后GuSIP1;4和GuTIP2;3在根中显著上调表达(P< 0.05),而在48 h 后GuSIP1;4、GuTIP4;1、GuTIP2;3和GuSIP1;2在叶中显著上调表达;GuPIP2;3在ABA 处理7 d 后叶中显著表达。
盐胁迫处理下24 和48 h 后GuSIP1;4根和叶中都显著上调表达(P< 0.05),GuPIP2;3盐胁迫处理下24 h 后在根和叶中显著上调表达,而48 h 后只在根中显著上调表达;盐处理7 d 后GuSIP1;2和GuNIP6;1在叶中显著上调表达,其中GuNIP6;1在根中也显著上调表达;GuTIP2;3在盐处理24 h 根中显著上调表达,而GuTIP4;1根中的表达量在盐处理48 h 和7 d后显著下调表达。
低温处理下24 和48 h 后在叶中除GuSIP1;4外,其余5 条基因都显著下调表达(P< 0.05);根中GuTIP4;1、GuNIP6;1、GuTIP2;3和GuSIP1;2在48 h和7 d 时都显著下调表达,而GuSIP1;4在24 h 和7 d时在根中显著上调表达。
3 讨论
AQPs 作为膜蛋白,可促进水和其他溶质在植物细胞膜上快速选择性转运,参与植物种子萌发、气孔运动、光合作用以及细胞伸长等生理过程[1]。本研究通过生物信息学分析,共鉴定出43 个GuAQPs基因家族成员,聚类为4 个亚家族,其中甘草TIPs亚组成员与拟南芥及其他植物TIPs 氨基酸序列平均长度最短、等电点值相对较低的特点相似,这可能和TIPs 亚组的C 端较短有关[25]。AQPs 亚细胞多定位于细胞膜,而GuNIP7;1 定位于叶绿体膜,推测GuNIP7;1 主要参与CO2的转运[26]。系统发育树结果显示,与单个物种的所有AQPs 序列相比,不同物种同一亚组的序列相似性更高,说明AQPs 的4 个亚组在高等植物分化之前就已经进化形成。有研究表明缺硼条件下AtNIP5;1 在拟南芥对硼酸的有效摄取中发挥重要作用[19],GuNIP5;1 与其有较短的遗传距离,推测GuNIP5;1 可能与AtNIP5;1 具有类似的生理功能。NPA 基序、Ar/R 过滤器及Froger 的5 个位置是AQPs 最显著的结构特征,在选择性运输物质的过程中扮演重要的角色[27]。在本研究中大多数GuAQPs 均具有双重典型的NPA 基序,但个别成员该基序的一个或两个氨基酸残基被其他氨基酸替换,推测不同物种对底物选择性具有一定差异。磷酸化能有效调控蛋白质活力和功能,植物AQPs 的磷酸化主要发生于N 端或C 端的丝氨酸上残基上[28],GuAQPs 在丝氨酸残基处有较多的磷酸化位点,说明甘草在受胁迫时丝氨酸磷酸化可能在增强GuAQPs 调控途径中更容易起作用。
ABA 是一种内源性信号分子,在调控蒸腾作用和脱水耐受性等与水分状态相关的过程中扮演关键角色[29]。本研究结果显示,GuAQPs基因含有众多激素响应元件,尤其是ABA 响应元件,而有研究表明干旱胁迫能响应ABRE 和MBS 顺式作用元件,其参与ABA 介导的渗透胁迫信号通路[30],如Zhou 等[31]PEG 处理诱导TaAQP7的上调表达可能与内源性ABA 信号通路有关。除此之外,PEG 处理后水稻OsPIP1;3基因通过ABA 独立的途径被诱导表达,在该基因的启动子区域发现DRE/CRT 盒,因此该基因上调表达可能是由于ABA 作用于DRE/CRT元件的结果[32]。研究显示,植物叶片中的AQPs上调表达使叶中AQPs 活性增强,其转运CO2能力变强,光合底物浓度升高,从而能提高光合速率[33]。本研究中GuTIP2;3分别在干旱和ABA 处理后叶中都上调表达,推测甘草在干旱胁迫下释放ABA,通过与AREB 互作,诱导其表达,进而在叶片光合作用中发挥作用。盐胁迫是水胁迫和离子胁迫的叠加,钾作为最丰富的细胞阳离子,在维持细胞膨压和膜电位中起着关键作用,因此植物在遭受Na+胁迫时,钠钾离子吸收系统便遭到破坏,导致液泡水分流失,从而使植物生长受到抑制[34]。有研究发现拟南芥TIP2;2的缺失使得离子泄漏,导致其对非生物胁迫的敏感性较低[35];Gao 等[36]在拟南芥中过表达TaNIP提高了K+/Na+,进而维持转基因植株低Na+、高K+的离子状态,从而可以提高耐盐性,说明AQPs 可以通过参与改善离子分布以及维持渗透平衡来提高植物对胁迫条件的抗性[37]。GuPIP2;3、GuSIP1;4、GuNIP6;1及GuTIP2;3等在盐胁迫处理后在根中上调表达,推测甘草根可能通过调节这4 个基因的表达影响离子稳定系统,进而改变溶质浓度来调控细胞含水量用以抵御盐胁迫。有研究表明,AQPs中PIPs和TIPs亚家族基因在高盐分胁迫中起主导作用[38],而本研究转录组数据显示盐胁迫处理后甘草地上部分上调表达的基因中PIPs 亚家族占多数,说明甘草PIPs 亚家族基因可能对响应盐胁迫也有类似的作用。
温度是影响植物根系生理功能的重要因素之一,低温会降低根系对水分的吸收,导致地上部分水分亏缺[39]。有研究表明小麦(Triticum aestivum)TaAQP7[31]和水稻OsPIP2;7[40]等在低温处理后被显著诱导表达,这些上调的AQPs基因对寒冷的反应可能是由细胞水运动所驱动,在参与水的快速运输和维持细胞内的水平衡中发挥作用,从而增强对低温的耐受性[34]。Narusaka 等[41]在拟南芥rd29A的启动子区域发现LTRE 元件,阐明其在调控低温诱导启动子表达的过程中起关键作用;Deokar 和Tar’an[42]发现鹰嘴豆(Cicer arietinum)在低温处理下CaTIP1-1、CaTIP4-2及CaPIP2-3的高表 达与启动子序列含有LTR 元件有关,在本研究中GuSIP1;4经低温处理后其在根中的表达量显著上升,这可能与GuSIP1;4基因含有多个低温响应元件有关,说明AQPs 可能通过提高水分运输,调节根系导水率,从而帮助甘草抵御冷害。
水通道蛋白作为重要的膜功能性蛋白,近年来对其的研究也备受关注,随着越来越多植物AQPs被分离鉴定,其功能和作用也较为广泛深入地被发现。研究表明,植物AQPs 在根和叶的水力调控中起着关键作用,其在植物组织生长,种子萌发以及花粉发育和授粉等生理和发育过程中的调节作用已经被证实[3]。不仅如此,AQPs 还通过渗透势梯度介导水跨膜的运输参与植物对各种环境胁迫的响应,如干旱、涝害、盐度和重金属及养分亏缺等[43]。植物通过调控基因表达、四聚化、pH、活性氧(reactive oxygen species,ROS)、植物激素和其他化学物质等不同机制调节AQPs,以维持其体内水分的吸收和运输,进而使得植物能在不同环境下正常生长[44]。目前,随着全球环境条件不断恶化,尤其是干旱和土壤盐碱化的加剧,使得甘草的种植和生产面临困难,因此,对于解析GuAQPs 控制水分平衡的机理还有待后续进一步深入研究。
4 结论
综上所述,本研究运用生物信息学和qRT-PCR的方法对甘草AQPs基因家族进行分析,qRT-PCR结果表明GuTIP2;3基因在叶中能显著响应干旱和ABA 处理,甘草根在盐胁迫下GuPIP2;3、GuSIP1;4、GuNIP6;1和GuTIP2;3都被诱导表达,其可能对甘草所受盐胁迫有缓解作用。此外GuSIP1;4在低温下表达量上升,推测其可能对甘草抵御寒害起一定作用。因此,GuAQPs在遭受非生物胁迫时可通过调节自身表达情况来应对干旱、盐以及冷害等环境胁迫。本研究结果为后续研究甘草AQPs基因的功能、更深入阐述甘草AQPs 维持水分平衡的作用机制提供了基础资料。

