超高压制备黑茶多糖铁的化学组成与结构特性
贾时荣,何 洪,安风平,曾绍校,王艺伟,宋洪波
(1.福建农林大学 食品科学学院,福建 福州 350002;2.福建省特种淀粉品质科学与加工技术重点实验室,福建 福州 350002)
铁是一种重要的人体所需矿物质,在代谢过程和免疫功能方面发挥重要作用[1]。缺铁可导致缺铁性贫血或功能障碍,在所有年龄人群中均较普遍[2],通常由于缺铁、难以吸收铁或大量流失所致[3]。目前,无机铁(如硫酸亚铁等)是常用的铁补充剂,但易产生脂质过氧化和胃肠道副作用[4-5]。因此,有机铁补充剂的研究受到关注,如多糖铁、多肽铁、氨基酸铁、血红素铁、富铁酵母等,主要以分子形式吸收,避免了铁离子导致的脂质过氧化和胃肠道副作用[4,6]。多糖易与铁离子作用形成复合物,不仅具有有机铁的优点,还保留了多糖的部分生物活性[7]。多糖铁复合物的化学组成及其结构是消化吸收的基础,此方面的研究鲜见报道。
有研究表明,超高压处理可以改变蛋白质、淀粉等生物大分子结构[8],用于制备莲子直链淀粉-脂肪酸复合物取得良好效果[9],这为超高压制备多糖铁复合物提供了可能性。黑茶属后发酵茶,通常选择成熟度较高的鲜叶加工,具有老茶的特点[10],其多糖含量普遍高于新叶[11]。因此,以黑茶多糖为基础材料,研究超高压制备黑茶多糖铁复合物的化学组成与结构特性,为进一步研究其消化利用奠定基础。
1 材料和方法
1.1 材料与试剂
原料:黑茶,中茶湖南安化第一茶厂有限公司提供。
试剂:FeCl3、NaOH、无水乙醇、K4[Fe(CN)6]、苯酚、硫酸、考马斯亮蓝G-250、盐酸、醋酸、邻菲罗啉、柠檬酸三钠、盐酸羟胺、三氟乙酸、PVP-P、Na2CO3,分析纯,国药集团化学试剂有限公司提供;没食子酸、PMP、乙腈、氯仿、ACS,上海阿拉丁生物科技有限公司提供;福林酚、牛血清蛋白(BSA)、3 500 U透析袋、葡萄糖标品,北京索莱宝生化技术公司提供;鼠李糖、阿拉伯糖、甘露糖、岩藻糖、半乳糖、半乳糖醛酸、葡萄糖醛酸、核糖,上海源叶生物科技有限公司提供;木糖、葡萄糖,北京坛墨质检科技有限公司提供。
1.2 仪器与设备
JHBE-20A型闪式提取仪,上海钒帜精密设备有限公司产品;5L-HPP600 MPa型静态超高压设备,包头科发高压科技有限责任公司产品;TGL-16型医用冷冻离心机,四川蜀科仪器有限公司产品;Agilent-1200型高效液相色谱,美国安捷伦科技公司产品;FTIR-8400S型傅立叶变换红外光谱仪、UV-1780型紫外分光光度计,日本岛津公司产品;TENSOR 27型X射线粉末衍射仪,德国布鲁克公司产品。
1.3 试验方法
1.3.1 黑茶多糖提取
将黑茶粉碎,过60目筛,料液比1∶55(W/V),闪式提取器电压170 V,提取107 s;以转速3 500 r/min离心10 min,乙醇沉淀10 h,净水复溶浓缩后冷冻干燥得黑茶粗多糖。取15 g粗多糖溶于300 mL水中,加3 g PVP-P搅拌10 min,于20℃下以转速3 500 r/min离心10 min,取上清液重复上述步骤3次,浓缩后3 500 U透析袋透析48 h,冷冻干燥得黑茶多糖(DTP)。
1.3.2 多糖铁复合物的制备
加热法制备黑茶多糖铁复合物(DTPIC-HW):取0.2 g DTP溶于10 mL水中,加入0.1 g柠檬酸三钠,用HCl和NaOH调节pH值至8,按质量比1.7∶1加入浓度为0.89 mmol/mL的FeCL3溶液,于60℃水浴中振荡反应1 h,以转速7 000 r/min离心10 min;4倍量乙醇沉淀1 h,以转速3 500 r/min离心10 min,加水复溶后3 500 U透析袋透析48 h,冷冻干燥。
超高压法制备黑茶多糖铁复合物(DTPIC-HP):有别于加热法,反应过程是将待处理溶液装入塑料袋密封,于超高压设备中425 MPa处理22 min。其他步骤同上。
1.3.3 多糖铁复合物成分测定
(1)定性分析。参考2015版《中华人民共和国药典(四部)》,取适量茶多糖粉末,加水配制1 mg/mL溶液,将FeCl3(2 mol/L)溶液滴加至沸腾水中直至变为红棕色,得到Fe(OH)3溶胶;取1 mL待测样品溶液,一式3份,分别用NaOH溶液、无水乙醇、K4[Fe(CN)6]溶液进行鉴定。
(2)化学成分测定。中性糖:采用苯酚-浓硫酸法[12]测定多糖得率,以中性糖含量为考查指标。铁:采用Lu Q等人[13]的方法稍作修改。取0.01 g样品溶于质量分数为0.6%的HCl溶液50 mL中,取1 mL溶液置于25 mL具塞试管中,依次加入质量分数为5%的HCl液1 mL和质量分数为10%的盐酸羟胺溶液1 mL,室温反应1 h;再加入质量分数为0.15%的邻菲罗啉2 mL和质量分数为10%的醋酸钠溶液5 mL,加入适量去离子水使溶液总体积为25 mL,室温反应15 min。于波长510 nm处测定溶液吸光度,根据标准曲线(Y=0.008 4X-0.004 8;R2=0.999 3)计算铁离子含量。糖醛酸:采用间羟基联苯法[14],以半乳糖醛酸为标准品,于波长520 nm处测定溶液吸光度,根据标准曲线(Y=0.007 4X+0.019 7;R2=0.995 7)计算糖醛酸含量。蛋白质的测定采用Bradford法[15],以牛血清蛋白为标准品,于波长595 nm处测定吸光度,依据标准曲线(Y=0.005 4X+0.009 4;R2=0.991 5)计算蛋白质含量。多酚的测定采用福林酚法[16],以没食子酸为标准品,于波长765 nm处测定吸光度,根据标准曲线(Y=0.009 5X+0.027 3;R2=0.997 8)计多酚含量。
1.3.4 结构表征
(1)单糖组成的测定。采用高效液相色谱法测定。取15 mg样品于水解管中,加入浓度为4 mol/L的TFA(三氟乙酸)溶液1 mL,于120℃下加热水解2 h;用氮气吹干,加入浓度为0.5 mol/L PMP-甲醇溶液1 mL及浓度为0.3 mol/L的NaOH溶液0.5 mL,70℃水浴加热60 min,冷却;再加入浓度为0.3 mol/L的HCl溶液0.5 mL和氯仿0.5 mL,振荡后静置20 min,弃去有机层,萃取3次,取水层过滤膜。色谱条件:SHISEIDO C18柱(4.6 mm×250 mm,5 μm),流动相0.1 mol/L KH2PO4(pH值6.8)/乙腈=82/18,流速1.0 mL/min,柱温25℃进样量10 μL,于波长245 nm处测定吸光度。
(2)红外光谱(FTIR)分析。称取5 mg样品与500 mg KBr混合,充分研磨后压片,傅立叶红外光谱仪进行定性检测。以4 cm-1的分辨率,4 000~400 cm-1的波数扫描32次。
(3)X-射线衍射(XRD)分析。称取50 mg样品进行X-射线衍射扫描。Cuk-α为X射线源,0.02°步长,2θ=5~90°范围内进行扫描。
1.4 数据处理
采用SPSS(17.0)软件,数据通过One-way ANOVA方差分析进行统计学比较,采用邓肯法进行事后检验,p<0.05具有显著性差异,结果以“平均值±标准差”表示。
2 结果与分析
2.1 定性分析
黑茶多糖铁的定性分析见表1。

表1 黑茶多糖铁的定性分析
由表1可知,将DTPIC-HW和DTPIC-HP溶于水后呈淡黄色,而Fe(OH)3溶液则为红棕色。加入NaOH后,DTPIC-HW和DTPIC-HP溶液无沉淀,而Fe(OH)3溶液产生沉淀,这反映了多糖和Fe(OH)3在碱性条件下的应有性质;加入无水乙醇后,DTPIC-HW和DTPIC-HP均产生沉淀,而Fe(OH)3未发生沉淀现象,说明DTPIC-HW和DTPIC-HP仍具有多糖的性质;加入K4Fe(CN)6后,DTPIC-HW和DTPIC-HP未发生明显的颜色变化,而Fe(OH)3生成了蓝色沉淀,说明2种黑茶多糖水溶液中均不存在游离Fe3+。
2.2 化学成分分析
黑茶多糖铁化学成分分析见表2。

表2 黑茶多糖铁化学成分分析
由表2可知,DTP中含有中性糖、糖醛酸,少量的蛋白质和多酚。DTPIC-HW和DTPIC-HP中的主要成分是中性糖、糖醛酸和铁,这是因为在制备过程中碱性条件使DTP中的多酚、蛋白与铁离子形成沉淀,在后续醇沉和透析被去除。与DTP相比,2种多糖铁中的中性糖和糖醛酸含量均显著降低,主要原因一方面是由于多糖铁中含有一定量的铁,使样品中的中性糖和糖醛酸相对含量降低;另一方面由于水分子参与复合物中“铁核”的形成,产物中引入了一定量的结合水,也使得等质量样品中的中性糖含量降低[17]。DTP中的中性糖与糖醛酸的比例为2.53,而DTPIC-HW中的中性糖与糖醛酸的比例为8.4,表明其中的糖醛酸明显减少,是由于热碱性条件下糖醛酸与铁离子相互作用造成的[18];DTPIC-HP中的中性糖与糖醛酸比例为2.15,铁含量显著高于DTPIC-HW中的(p<0.05),说明常温超高处理使得更多的铁与中性糖及糖醛酸结合。
2.3 单糖组成分析
黑茶多糖及不同黑茶多糖铁的单糖组成分析见表3。

表3 黑茶多糖及不同黑茶多糖铁的单糖组成分析
由表3可知,茶多糖及多糖铁均含有岩藻糖、阿拉伯糖、半乳糖、葡萄糖、木糖、甘露糖、核糖、鼠李糖等中性多糖,半乳糖醛酸和葡萄糖醛酸等酸性多糖。与DTP相比,DTPIC-HW和DTPIC-HP中的单糖组成比例均发生不同程度变化,说明因加热或超高压制备方法的不同,茶多糖铁中的单糖组成比例亦产生差异。
黑茶多糖及不同黑茶多糖铁的典型单糖比值见表4。
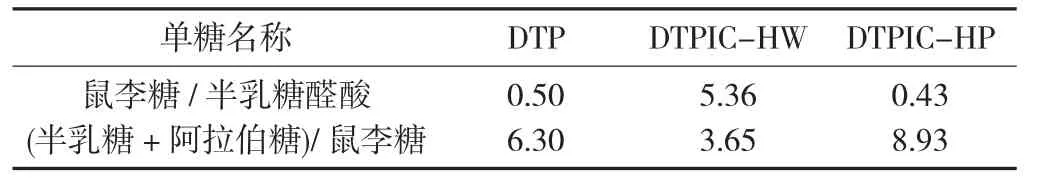
表4 黑茶多糖及不同黑茶多糖铁的典型单糖比值
由表4可知,DTP、DTPIC-HW和DTPIC-HP中典型单糖比值结果,用于判断样品是否含有RG-I结构并评估RG-I结构侧链长短。RG-I结构是植物酸性多糖的一种亚结构,鼠李糖与半乳糖醛酸的比值(即Rha/GalA)为0.05~1.00时表明包含这一结构[19];RG-I的侧链含有半乳糖和阿拉伯糖,而半乳糖与阿拉伯糖之和与鼠李糖的比值(即(Gal+Ara)/Rha)可评估RG-I的侧链长短[20]。结果表明,DTP中Rha/GalA为0.50,说明其含有RG-I结构,这与Chen G等人[21]对热水浸提法提取的黑茶多糖的试验结果(0.28~0.55)相符。DTPIC-HW中Rha/GalA为5.36,表明RG-I结构被破坏,可能是由糖链上的半乳糖醛酸与铁离子螯合导致的;(Gal+Ara)/Rha为3.65,表明加热法制备法使得多糖侧链变短。DTPIC-HP中Rha/GalA为0.43,说明超高压制备的茶多糖铁更好地保留了RG-I的结构;(Gal+Ara)/Rha为8.93,高于DTP,说明DTPIC-HP的RG-I结构上可能连接了更长的侧链。
2.4 红外光谱分析
黑茶多糖及不同黑茶多糖铁的FT-IR光谱图谱见图1。

图1 黑茶多糖及不同黑茶多糖铁的FT-IR光谱图谱
由图1可知,DTP、DTPIC-HW和DTPIC-HP均在3 397 cm-1处有吸收峰,为多糖羟基结构的伸缩振动[22]。2 930 cm-1和1 236 cm-1处产生的吸收峰为DTP中C-H结构的伸缩振动所致,而DTPIC-HW和DTPIC-HP图谱中此吸收峰强度不同程度减弱,且波数移至2 941 cm-1和1 258 cm-1,说明铁与多糖复合过程中影响了C-H的结合强度[23]。1 720 cm-1处吸收峰为DTP中COO-的特征吸收[24],而DTPIC-HP图谱中此吸收峰减弱,DTPIC-HW图谱中此峰消失;1 622 cm-1和1 419 cm-1处的吸收峰是DTP中C=O和C-O的伸缩振动[25],螯合铁后DTPIC-HW和DTPIC-HP中此2个特征峰均向低波数(1 607 cm-1和1 393 cm-1)偏移,表明羧基和羟基不同程度参与了铁离子与DTP的结合。1 088 cm-1和901 cm-1处的吸收峰是DTP中C-O-C伸缩振动和C-C伸缩振动[26],而DTPIC-HW和DTPIC-HP中这2个特征峰均发生了偏移(1 074 cm-1和918 cm-1)。在指纹区(1 000~400 cm-1),DTPIC-HW和DTPIC-HP出现了2个新的吸收峰(853 cm-1和692 cm-1),这是β-FeOOH的特征峰[27],表明铁与DTP螯合成功,并且以β-FOOH的形式存在。
2.5 X-射线衍射分析
黑茶多糖及不同黑茶多糖铁的XRD图谱见图2。

图2 黑茶多糖及不同黑茶多糖铁的XRD图谱
由图2可知,3个样品在2θ=0~80°无明显的强吸收峰,说明茶多糖和茶多糖铁均无结晶区域,呈无定形态[28]。与DTP的图谱相比,DTPIC-HW和DTPIC-HP出现了凸起的衍射峰,特别是DTPIC-HP凸起衍射峰(5°<2θ<15°)较DTPIC-HW的凸起衍射峰(5°<2θ<25°)更窄、强度更大,一方面说明铁离子能够与茶多糖配位形成新的螯合物;另一方面也说明超高压较加热制备茶多糖铁中的铁离子在糖链上的分布更为集中。
3 结论
常温超高压法和加热法均可有效地将铁离子与黑茶多糖螯合,且不形成结晶区。DTPIC-HP中铁含量为16.73,显著高于DTPIC-HW的12.77%;前者的中性糖与糖醛酸比例为2.15,显著小于后者的8.40。黑茶多糖铁及黑茶多糖的单糖组成相同,但DTPIC-HW和DTPIC-HP中的单糖组成比例发生不同变化;DTPIC-HP的侧链长度有所增加,而DT PIC-HW的链长变短。由此表明,DTPIC-HP的化学组成和结构特性优于DTPIC-HW。
——α-葡萄糖醛酸酶的研究进展*

