啤酒基荧光碳点的绿色合成及其在Fe3+检测和细胞成像中的应用
胡金双,杨 熙,刘舒芹,杨升宏*
(1.齐鲁工业大学(山东省科学院)化学与化工学院 山东省分子工程重点实验室,山东 济南 250353;2.广东省科学院测试分析研究所(中国广州分析测试中心),广东 广州 510070)
三价铁离子(Fe3+)作为氧和电子的运输载体,与众多生理活动息息相关,不仅是氧化还原酶的辅助因子,同时还承担着转运血红蛋白的角色[1]。Fe3+缺乏时会引起贫血、神经损伤、免疫力下降等问题[2];而Fe3+浓度过高则会催化产生大量活性氧,降低细胞活力,破坏细胞的正常生理活动。同时,机体内Fe3+的浓度水平还与帕金森症、阿尔茨海默症等重大疾病息息相关[3]。因此,环境样品中Fe3+的准确分析和细胞内Fe3+的动态监测对于维护人体正常生理机能至关重要。Fe3+的传统检测方法主要有原子发射光谱法、原子吸收光谱法、电感耦合等离子体质谱法、电感耦合等离子体原子发射光谱法等[4],这些方法虽然都能实现Fe3+的准确测定,但大多需要复杂的专业操作过程、昂贵的大型设备,且无法实现细胞内Fe3+的动态监控。荧光分析法具有灵敏度高、成本低、操作简便的优势,不仅能够满足水体中Fe3+的准确分析,同时可实现细胞内Fe3+含量的实时监测,具有更为广泛的应用前景[5]。
荧光碳点(Carbon dots,CDs)作为碳纳米材料家族中一种新兴的环境友好型纳米材料,具有光稳定性优异、水溶性好、易于表面功能化、低毒性和生物相容性良好等优势[6],适用于作为荧光探针构建分析方法,以实现Fe3+的检测。荧光碳点合成的原料来源广泛,既可以是柠檬酸[7]等各种化学品,也可以是大蒜[8]、蜂蜜[9]甚至虾壳[10]等绿色天然原料。天然物质用于碳点制备具有成本低、污染小等优势,但在合成过程中大多仍需要使用强酸或强碱进行碳化[11]。因此,碳点绿色合成路线的开发和Fe3+荧光分析方法的构建具有重要意义。
啤酒是含有碳水化合物的饮品,主要以小麦麦芽和大麦麦芽为原料,啤酒中含有多种氨基酸、维生素、低分子糖、无机盐和各种酶[12],这些营养素易被人体吸收和利用。啤酒中的低分子糖和氨基酸也很容易被消化和吸收,从而在体内产生大量的热能,因此啤酒也被称为“液体面包”[13]。2012年,Chattopadhyay等[14]基于聚乙二醇在微波辐射下可产生焦糖化CDs,分析了不同含糖食品中的碳纳米粒子,发现含碳水化合物的食物可以作为原料用于CDs的合成。除此之外,Tan等[15]的研究证明啤酒对小鼠无明显的急性毒性。基于此,啤酒可直接作为一种绿色原料用于CDs的合成。考虑到啤酒的成分,其丰富的活性位点为产物在传感领域的应用提供了可能。
本研究以齐鲁工业大学自酿啤酒为碳源,利用一步溶剂热法制备了啤酒基荧光碳点(Q-CDs)。合成的啤酒基荧光碳点表现出发射波长随激发波长变化而变化的性质,最佳发射波长为475 nm,能够发出明亮的蓝色荧光。基于Fe3+对所制备碳点的荧光猝灭作用构建了高灵敏度、高特异性的Fe3+分析方法,并成功用于实际水样中Fe3+的定量分析。另外,所制备碳点具有良好的生物相容性和发光特性,可成功用于细胞成像。本研究为促进碳点的绿色合成以及新型分析方法的开发提供了新的思路。
1 实验部分
1.1 试剂与仪器
三价铁离子标准溶液(中国计量科学研究院)购自广州分析测试中心科力技术开发公司;齐鲁工业大学自酿啤酒购自齐鲁工业大学长清校区纳博士超市;艾尔啤酒、青岛啤酒和崂山啤酒购自当地超市;其它试剂均为分析纯,且使用时未进一步纯化。实验用水均为电阻率为18.25 MΩ·cm的超纯水。
Tecnai G2 F30透射电子显微镜(美国FEI);BI-200SM动态光散射粒度分析仪(美国Brookhaven);D8-ADVANCE X射线粉末衍射仪(德国Bruker);UV2800s紫外可见分光光度计(上海恒平科学仪器有限公司);F97 Pro荧光分光光度计(上海棱光科技有限公司);NEXUS 670傅里叶变换红外光谱(美国Nicolet);EscaLab Xi+X射线光电子能谱仪(美国Thermo Fisher Scientific);RT-6100酶标仪(深圳雷杜生命科学股份有限公司);Axioscope A 1 POL荧光显微镜(德国ZEISS)。
1.2 碳点的制备
以啤酒作为碳源,经水热处理制备水分散性CDs。将30 mL啤酒直接加入到容量为50 mL的反应釜中,放入烘箱,在200℃下高温高压反应5 h。反应结束后,待反应釜自然冷却至室温,将所得产物于12 000 r/min离心处理15 min后,上清液用透析膜(截留分子量:500 D)透析24 h,得到CDs溶液。50℃下真空干燥后得到的粉末即为啤酒基荧光碳点。
1.3 Fe3+的检测
室温下,将0.2 mL的CDs(250 μg·mL-1)溶液加入到2 mL pH 7.4的磷酸盐缓冲溶液(1 mmol/L)中,依次加入不同浓度的Fe3+,孵育5 min后,以400 nm激发波长测量475 nm处的荧光发射强度,建立标准曲线。采用相似的方法测定该探针对Mn2+、Cd2+、Zn2+、Co2+、Pb2+、Hg2+、Fe2+、Cr3+、Ag+、Cu2+、Ni+、Ca2+和Mg2+的选择性。以自来水、雨水、泉水为实际水样进行加标回收实验评估方法的可靠性。
1.4 细胞毒性及细胞成像
将Hela细胞在37℃及5%CO2的培养箱中培养,待其生长至一定密度,将细胞接种于96孔板,细胞悬浊液浓度为5×104/mL;然后置于培养箱中继续培养,待细胞完全贴壁后,在新鲜的培养基中加入不同质量浓度(0、10、100、200、400、600、800 μg/mL)的Q-CDs与Hela细胞共同培养16 h。培养结束后,每孔加入10 μL 5%的MTT(3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐)溶液,继续培养4 h后终止培养。吸去培养液后,每孔加入150 μL的二甲基亚砜,置摇床上低速振荡10 min,以使结晶物充分溶解。用酶标仪测定各孔的吸光度。
将Hela细胞接种于12孔板,置于培养箱中培养48 h;然后加入200 μg/mL Q-CDs共同孵育10 min后,加入不同浓度(0、15、50 μmol/L)的Fe3+,孵育10 min,使用pH 7.4的磷酸盐缓冲溶液冲洗3次,以荧光显微镜观察。
2 结果与讨论
2.1 碳点的表征
本研究以齐鲁工业大学啤酒(QUTB,酒精含量≥5.5%vol,原麦汁浓度13°P)、艾尔啤酒(NB,酒精含量≥3.8%vol,原麦汁浓度11.8°P)、青岛啤酒(TB,酒精含量≥4.7%vol,原麦汁浓度12°P)和崂山啤酒(LB,酒精含量≥4%vol,原麦汁浓度10°P)4种类型的啤酒为碳源合成了荧光碳点。这4种碳点具有类似的光谱性质,其荧光光谱如图1所示。制备的CDs溶液均表现为发射波长随激发波长改变而改变的性质。当激发波长在280~520 nm范围变化时,最大发射峰的位置从415 nm移至545 nm。以硫酸奎宁为参比(量子产率为54%),测量了合成CDs的荧光量子产率。结果表明以QUTB为原料制备的CDs具有最佳荧光性能,量子产率为4.56%,优于使用其他啤酒制备的CDs(2.89%、3.16%和2.87%)。推测基于QUTB合成的CDs的高量子产率归因于QUTB具有更高的酒精含量和原麦汁浓度。因此,最终选择基于QUTB合成的CDs(Q-CDs)进行进一步的表征和应用。
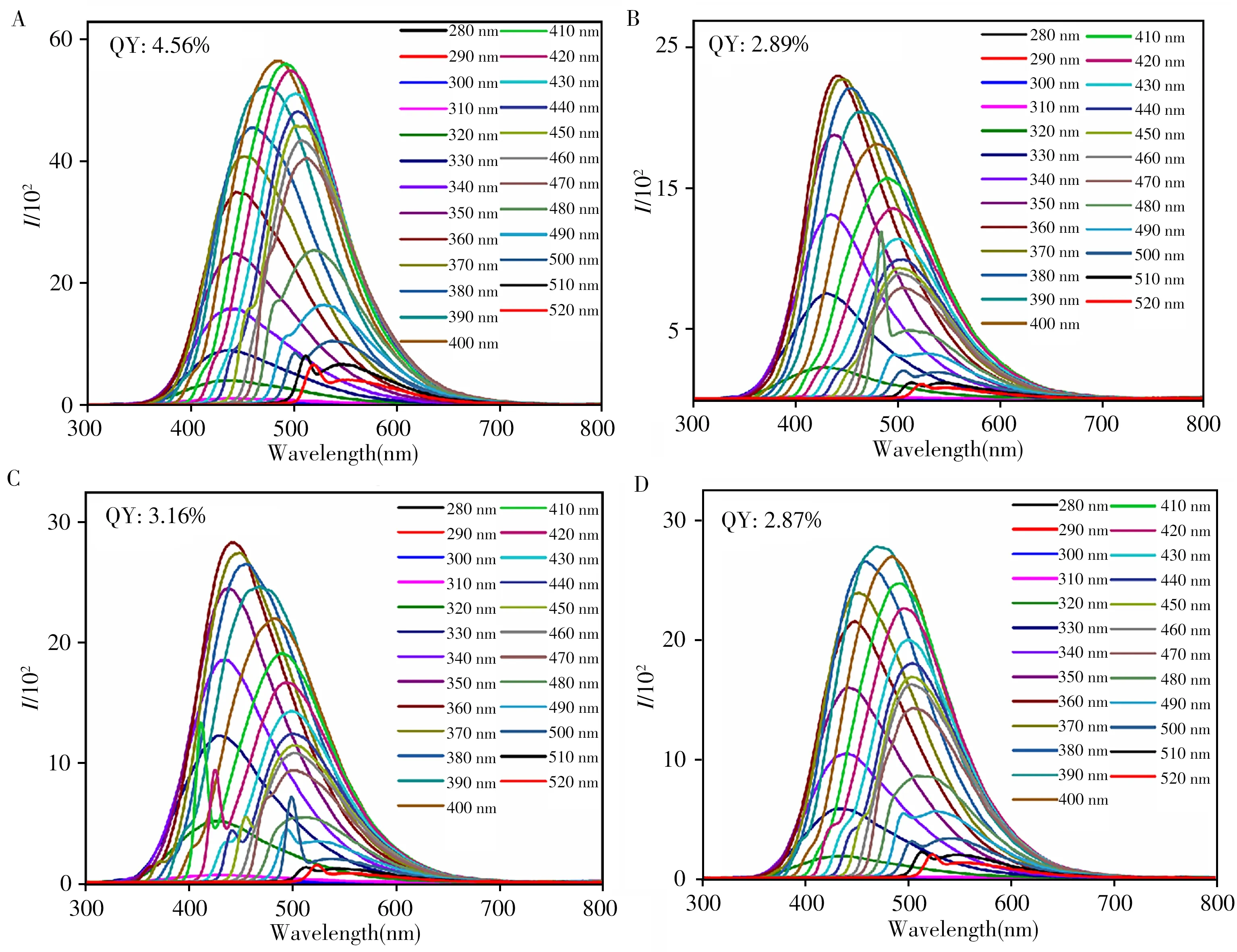
图1 利用不同原料制备的4种CDs的荧光光谱Fig.1 The fluorescence spectra of four kinds CDs by using different raw materials
Q-CDs的紫外-可见吸收光谱及荧光光谱如图2A所示。Q-CDs溶液在274 nm处的吸收峰由ππ*电子转移而产生[16]。Q-CDs的最佳激发波长为400 nm,发射波长为475 nm,可发出明亮的蓝色荧光,以下实验均在最佳激发波长下进行。使用透射电镜(TEM)对合成的Q-CDs的尺寸分布和形貌进行了表征。如图2B所示,Q-CDs为接近球形的单分散性纳米颗粒,其尺寸分布相对较窄(3~7 nm)。动态光散射(DLS)测量结果(图2C)进一步证明了Q-CDs的尺寸及单分散性,其平均直径为5.6 nm,与透射电镜的测量结果一致。从图2D中可以看出,Q-CDs的X射线粉末衍射图(XRD)在2θ=22°处有一个明显的碳特征衍射峰,表明Q-CDs具有无定形碳结构。
利用傅里叶变换红外光谱(FTIR)对Q-CDs的表面官能团进行表征。如图2E所示,O—H的伸缩振动吸收峰出现在3 214.7 cm-1处,2 931.2 cm-1处的吸收峰为饱和C—H键的伸缩振动峰,1 671.9 cm-1和1 598.6 cm-1处的吸收峰分别对应C==O和N—H的伸缩振动,1 401.9 cm-1处为C—N键的伸缩振动。通过X射线光电子能谱(XPS)进一步证实了Q-CDs的表面组成(图2F),其XPS光谱显示了C1s(285.3 eV)、N1s(399.3 eV)和O1s(531.4 eV)的3个典型峰。C1s的高分辨率XPS光谱(图2G)在284.7、286.4和288.2 eV处有3个峰,分别对应于C—C、C—N/C—O和C==O基团[17]。以上结果表明,Q-CDs表面含有大量的活性官能团。
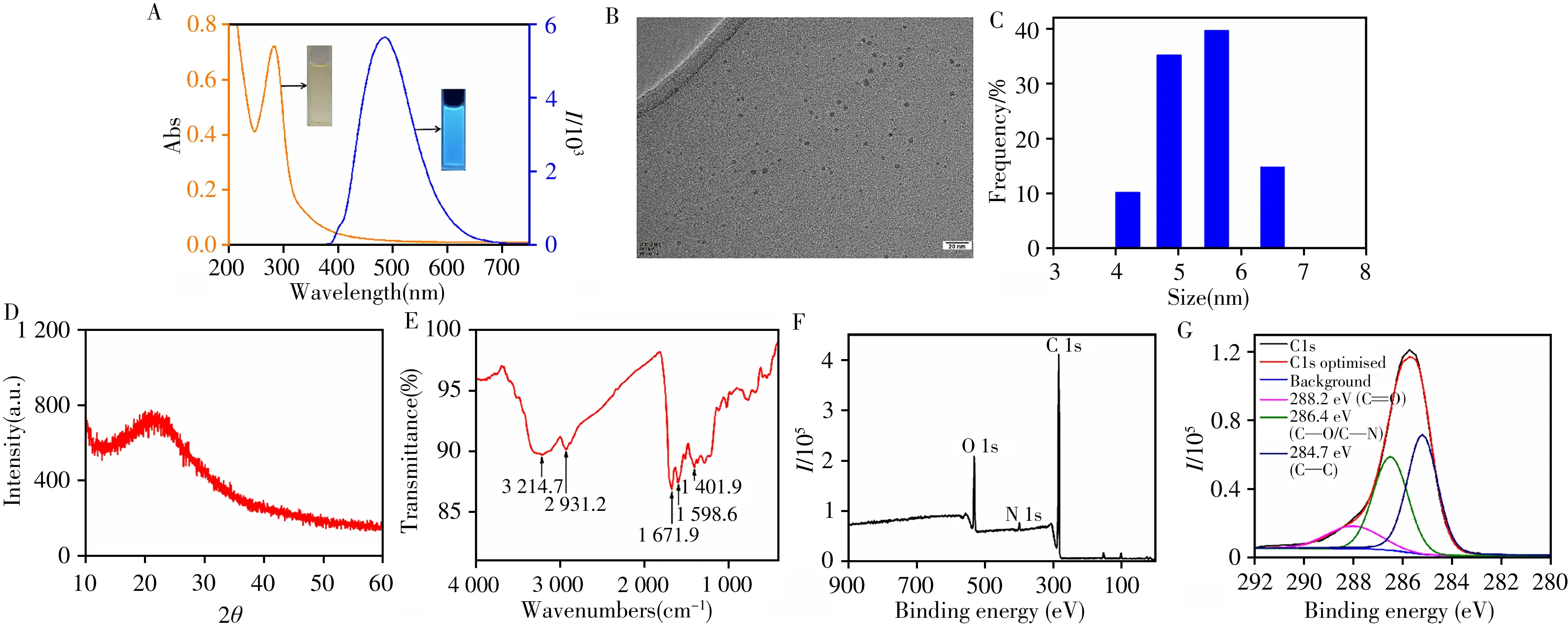
图2 Q-CDs的紫外-可见光谱图与荧光发射光谱图(A)、透射电镜图(B)、动态光散射图(C)、X射线粉末衍射图(D)、傅里叶变换红外光谱图(E)以及Q-CDs(F)和C1s(G)的X射线光电子能谱Fig.2 UV-Vis and fluorescence emission spectra(A),TEM spectrum(B),DLS spectrum(C),XRD spectrum(D),FTIR spectrum(E),and XPS spectra of the Q-CDs(F)and C1s(G)
2.2 Q-CDs的稳定性
为了评估Q-CDs用于分析检测的可能性,对其荧光稳定性进行了测试。首先,测试了不同pH值对Q-CDs荧光强度的影响。从图3A可以看出,Q-CDs的荧光强度在pH 3.0~12.0范围内较稳定,表明Q-CDs的荧光在一定程度上可以耐受酸碱变化。在365 nm紫外灯下对Q-CDs的光学稳定性进行了研究。连续扫描样品60 min,Q-CDs的荧光强度几乎没有变化(图3B);即使在紫外光连续照射6 h后,荧光强度下降也不到6%(图3C),表明Q-CDs具有较好的光学稳定性。最后考察了离子强度对Q-CDs荧光行为的影响(图3D)。在盐浓度高达0.5 mol/L时,荧光强度无明显变化,表明Q-CDs在高离子强度条件下仍具有较高的稳定性。以上结果表明Q-CDs稳定性良好,为其进一步在分析传感中的应用奠定了基础。

图3 pH值(A)、连续扫描时间(B)、紫外灯照射时间(C)、盐浓度(D)对Q-CDs荧光强度的影响Fig.3 Effects of pH value(A),continuous scanning time(B),UV lamp irradiation time(C)and salt concentration(D)on fluorescence intensity of Q-CDs
2.3 Fe3+的检测
探究了Q-CDs对不同浓度Fe3+的响应情况,发现Q-CDs溶液的荧光强度随Fe3+浓度的增加逐渐降低(图4A)。以(I0-I)/I0(I0和I分别为Fe3+不存在和存在情况下Q-CDs的荧光强度)对Fe3+浓度作图(图4B),结果显示,在0.3~45 μmol/L范围内,(I0-I)/I0与Fe3+浓度呈良好的线性关系,相关系数(r)为0.998 6,以3倍信噪比计算检出限(LOD),得到LOD为91 nmol/L。与其他Fe3+检测方法相比(表1),本方法具有较高的灵敏度。

表1 不同荧光检测法对Fe3+检测性能的比较Table 1 Comparison of performance of different fluorescence methods for detection of Fe3+

图4 不同浓度Fe3+存在下Q-CDs的荧光光谱(A)、(I0-I)/I0与Fe3+浓度的关系图(B)及Q-CDs对Fe3+的选择性测试(C)Fig.4 Fluorescence spectra of Q-CDs at different Fe3+concentrations(A),diagram of(I0-I)/I0 and Fe3+concentrations(B)and selectivity of Q-CDs to Fe3+(C)inset B:(I0-I)/I0 linear relationship with Fe3+concentration in the range of 0.3-45 μmol/L
进一步考察了Q-CDs对Fe3+的选择性(图4C),将各种重金属离子加入Q-CDs水溶液中,包括Fe3+、Mn2+、Cd2+、Zn2+、Co2+、Pb2+、Hg2+、Fe2+、Cr3+、Ag+、Cu2+、Ni+、Ca2+和Mg2+,离子浓度均为150 μmol/L。考察其对(I0-I)/I0的影响。Fe3+能够使Q-CDs的荧光发生猝灭,而其他金属离子仅有少量或无猝灭效应。综上,Q-CDs荧光传感探针对Fe3+有灵敏的响应。
XPS和FTIR结果(图2)显示,Q-CDs表面有大量的活性基团(如羧基、氨基、羟基等),这些活性基团可以与Fe3+进行配位螯合,改变Q-CDs表面官能团的电子结构。这些配合物通过有效的光电子或能量转移激发电子的非辐射重组,并进一步导致荧光猝灭[18-20]。因此,推测Fe3+使Q-CDs荧光猝灭是由电子转移导致的。
为了评估该方法的实用性,进一步将其应用于当地自来水、雨水及泉水(取自济南市五龙潭、趵突泉)中Fe3+的检测。结果发现Q-CDs对所取样品无明显响应,即未检测出Fe3+。为了验证方法的准确性,向待测水样中加入不同浓度(0.5、5、15 μmol/L)的Fe3+标准溶液,进行加标回收率实验,结果如表2所示。Fe3+的加标回收率为94.6%~106%,相对标准偏差(RSD)小于5%。结果表明,Q-CDs对实际环境水样中Fe3+的检测结果可靠,可用于实际水样中Fe3+的检测。
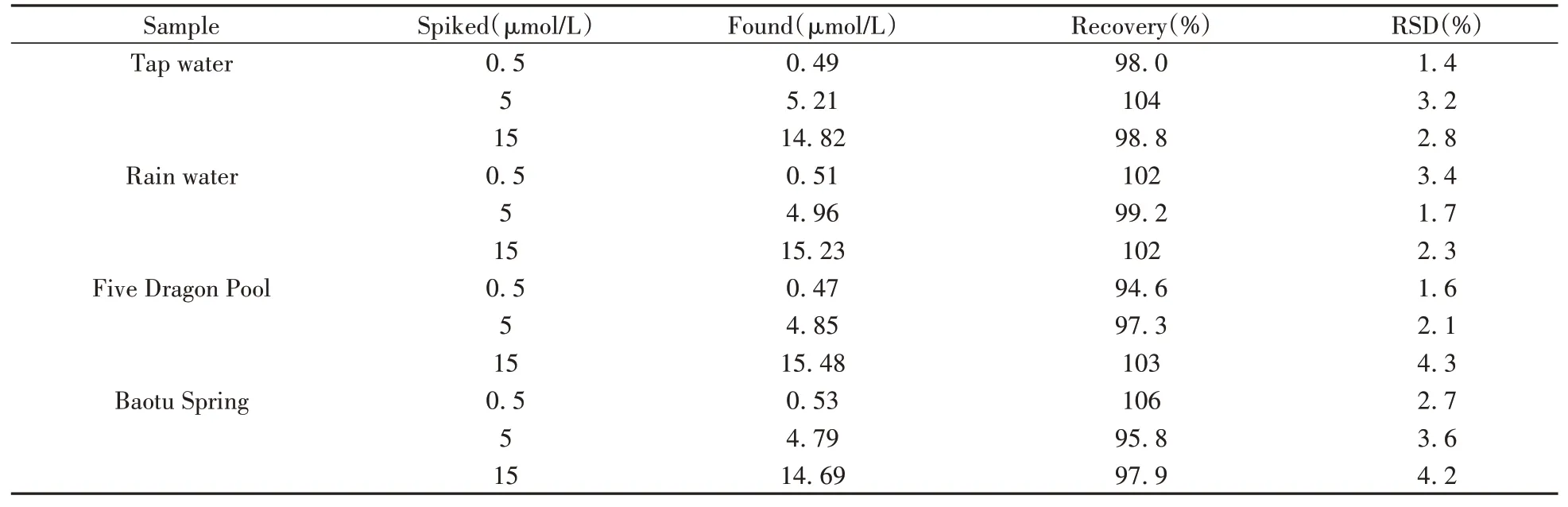
表2 实际样品中Fe3+的测定Table 2 Determination of Fe3+in real water samples
2.4 细胞毒性与细胞成像
采用MTT法测定了不同浓度Q-CDs对Hela细胞的毒性,发现即使Q-CDs为800 μg/mL,细胞活性仍高达97.54%(图5A)。Hela细胞与Q-CDs(200 μg/mL)共孵育后,仍然表现出很好的细胞活性(图5B)。在紫外光(395~415 nm)、蓝光(420~485 nm)、绿光(460~550 nm)的激发光条件下观察,细胞分别发出蓝色、绿色、红色荧光(图5C-E),表明Q-CDs具有良好的生物相容性和较低的毒性,容易进入到细胞内部,并保留其荧光特性,可以用于简便的细胞成像分析。
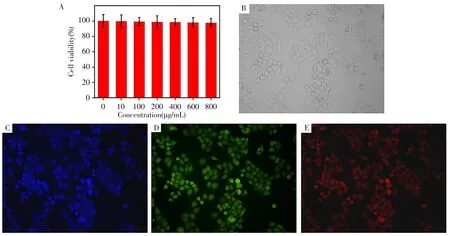
图5 不同浓度Q-CDs存在下的细胞毒性测试(A),Hela细胞与200 μg/mL Q-CDs孵育后的明场图像(B)以及紫外光(C)、蓝光(D)、绿光(E)激发下孵育后细胞的荧光图像Fig.5 Cytotoxicity test in the presence of different concentrations of Q-CDs(A),bright field image of Hela cells incubated with 200 μg/mL Q-CDs(B),fluorescent images of incubated cells under UV(C),blue light(D),green light(E)excitation
基于Q-CDs的细胞内荧光保留和特异性识别Fe3+的特性,将Q-CDs用于活细胞内Fe3+的成像分析。将Hela细胞与200 μg/mL Q-CDs共同孵育10 min后,分别加入0、15、50 μmol/L Fe3+孵育10 min。结果发现加入Fe3+后细胞内荧光强度逐渐减弱,且Fe3+浓度越高,荧光猝灭越严重(图6)。表明合成的Q-CDs可用于细胞成像,且能实现活细胞内Fe3+的可视化检测。

图6 Hela细胞与200 μg/mL Q-CDs和0、15、50 μmol/L Fe3+共同孵育后在紫外光激发下的荧光图像(A1、B1、C1);明场图像(A2、B2、C2);细胞荧光图像与明场图像合并图像(A3、B3、C3)Fig.6 Fluorescence images of Hela cells incubated with 200 μg/mL Q-CDs and 0,15,50 μmol/L Fe3+under UV excitation(A1,B1,C1),bright field images(A2,B2,C2),the combination of cell fluorescence images and bright field images(A3,B3,C3)
3 结论
本文以4种啤酒为前体,无需额外酸碱辅助,利用温和的一步溶剂热法直接合成了具有蓝色荧光的CDs。其中以齐鲁工业大学啤酒为原料制备的Q-CDs发光效率最佳,能够发出明亮的蓝色荧光,量子产率为4.56%。合成的Q-CDs不仅具有较低的生物毒性,并且对于Fe3+具有较高的选择性和较好的响应灵敏度,基于此成功建立了Fe3+的荧光分析方法,检出限可达91 nmol/L。所建方法成功用于实际水样中Fe3+的检测,结果令人满意。考虑到Q-CDs良好的生物相容性,进一步将其成功应用于多色细胞成像和细胞内Fe3+的成像分析。

