靶标介导DNA自组装及催化电流放大的microRNA电化学检测研究
李鳗亭,韦颖怡,杨 帆,李新春
(广西医科大学 药学院,广西 南宁 530021)
MicroRNAs(miRNAs)是一类由17~25个核苷酸组成的内源性非编码单链RNA,参与转录后基因表达调控,在细胞分化、增殖、代谢和凋亡等许多过程中扮演重要的角色[1-2]。研究表明,miRNAs表达水平与癌症的发展密切相关,被认为是相关疾病临床早期诊断和预后的重要标志物[3-4]。
miRNAs具有序列高度同源、丰度低等特点,给其定量检测带来严重挑战[5]。目前较为成熟的miRNAs检测方法主要包括Northern印迹分析[6]、逆转录聚合酶链反应[7]和微阵列分析等[8]。近年来,微流控芯片技术[9]、局部表面等离子共振[10]、表面增强拉曼散射[11-12]和荧光分析[13-14]等方法被用于miRNA的定量检测。电化学技术由于操作简单、灵敏度高、响应速度快、检测成本低、可微型集成化等优点而备受青睐。Zouari等[15]在AuNPs/rGO修饰的SPCEs上组装巯基标记DNA捕获探针,将链霉亲和素修饰的二茂铁封端的AuNPs与生物素化的检测探针相结合,作为标记纳米载体,在miRNA-21存在下进行“三明治”杂交,实现miRNA-21的高灵敏检测;Bao等[16]报道了一种双链特异性核酸酶功能化的石墨烯纳米阵列/金纳米粒子碳墨电极,用于miRNA的动态、灵敏和实时分析;Wang等[17]开发了一种基于靶标介导的环状链置换反应和引物交换DNA扩增反应的双重扩增策略的非标记电化学生物传感器,用于检测外泌体中miRNA;Luo等[18]开发了一种基于锁核酸修饰的“Y”形结构的比率型电化学DNA生物传感器,用于检测外泌体中miRNA-21。上述方法均具有较高灵敏度,但实验设计流程略显繁琐,耗时耗力。
本文报道了一种非标记、靶标诱导核酸自组装,且无需酶辅助信号扩增或其他繁琐杂交链反应的电化学传感方法,用于miRNA-21的超灵敏检测。当miRNA-21存在时,金电极表面巯基标记的茎环结构捕获探针打开,与设计的两个衔接子Strand-UP链、Strand-DOWN链,以及miRNA-21互补配对,自组装成一个“H”型核酸复合结构。同时,利用铁氰根离子([Fe(CN)6]3-)调控[Ru(NH3)6]3+/2+氧化还原循环,实现催化电流信号放大。该生物传感器对miRNA-21具有极高的检测灵敏度,对单碱基错配以及其他miRNA分子具有很强的抗干扰能力,适用于多个细胞系中miRNA-21的定量检测。
1 实验部分
1.1 仪器与试剂
CHI650E电化学工作站(上海辰华仪器股份有限公司);pH酸度计(上海仪电科学仪器股份有限公司);超声波清洗器(上海冠特超声仪器有限公司);TDL-5A台式低速离心机(上海菲恰尔分析仪器有限公司);MICRO17R小型高速冷冻离心机(赛默飞世尔科技有限公司,美国);ME104E万分之一电子天平(梅特勒-托利多,瑞士)。
除特别说明外,本实验所用试剂均为分析纯。K3[Fe(CN)6]、K4[Fe(CN)6]·3H2O、KCl、NaCl、MgCl2、HCl、H2SO4、无水乙醇、6-巯基己醇(MCH)、三(2-羧乙基)膦盐酸盐(TCEP,纯度≥98%)、三羟甲基氨基甲烷(Tris,纯度≥99.8%)、氯化六氨合钌([Ru(NH3)6]3+,RuHex)购自上海阿拉丁生化科技股份有限公司;氧化铝(Al2O3,0.05 μm,武汉高仕睿联科技有限公司);MicroRNA提取试剂盒(天根生化科技有限公司);实验用水为Milli-Q超纯水(18.2 MΩ·cm)。DNA序列(见表1)由上海生工生物工程有限公司合成并经高效液相色谱法纯化。实验用缓冲溶液如表2所示。

表1 本实验使用的核酸序列Table 1 The nucleic acid sequences used in this experiment

表2 本实验使用的缓冲溶液Table 2 The buffer solutions used in this experiment
1.2 电极的预处理
将2 mm金盘电极在抛光布上用Al2O3粉(粒径0.05 μm)充分打磨后,依次用水、乙醇、水各超声1 min。然后将电极置于0.5 mol/L H2SO4中,用循环伏安法(CV)进行活化(扫速为100 mV/s,电位范围为-0.25~1.55 V),至形成稳定的伏安图谱。取出电极用水冲洗,氮气吹干备用。
1.3 非标记miRNA-21电化学传感器的构建
将50 μL含1.0 μmol/L CP和1 mmol/L TCEP的Buffer-Ⅰ避光处理1 h,取6 μL滴至金电极表面,在室温下避光孵育2 h。用Buffer-W冲洗金电极盘面,氮气吹干后将金电极置于200 μL 1 mmol/L MCH溶液中浸泡1 h,封闭残余的电极位点,然后用Buffer-W冲洗干净。再将CP/MCH修饰的金电极浸入40 μL Strand-UP、40 μL Strand-DOWN以及40 μL含不同浓度miRNA-21的Buffer-H中,37.5℃孵育12 h,取出电极,用Buffer-W冲洗电极盘面。最后,将金电极置于10 mL Buffer-E-1中5 min,通过静电吸附[Ru(NH3)6]3+至平衡状态,用于后续电化学信号检测。测试前向电解池中通10 min氮气除氧,排除其对电化学测量的干扰。
1.4 电化学测量
电化学检测采用三电极系统,其中铂电极为对电极,Ag/AgCl(3 mol/L氯化钾)电极为参比电极,组装有核酸纳米结构的金电极(直径2 mm)为工作电极,室温下测量。DPV电位扫描范围为0.1~0.6 V,振幅50 mV、脉冲宽度0.05 s、脉冲周期0.2 s,扫描速度为50 mV/s。
2 结果与讨论
2.1 检测原理
基于靶标诱导自组装、非标记、电化学-化学偶联信号放大的miRNA-21超灵敏电化学检测示意图如图1所示。利用金-硫键可将末端修饰巯基的CP固定在金电极表面,CP序列首尾部含有4对C/G碱基对,可形成相对稳定的茎环结构。Strand-UP和Strand-DOWN链均含有与CP、miRNA-21部分互补的片段。在无miRNA-21的情况下,由于CP茎环结构具有热力学稳定性,Strand-UP和Strand-DOWN不能与金电极表面的CP相互作用形成DNA复合结构,电极表面仅有的茎环结构未被打开。由于核酸链中带负电荷的磷酸骨架与钌氨离子([Ru(NH3)6]3+)之间存在静电作用,[Ru(NH3)6]3+可静电吸附到CP链上,通过DNA介导的电子转移作用产生很低的背景电流信号。当有miRNA-21时,触发CP链的茎环结构打开,CP与Strand-UP、Strand-DOWN以及miRNA-21通过碱基互补配对原则形成一个“H”型的DNA复合结构,为[Ru(NH3)6]3+提供了大量的吸附位点,从而产生较强的电流信号。当测试体系中含有[Fe(CN)6]3-时,[Ru(NH3)6]3+电解还原产物[Ru(NH3)6]2+进一步被[Fe(CN)6]3-氧化,重新生成[Ru(NH3)6]3+,即形成电化学-化学偶联循环,使得[Ru(NH3)6]3+被多次利用,产生高效的催化电流和信号放大效应,实现对miRNA-21的超灵敏检测[19]。

图1 一种非标记及催化信号放大的miRNA-21电化学传感示意图及信号响应模式图Fig.1 Schematic diagram and signal response mode of label-free and catalytic current amplified electrochemical sensing of miRNA-21
2.2 电极修饰表征
采用电化学阻抗图谱(EIS)对电极修饰过程进行表征,高频区域为电子转移控制过程,其中半圆形弧线直径对应电荷转移阻抗。如图2所示,在5 mmol/L K3[Fe(CN)6]+5 mmol/L K4[Fe(CN)6]体系(即Buffer-E-2)中,裸金电极在高频区域仅有一个非常小的半圆弧线,电荷转移阻抗约为140 Ω(曲线a),表明在金电极表面具有快速的电子传递过程。当电极修饰了CP后,电荷转移阻抗增大到约2 070 Ω(曲线b),这是由于DNA带负电荷,与[Fe(CN)6]3-/4-电化学对之间存在静电排斥,表明CP通过金-硫键连接到金电极表面。用MCH封闭金电极表面多余的活性位点后,电荷转移阻抗进一步增大到10 530 Ω(曲线c),这是由于MCH会阻碍[Fe(CN)6]3-/4-与电极界面的接触和电子交换。当无靶标存在时,电荷转移阻抗约为10 900 Ω,这是因为引入Strand-UP和Strand-DOWN后,不能形成稳定的DNA双链结构,因此不会改变电极表面状态(曲线d)。当靶标存在时,由于形成DNA-RNA复合结构,严重阻碍了电子交换过程,导致电荷转移阻抗显著增大至17 500 Ω(曲线e)。以上结果表明已在金电极上成功识别miRNA-21并自组装形成核酸复合结构。

图2 电极修饰过程中电化学阻抗谱的变化Fig.2 Electrochemical impedance spectroscopy tracing the modification process of gold electrode
2.3 捕获探针的组装密度
金电极表面CP的组装密度对形成H型DNA复合结构的影响较大,进而会影响电化学信号响应。因此采用计时电量法(CC)检测不同浓度CP在电极上的组装密度[20]。当用CP修饰的电极置于含有多价氧化还原阳离子和低离子强度电解质中时,氧化还原阳离子与天然电荷补偿阳离子交换并在该界面处被静电捕获。计时库仑法(Chronocoulometry)可以方便地将基于扩散的RuHex氧化还原过程与表面限制的RuHex氧化还原过程分开,由于双电层和其他吸附在电极表面上的物质的反应引起的电量,不同于由于扩散到电极表面的氧化还原分子反应产生的电量。因此,采用计时库仑法可对DNA上吸附的阳离子([Ru(NH3)6]3+)氧化还原电量进行测量,从而计算出CP分子的组装密度。积分电量Q,作为计时库仑实验中时间t的函数由积分Cottrell表达式给出,公式如下:

式中,n是电子转移数,F是法拉第常数,A是电极面积(cm2),D0是扩散系数(cm2·s-1),C0是体积浓度(mol/cm2),Qdl是电容电荷(C),nFAΓ0是吸附的氧化还原标记的Γ0(mol/cm2)还原产生的电荷。Γ0表示限制在电极表面附近的RuHex的量,Q总电荷包含电容电荷和吸附的反应物电荷。计时库仑截距(在t=0时)表示限制在电极表面的氧化还原分子RuHex的电荷。由于RuHex对DNA的完全电荷补偿,表面限制的氧化还原分子数可转换为DNA探针密度,关系如下:

式中,ΓDNA是探针表面密度(mol/cm2),m是探针DNA中的碱基数,Z是氧化还原分子的电荷数(Z=1),NA是阿伏伽德罗常数。图3A给出了CP修饰电极在Tris缓冲液中的计时库仑图,通过对比这两种情况(即Tris缓冲液中是否含有50 μmol/L RuHex)的氧化还原电量,可计算出修饰电极上CP探针的组装密度。从图3B可以看出,当CP浓度为0.7 μmol/L时,其组装密度相对较高,浓度达到1.5 μmol/L时,CP组装密度下降较为明显,这是由于过高浓度的DNA单链之间会产生一定的空间位阻,不利于DNA自组装单层的形成。
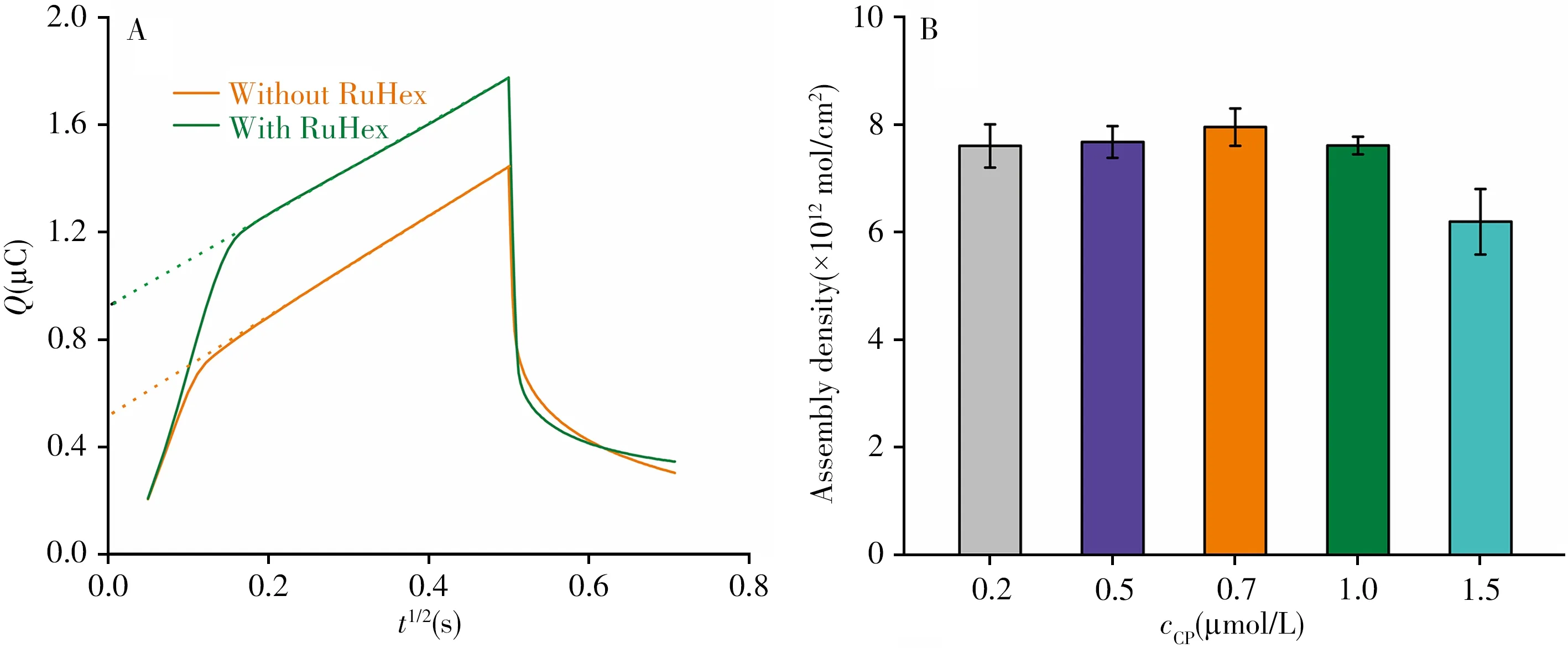
图3 电化学传感器在加入RuHex前后缓冲溶液中的计时库仑图(A),及不同浓度CP在金电极上的组装密度(B)Fig.3 Chronocoulometry signal response of the electrochemical sensor in buffer without or with RuHex(A),and comparison of the assembly density of CP on gold electrode(B)
2.4 实验条件的优化
为获得最优实验条件,提高检测灵敏度,对CP浓度、Strand-UP/Strand-DOWN与CP浓度比及核酸组装时间进行优化。采用微分脉冲伏安法(DPV)检测电流信号的改变:S%=(ImiRNA-21-I0)/I0×100%,式中S%为电流信号的改变,ImiRNA-21为miRNA-21存在时的峰电流值,I0为无miRNA-21时的峰电流值,其中靶标miRNA-21浓度固定为100 pmol/L。
2.4.1 CP浓度的优化CP浓度会影响其在金电极表面的组装密度,进而影响DNA复合结构的生成效率。如图4A所示,当CP浓度从0.2 μmol/L增加到1.0 μmol/L时,信号增幅逐渐增大,继续增加CP浓度至1.5 μmol/L,则S%降低。这是由于当电极表面CP浓度过高时,会产生较大的空间位阻,致使两个衔接子链和miRNA-21不能有效形成稳定的H结构;CP浓度过低时,则生成的H结构较少,吸附的钌氨离子数量有限,电流信号弱,灵敏度低。因此,实验选择1.0 μmol/L CP作为最佳固定探针浓度。

图4 CP浓度(A)、Strand-UP/Strand-DOWN与CP的浓度比(B)及孵育时间(C)对信号响应的影响Fig.4 Effects of CP concentration(A),concentration ratio of Strand-UP/Strand-DOWN to CP(B),and incubation time(C)on electrochemical signal response
2.4.2 杂交链与CP浓度比的优化Strand-UP/Strand-DOWN与CP的浓度比会直接影响H型DNA复合结构的形成效率。如图4B所示,S%在浓度比0~2之间随比值的增大而增大,继续增大浓度比,则S%呈下降趋势,这是因为当Strand-UP/Strand-DOWN浓度过大时,会增大电极表面的空间位阻,使得CP茎环结构不能有效打开,阻碍了H型DNA复合结构的形成,导致S%降低。另外,过高浓度的Strand-UP/Strand-DOWN链会产生较大的静电排斥,4条链不能有效地识别和互补配对,从而导致S%降低。因此,实验选择Strand-UP/Strand-DOWN与CP链的浓度比为2作为后续实验条件。
2.4.3 孵育时间的优化孵育时间直接影响4条核酸链杂交反应的进程以及最终H型DNA复合结构的数量,进而影响电化学响应灵敏度。如图4C所示,S%在4~12 h范围内随着时间的延长电流信号逐渐增大,之后呈下降趋势。因此,实验选择12 h作为最佳孵育时间。
2.5 电化学传感器的性能分析
在优化实验条件下考察了传感器对不同浓度miRNA-21的响应。测试体系为表2中的Buffer-E-1。如图5所示,在0.1 fmol/L~0.1 nmol/L浓度范围内,DPV电流响应值随着miRNA-21浓度的不断增加,峰电流增幅与浓度的对数(lgcmiRNA-21)呈良好的线性关系(图5插图),其线性方程为S%=19.05 lgcmiRNA-21+331.53,r2=0.995,检出限(LOD,S/N≥3)为12.8 amol/L。以上结果表明所采用的电化学-化学偶联循环策略可显著增强电流响应,提高miRNA-21的检测灵敏度。相较其他miRNA电化学传感器,本方法具有更低的检出限(见表3)。

图5 信号扩增模式下系列浓度miRNA-21的微分脉冲伏安图Fig.5 DPV curves of the sensor response to serial concentrations of miRNA-21 with signal amplification strategy insert:quantitative calibration curve of the sensor for miRNA-21 assay

表3 miRNA电化学传感器的性能比较Table 3 Comparison of analytical performance of electrochemical sensors for miRNA assay
2.6 电化学传感器的特异性分析
为评估制备的电化学传感器对miRNA-21检测的特异性,以相同浓度(100 pmol/L)的其他miRNA,包括miRNA-16、miRNA-39,以及不同碱基错配RNA链对该传感器的抗干扰能力进行考察。如图6所示,相同浓度水平的miRNA-21可产生164%的电流信号变化,其他潜在干扰物的信号变化比值均低于20%,表明制备的传感器具有很好的特异性,可以区分其他miRNA家族成员、多碱基错配甚至是单碱基错配RNA序列,这得益于H型核酸复合结构的设计。

图6 传感器对miRNA-21测定的选择性Fig.6 Selectivity of the present sensor for miRNA-21 assay
2.7 细胞裂解液中的miRNA-21检测
为验证该方法在复杂生物基质中定量测定miRNA-21的能力,以4种肿瘤细胞如小鼠乳腺癌细胞(4T1)、大细胞肺癌细胞(NCl-H460)、人乳腺癌细胞(MCF-7)、宫颈癌细胞(Hela)和正常人脐静脉内皮细胞(HUVEC)的细胞裂解物作为分析样本,浓度分别为9.4×10-14、2.7×10-15、2.9×10-11、3.0×10-13、6.0×10-18mol/L。可以发现,相对于其他肿瘤细胞,MCF-7细胞中的miRNA-21浓度较高,也明显高于正常内皮细胞。因此,该方法能够灵敏地检测肿瘤细胞中miRNA-21的浓度水平,在相关疾病诊断中具有一定的应用潜力。
3 结论
本研究成功构建了一种靶标介导的无标记且无需酶辅助信号扩增的超灵敏电化学传感策略。在靶标miRNA-21存在下,CP链、Strand-UP链与Strand-DOWN链在金电极表面可自发形成H型核酸复合结构,通过铁氰根离子([Fe(CN)6]3-)调控[Ru(NH3)6]3+/2+氧化还原循环,产生电化学-化学级联效应,产生高效催化电流,实现了对miRNA-21的超灵敏检测,最低检出限为12.8 amol/L,并能有效区分其他microRNA以及单碱基错配核酸序列。方法成功用于多种细胞中miRNA-21的定量检测。该传感器具有灵敏度高、选择性好、线性范围宽等特点,优于目前报道的PCR扩增、滚环扩增、链置换反应等分析策略,为microRNA相关生物医学研究和临床疾病诊断提供了一种新的技术手段。

