基于杂交指示剂的无标记适配体电化学传感器用于铅离子检测
张雨婷,陈灏翰,李 惠,王晓丽,周楠迪
(江南大学 生物工程学院,糖化学与生物技术教育部重点实验室,江苏 无锡 214122)
铅离子(Pb2+)作为毒性最强的重金属污染物之一,其污染环境后难以自然降解或无害化,进入有机体后有较强的生物蓄积毒性,会对环境安全和人类健康造成巨大威胁[1-2]。因此,开发一种简单、可靠的Pb2+检测方法对于环境和人类健康均有着至关重要的作用。目前Pb2+的传统检测方法主要有原子吸收光谱法[3]、电感耦合等离子体质谱法(ICP-MS)[4]、表面等离子共振法[5]等。这些方法虽准确可靠,但存在着操作繁琐、仪器昂贵、基质干扰严重、需要专业人员操作等缺点,限制了其实际应用尤其是在线快速分析领域的应用[6-7]。为克服上述困难,研究者们运用荧光法[8]、比色法[9]、电化学发光法[10]、电化学分析法[11]等方法实现了对Pb2+的检测。随着近年来微电子技术的发展和新材料的应用,电化学传感器以其高灵敏度、便携性及低成本等优点受到了广泛关注。
电化学传感器是以酶、抗体、适配体、细胞等为特异性识别元件,通过对待测目标捕获后电极表面电子传递能力变化的检测,从而将待测物质的浓度信号转换成电信号进行定量分析[12-13]。对比其他识别原件,适配体作为一类能够特异性识别小分子、蛋白分子甚至细胞的寡核苷酸片段,因其高稳定性、低成本和多功能性而越来越多的应用于检测分析领域[14-15]。Abu-Ali等[16]利用末端修饰电化学信号分子的适配体作为识别原件,当与Pb2+结合后,DNA构象改变并引起信号分子与电极表面距离的变化,从而引起电化学信号改变,实现Pb2+的定量检测。董杰等[17]利用PtNPs@Cu-MOF信号探针和DNA walker信号放大技术开发了一种灵敏检测Pb2+的电化学传感器。然而无论是电化学活性分子还是纳米探针作为信号标记的适配体传感器,均需在适配体末端修饰信号分子,使得传感器构建需花费大量成本和精力。
适配体由于本身结构的特殊性,在信号检测方面展示出其他生物识别原件无可比拟的优异性能,不仅可以通过末端修饰信号基团引入可检测信号,还可通过指示剂吸附插入等方式构建无需提前信号标记的检测方法,大大降低了传感器的制备成本和操作难度[18-19]。亚甲基蓝(MB)作为一种有机染料分子,可定向插入DNA互补配对形成的双键之中,且其具备良好的电化学活性,因此经常作为一种电信号探针应用于电化学适配体传感器中[20-21]。
本研究通过将Pb2+适配体修饰于电极表面,并与其cDNA通过碱基互补配对形成双链的形式吸附杂交指示剂MB作为电化学信号物质,利用适配体对重金属Pb2+的特异性识别后双链的定量打开,释放出MB,构建了一种基于MB信号“Turn off”的无标记适配体电化学传感器,为环境或食品工业中Pb2+的快速在线分析提供了一种便捷、灵敏的新型分析方法。
1 实验部分
1.1 仪器与试剂
CHI660E电化学工作站(上海辰华仪器有限公司);三电极系统:工作电极为金电极(AuE,Φ=3 mm)或修饰电极,参比电极为银/氯化银(饱和氯化钾)电极,对电极为铂丝电极;电子分析天平(赛多利斯BSA224S);泰坦UC-6超声波清洗机(上海泰坦科技股份有限公司);HH-B11-BS-I恒温培养箱(上海泰坦科技股份有限公司);Ultra-low organic型超纯水机(上海涞科仪器有限公司);KX-79-1型磁力搅拌器(江苏科析仪器有限公司);MX-S漩涡振荡器(美国赛洛捷克公司),CF15RN离心机(日本日立公司)。
乙酸铅标准品、氯化钠、氯化镁、铁氰化钾、亚铁氰化钾、乙酸、氯化钾、氯化钙、亚甲基蓝、磷酸氢二钾、硫酸、磷酸二氢钠(国药集团化学试剂有限公司);三羟甲基氨基甲烷(Tris,上海生工生物工程股份有限公司);6-巯基己醇(美国Sigma-Aldrich公司);0.05 μm氧化铝粉末(浙江理协仪器公司)。所有试剂若无特殊说明均为分析纯,实验用水为去离子水(18 MΩ·cm)。
所用DNA核酸序列由生工生物工程(上海)股份有限公司合成;Pb2+适配体:GGGTGGGTGGGTGGGT,cDNA序列:CACCCTCCCAC。
1.2 金电极预处理
在食人鱼溶液(H2SO4∶H2O2=7∶3)中浸泡15 min,分别在水和无水乙醇中超声3 min,再在0.3 μm和0.05 μm氧化铝悬浮液中分别打磨3 min。用水冲净后在0.5 mol/L硫酸溶液中进行循环伏安扫描(-0.2~1.5 V,扫描速率1 V/s,循环次数100次),再用水冲净,氮气吹干后备用。
1.3 适配体与金电极孵育
用Tris-HCl缓冲溶液(10 mmol/L Tris,1 mol/L NaCl,1 mmol/L MgCl2,pH 7.4)将Pb2+适配体序列(GGGTGGGTGGGTGGGT)及cDNA序列(CACCCTCCCAC)稀释至目标浓度。取5 μL 0.1 μmol/L的铅离子适配体(Apt)滴加到处理好的金电极表面,室温下孵育12 h后用Tris-HCl缓冲溶液清洗电极以备后续使用。将修饰有Apt的金电极浸泡在2 mmol/L 6-巯基己醇(MCH)中,37℃下孵育1 h后用Tris-HCl清洗电极以备后续使用。
1.4 互补双链的形成及杂交指示剂的吸附插入
取5 μL 1 μmol/L的cDNA滴加至处理好的金电极表面,37℃下孵育2 h与Apt形成双链,再用Tris-HCl清洗电极以备后续使用。将上述修饰电极浸泡在1.6 mmol/L亚甲基蓝(MB)溶液中,37℃下孵育1 h,MB即吸附到DNA双链中产生电信号。用Tris-HCl清洗电极以备后续使用。
1.5 传感器检测Pb2+的电化学测试
将上述修饰电极浸泡在含不同浓度Pb2+的Tris-HCl缓冲溶液中,37℃下孵育一段时间后,用3 mL Tris-HCl缓冲溶液和3 mL水冲洗,进行电化学测试。电化学测试采用传统的三电极系统,所有测量均在室温下进行。循环伏安测试(CV)和电化学阻抗测试(EIS)在含0.1 mol/L KCl的5.0 mmol/L[Fe(CN)6]3-/4-溶液中进行,其中,EIS的频率范围为10-2~105Hz,振幅为5 mV。差分脉冲伏安(DPV)测试在Tris-HCl缓冲溶液中进行,起始电势-0.5 V,终止电势0.1 V,振幅0.05 V,脉冲宽度0.05 s,取样宽度0.016 666 7 s,脉冲周期0.2 s,静态时间2 s,DPV测定扫描时间为30 s。
1.6 PAGE凝胶电泳分析
使用电泳仪(美国Bio-Rad)进行PAGE凝胶电泳实验,并通过UV凝胶电泳成像仪(SmartGel 600,北京赛智创业科技有限公司)记录成像。将混合有6×TEK载样缓冲液(pH 8.0,50%甘油,0.25%溴酚蓝)的DNA溶液注入12%天然聚丙烯酰胺凝胶中。在1×TBE电泳液(pH 8.0)、120 V恒定电压电泳分析1 h。凝胶用Gelred核酸凝胶染色液染色后,记录图像。
1.7 实际样品检测
牛奶样品:先用20%三氯乙酸将牛奶样品溶液调至pH 4.6,在45℃下孵育15 min使蛋白质变性后,采用10 000 r/min离心15 min去除沉淀的蛋白,再将不同浓度的Pb2+添加到处理好的牛奶样品的上清液中,得到含有不同靶标浓度的牛奶样品。
湖水样品:水样以8 000 r/min离心15 min,过0.22 μm膜,用10 mmol/L Tris缓冲液调至pH 7.4,采用本方法进行加标回收实验,计算回收率。
2 结果与讨论
2.1 适配体电化学传感器的工作原理
本研究基于适配体与Pb2+高特异性结合后,使插入碱基对间的杂交指示剂MB定量游离,从而实现响应信号的“Turn off”变化,发展了一种检测Pb2+的适配体电化学传感器。传感器的工作原理如图1所示。首先将Pb2+适配体修饰至金电极,再将与适配体互补的cDNA与适配体进行碱基互补配对。形成双链后,将MB嵌入到DNA双链中。此时,当不存在Pb2+时,插入双链间的丰富的MB在DPV扫描中产生较大的峰电流;当加入Pb2+时,Pb2+与适配体结合导致DNA双链解开,双链中MB的吸附数量降低,电信号降低,从而实现对Pb2+的定量、灵敏检测。

图1 基于杂交指示剂的适配体电化学传感器检测Pb2+的原理图Fig.1 Scheme of aptamer electrochemical sensor based on hybridization indicator for Pb2+detection
2.2 适配体电化学传感器的电化学表征
为评估构建的适配体电化学传感器的电化学性能,以[Fe(CN)6]3-/4-作为探针,采用交流阻抗法和循环伏安法(CV)对制备的传感器进行表征[29]。如图2A所示,裸电极EIS曲线的半圆直径很小,表明此时的电极表面被处理干净,氧化还原探针可以自由在电极表面进行电子传递。修饰适配体后的EIS曲线阻值达到860 Ω,这是由于核酸适配体磷酸骨架的电负性与探针[Fe(CN)6]3-/4-之间的静电排斥所造成。使用MCH封闭后,修饰电极的阻值升高,这是由于电极表面裸露的点位被封闭后,修饰的适配体DNA链从电极表面吸附状态变为以一定角度直立于电极表面,因此对探针的排斥增加。当加入cDNA,其与适配体形成双链后负电荷进一步增加,造成EIS曲线的半圆直径进一步增大。最后当适配体捕获Pb2+之后,cDNA从电极表面释放,导致电极的电子传递阻力降低。
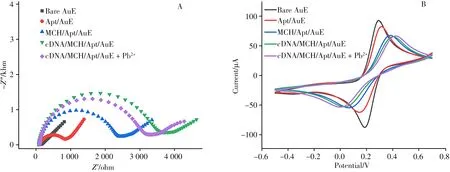
图2 传感器构建及检测过程中的EIS表征曲线图(A)和CV表征曲线图(B)Fig.2 EIS curves(A)and CV curves(B)during sensor construction and detection
为一进步表征电化学传感器的修饰与测定过程,在5 mmol/L K4[Fe(CN)6]3-/4-溶液中进行循环伏安法扫描,结果如图2B所示。裸电极的CV曲线在扫描范围内出现一对明显的且峰形尖锐的氧化还原峰,且峰间距小于100 mV,说明此时电极表面光滑洁净。修饰适配体后,电极表面由于适配体中磷酸骨架的负电性对氧化还原探针的排斥作用,使得循环伏安曲线的峰电流降低。以MCH封闭金电极的剩余点位,并采用cDNA与适配体进行杂交孵育之后,进一步减少了电子传递,循环伏安曲线的峰电流进一步减小,峰间距进一步扩大。当加入Pb2+后,适配体捕获目标离子并释放出cDNA,造成循环伏安曲线的峰电流值有所上升。此结果与上述电化学阻抗表征结果一致,进一步证明电化学传感器构建成功。
2.3 PAGE凝胶电泳分析
PAGE凝胶电泳被用于直观验证传感方案构建的可行性。如图3所示,泳道1和泳道2分别为Pb2+的适配体(bp为18)和cDNA(bp为11)。当Pb2+不存在时,泳道3是由适配体(泳道1)和cDNA(泳道2)组成的双链结构。当Pb2+存在时,适配体与Pb2+特异性结合而造成双链被破坏,因此泳道4显示变弱的双链电泳带以及被释放出的cDNA电泳带。上述结果表明,所提出的传感方案是切实可行的。

图3 PAGE电泳图Fig.3 PAGE images
2.4 差分脉冲法检测Pb2+
在Tris-HCl缓冲溶液中进行差分脉冲(DPV)扫描,结果如图4所示。从图中可以看出,当适配体电化学传感器(即修饰有Apt-MCH-cDNA的电极)在无目标物的缓冲溶液中进行DPV扫描时,由于适配体与cDNA碱基互补配对间插入了大量杂交指示剂MB,在-0.23 V出现了MB的信号峰。当传感器与100 mg/L Pb2+孵育后,Pb2+与Apt的结合使双链解开,释放出等比例的MB,从而使MB的峰电流降低。
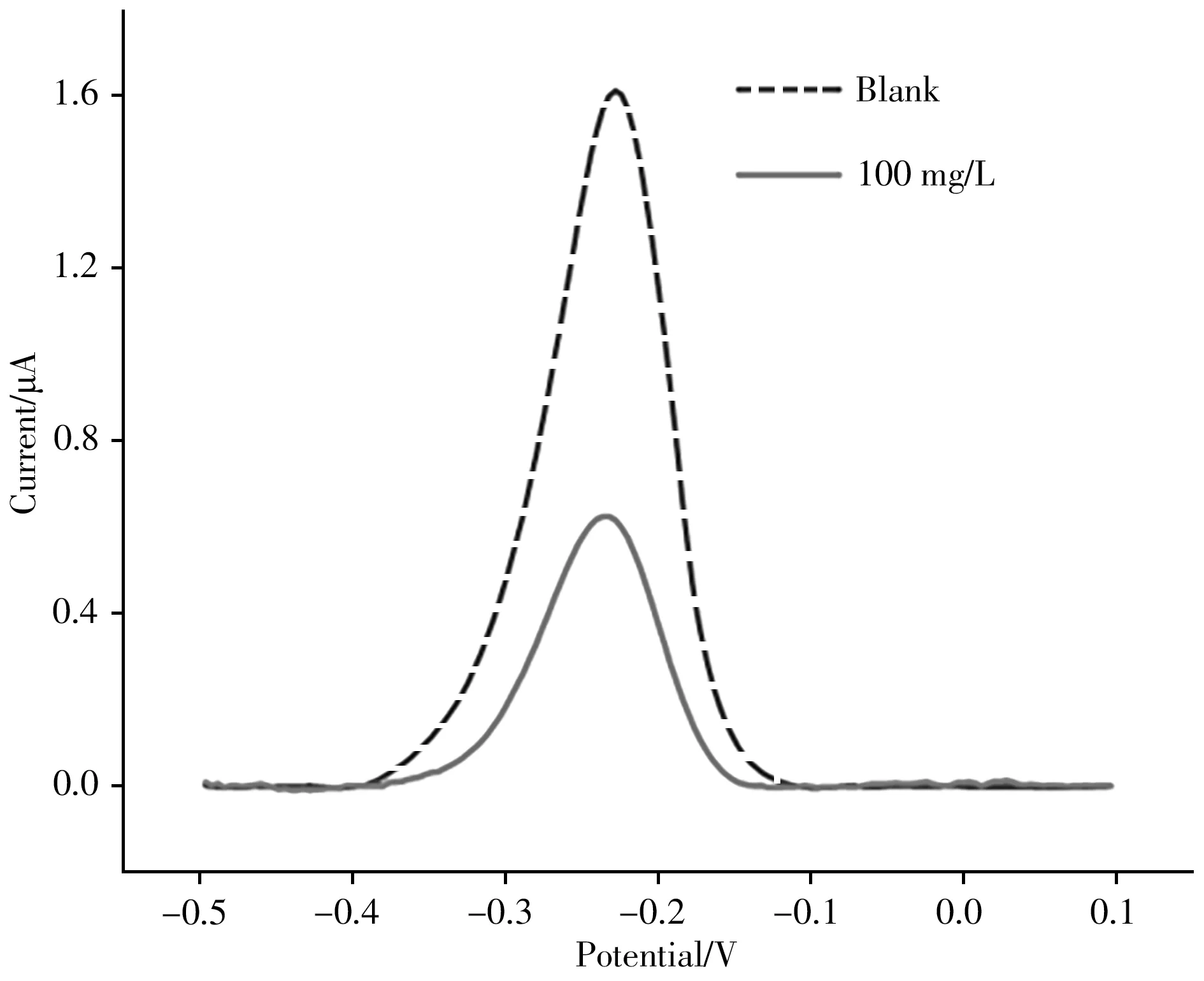
图4 在空白溶液及100 mg/LPb2+溶液孵育后传感器的DPV响应曲线图Fig.4 DPV curves of the developed sensor incubated in blank Tris-HCl buffer and Tris-HCl buffer containing 100 mg/LPb2+solution
2.5 实验条件的优化
本文对影响适配体传感器对Pb2+检测的相关实验条件进行优化,包括适配体与cDNA的孵育时间、杂交指示剂MB的使用浓度及吸附时间、目标物Pb2+的孵育时间等。
2.5.1 适配体与cDNA的孵育时间将1 μmol/L cDNA滴加到修饰有Pb2+适配体的金电极表面,孵育不同时间后进行后续实验,并进行DPV测试,结果如图5A所示。当孵育时间在30~120 min内,电流值随孵育时间的增大而增大,当孵育时间超过120 min后,电流值稳定。因此选取120 min为cDNA的最佳孵育时间。
2.5.2 杂交指示剂MB的浓度与吸附时间取1.2、1.4、1.6、1.8、2.0 mmol/L MB进行实验,结果如图5B所示,当MB浓度在1.2~1.6 mmol/L之间时,电流值增加较快;当MB浓度在1.6~2.0 mmol/L时,电流值增速缓慢。因此取1.6 mmol/L MB进行后续实验。

图5 不同实验条件对检测信号的影响Fig.5 Effects of different experimental conditions on detection signal
进一步对MB的孵育时间进行优化,结果如图5C所示,随着孵育时间的延长,电流值逐渐增高,在120 min时达到最大值。当孵育时间超过120 min后,电流值降低。因此,选取120 min为MB的最佳孵育时间。
2.5.3 Pb2+的孵育时间由于适配体与其目标物的特异性结合需合适的孵育时间,因此,在上述优化实验基础上,对Pb2+的孵育时间进行优化。随着孵育时间的延长,Pb2+与适配体结合的量增多,MB的DPV扫描峰电流降低(如图5D所示)。当Pb2+孵育时间为60 min时,电流值达到最低,且随着时间的增加,电流值趋于稳定。因此实验选取60 min为Pb2+的最佳孵育时间。
2.6 适配体电化学传感器对Pb2+的定量分析
在最优实验条件下,将0.1、1.0、10.0、100、1 000、10 000、100 000 μg/L Pb2+与适配体电化学传感器进行孵育,测定不同Pb2+质量浓度下传感器响应的DPV曲线,结果如图6A所示。可以看出随着Pb2+质量浓度的增加,由于适配体与目标物特异性结合,使得电活性分子MB的数量逐渐降低,DPV的峰电流值逐渐减小。以DPV的响应峰电流值为纵坐标,Pb2+质量浓度的对数值(lgρPb2+)为横坐标做图,可获得传感器对Pb2+离子检测的线性曲线(如图6B所示)。结果显示,在0.1~100 000 μg/L范围内,Pb2+的质量浓度的对数(x,μg/L)与DPV电流值(y)之间存在良好的线性关系,线性方程为y=-0.150x+1.86,相关系数(r2)=0.993,检出限(S/N=3)为33.4 ng/L。

图6 不同Pb2+质量浓度下适配体电化学传感器的DPV曲线以及峰电流值与不同Pb2+质量浓度对数的线性曲线Fig.6 DPV curves obtained at the aptamer electrochemical sensor upon different concentrations of Pb2+(A),calibration curve between peak current and logarithm different concentration of Pb2+(B)
为评估所构建检测方法对目标物检测的特异性,在最优实验条件下对10 000 μg/L Pb2+、Mn2+、Fe2+、Cd2+、Cu2+、Zn2+、Cr3+、Ca2+进行DPV扫描。结果如图7所示,由于其他金属离子不能与Pb2+适配体结合,所以Apt与cDNA仍呈双链,MB信号没有衰弱。证明该方法对Pb2+有较强的特异性。

图7 传感器对10 000 μg/L Pb2+、Mn2+、Fe2+、Cd2+、Cu2+、Zn2+、Cr3+、Ca2+的检测结果Fig.7 Analysis results of 10 000 μg/L of Pb2+,Mn2+,Fe2+,Cd2+,Cu2+,Zn2+,Cr3+,Ca2+by the sensor
2.7 实际样品的检测
为了考察所构建的适配体电化学传感器的实际测定效果,利用所建立的方法分别对牛奶和湖水样品中Pb2+含量进行加标回收测定。将不同浓度的Pb2+添加到处理好的牛奶及小蠡湖水样品中进行DPV检测,结果如表1所示。由实验结果可知,当Pb2+加标水平分别为0.400、20.0、50.0×103μg/L时,牛奶样品的回收率分别为87.1%、115%、97.6%,湖水样品的回收率分别为107%、106%、108%,证明本方法在牛奶及湖水样品检测中具有良好的应用效果。

表1 牛奶和湖水样品中Pb2+的检测(n=3)Table 1 Detection of Pb2+in milk and lake water samples(n=3)
3 结论
本研究基于杂交指示剂亚甲基蓝(MB)构建了一种无需标记、便捷灵敏的适配体电化学传感器,用于重金属Pb2+的检测。在最优条件下,Pb2+的可检测范围为0.1~100 000 μg/L,检出限为33.4 ng/L。传感器对牛奶样品和湖水样品中Pb2+的检测均展示出良好的实用性。本方法不仅为Pb2+的检测提供了一个快速便捷、成本低廉的电化学检测平台,也可将其推广到其他重金属离子的快速检测中,具有广泛的应用前景。

