血管中心性胶质瘤6例临床、影像与病理分析
吴婉莎,林炳权,许乙凯
(南方医科大学南方医院影像中心 广东 广州 510510)
血管中心性胶质瘤(angiocentric gliomas,AG)是近年来发现的一种的罕见的良性中枢神经系统肿瘤,2005年由Wang等[1]首次报道,WHO中枢神经系统肿瘤分类于2007 年将其正式定义为“其他神经上皮肿瘤”[2],2016年仍保留其WHO I级并归类为“其他胶质瘤”[3]。本病常发生于儿童及年轻患者,多位于幕上脑皮层及皮层下区,临床多表现为难治性癫痫。目前,国内外关于其报道较少,且影像学特征描述多为个案报道,基于此,本文对6例AG患者的临床资料、影像学表现及病理学特征等方面进行分析并结合国内外文献阐述,以加强对本病的认识。
1 资料与方法
1.1 一般资料
回顾性分析2012年9月—2021年1月于南方医科大学南方医院经病理确诊的血管中心性胶质瘤患者共6 例,最新病例随访到2022年4月7日,最长随访时间为18个月。6例患者中男3例,女3例,年龄4~22 岁,中位年龄13岁。纳入标准:①患者均采取手术治疗,取得病理结果,确诊为血管中心性胶质瘤;② 患者均行MRI增强检查。
1.2 方法
MR扫描采用GE Excite HD 3.0T磁共振扫描仪,使用头部线圈,先行常规T1WI、T2WI、FAIR轴扫,经肘静脉团注Gd-DTPA 0.1 mmol/kg体质量后行T1WI增强扫描。CT扫描采用GE LightSpeed 16层螺旋CT机,1例患者行CT平扫。
选择两位5年以上经验的影像医师进行影像学诊断,对病灶的大小、形态、密度或信号、边界及强化情况进行观察和分析。
1.3 观察指标
对本次研究的影像学结果进行分析,并回顾性分析其临床资料包括性别、年龄、病程、发病部位、病理学资料等。
2 结果
2.1 临床特点
6例AG患者中,1例以视力下降起病,1例以肢体无力及间断头痛起病,其他以癫痫起病且经药物治疗后无效。入院后均行手术治疗,1例因部分位于鞍上视交叉予以大部分切除,术后MRI显示肿瘤残留,随访提示残留肿瘤逐渐增大。其余5例经术后MRI检查后提示肿瘤得以全切除。随访所有患者无癫痫发作,除1例外无肿瘤复发。
2.2 影像学表现
①发病部位:6例患者均为位于幕上脑皮层及皮层下区的单发肿块,直径约8~70 mm,3例位于额叶,2例位于颞叶,1例累及多部位包括双侧额叶、胼胝体膝部及鞍上区。
②边界:5例边界较清,1例边界不清。
③形态及成分:5例呈类圆形,其中1例伴边缘分叶;1例呈不规则形。6例AG患者中,3例呈囊实性,1例为囊性伴小分隔,1例为实性,1例为呈软化灶并少量出血。CT示1例伴钙化,未行CT检查但术后病理显示有钙化1例。
④MRI信号:实性部分为T1WI呈等或低信号,T2WI呈等或稍高信号,囊性部分呈T1WI低信号,T2WI高信号,出血部分呈T1WI高信号,T2WI低信号。2例可见粗大、迂曲血管流空影。1例伴少量出血,呈T1WI高、T2WI低信号。
⑤增强扫描:实性部分明显强化2例,轻度不均匀强化2例,1例为囊性病灶呈环形及分隔样强化,1例无明显强化。
⑥瘤周水肿:4例轻度水肿,1例重度水肿,1例无水肿。
各病例影像学表现总结,见表1。

表1 6例AG患者的影像学表现
2.3 病理学结果
6例患者术后病理结果均为血管中心性胶质瘤,WHO I级。镜下:瘤细胞呈卵圆形、梭形或长杆状,围绕血管呈平行或垂直排列,形成室管膜菊形团样结构或同心样结构,或呈部分弥漫性浸润性生长,核分裂象难见,2例可见较多钙化,1例可见微囊。免疫组化:6例神经胶质纤维酸性蛋白(GFAP)均阳性;2例波形蛋白(VIM)阳性,4例未检;2例少突胶质细胞转录因子2(Olig-2)阳性,2例部分阳性;4例神经元抗原(NenN)阳性,1例部分阳性;4例神经突触素(Syn)阳性,2例未检;1例上皮膜抗原(EMA)呈灶状阳性;1例增值指数Ki-67为10%,5例≤5%。典型病例病理切片,见图1。
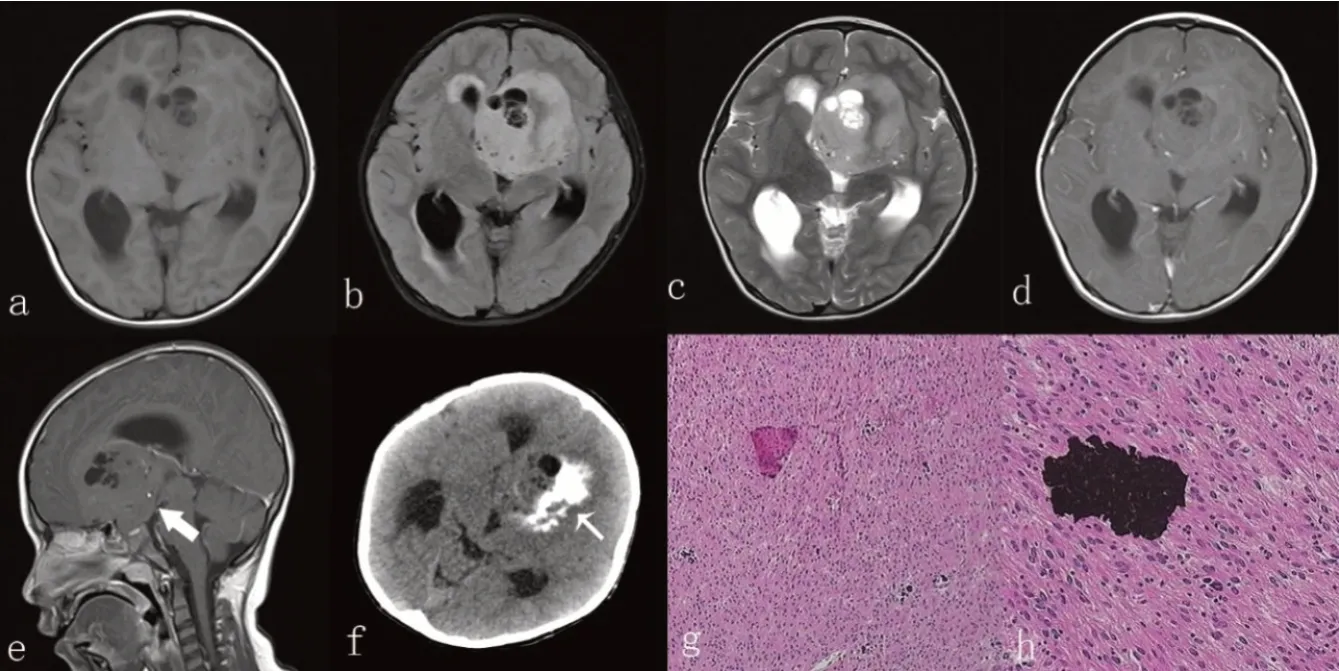
图1 1例4岁男童AG患者的影像学及病理学结果
3 讨论
血管中心性胶质瘤是一种罕见的以难治性癫痫为主要症状的中枢神经性肿瘤,由于其生长缓慢,增生潜能低,完全切除后可明显改善症状,且肿瘤无复发,故WHO分级为I级[2-3]。AG常发生于儿童及年轻患者,本文6 例患者为4~22岁,4例以癫痫起病;Soylemezoglu等[4]曾报道1例从症状发作到手术治疗确诊长达38年,该患者从3岁开始癫痫发作,直到41岁确诊为AG;另有报道,两名患者在手术治疗并确诊为AG前,患有癫痫发作史25年[1]。值得注意的是,Gonzalez-Quarant等[5]曾报道1例85岁患者,仅只有1个月的轻瘫及癫痫部分发作史。因此,AG也见于成年人,但以儿童和青少年常见。
AG的影像学表现具有一定的特征性,病变多位于幕上脑皮层及皮层下区,最常见于颞叶(约40%),其次是额叶(约30%),顶叶(约14%)[6],Weaver等[7]曾报道发生于脑干的病例。本组病例中6例均位于幕上脑皮层及皮层下区,3例位于额叶,2例位于颞叶,1例累及多部位包括双侧额叶、胼胝体膝部及鞍上区。AG多为实性肿块,可见囊变、钙化,边界清楚,MRI上T2WI及FLAIR上多为稍高及高信号,但在T1WI上信号多变,以低信号多见,但亦可见等或高信号,这可能与出现出血、钙化有关,增强多为无强化或轻度强化,肿瘤周围多无或轻度水肿[8]。本组病例中1例重度水肿,4例轻度水肿,1例无水肿,表明AG可能具有一定的侵袭性。CT显示钙化更清楚,本组1例可见块状钙化灶,余未行CT检查,但1例病理可见钙化。AG还容易发生囊变,本组病例中4例出现囊变,Harmsen等[9]曾报道2例影像学上呈脑软化改变。而本组病例中,1例边界不清并无法完全切除,这或许与肿瘤的浸润性生长有关[8];1例呈脑软化表现并少量出血,另外5例均未见出血改变,2例实性部分呈明显强化,这或许是与微血管增生有关,Hu等[10]报道了一例病例呈明显强化,认为可能与巨大的肿瘤供血血管有关,本组2例明显强化病例可见粗大、迂曲血管流空影。有学者对患者进行了MRS检查,结果显示NAA明显下降,Cho峰明显升高[8],本组病例未行MRS检查。其他报道发现部分患者MRI上可见病灶皮质边缘(rim-like)呈T1WI高信号,T2WI上肿瘤可通过蒂状结构(stalk-like)延伸至邻近脑室[10-12];这可能是AG的特征性影像改变,具有一定的诊断意义,但本组病例均无此改变。
AG的典型镜下特征为,瘤细胞围绕血管生长,沿血管长轴和(或)血管周围单层或多层袖套样排列,形成室管膜瘤样的假菊形团状结构,部分病例可见微囊形成,或微小钙化[13]。瘤细胞有轻度的细胞异型性,Ki-67一般为0%~5%[1,6]。本组病例中部分弥漫性浸润性生长,2 例有较多钙化,1例可见微囊,并且1例Ki-67为10%,但手术完全切除后无复发,症状明显缓解,这与Li等[14]报道一致。有研究显示,当AG伴有复杂的病理结构(如星形细胞瘤、室管膜瘤或高增殖指数等)时预后较差[15],这一推测还需要进一步的研究证实。
手术切除为主要的治疗方式,肿瘤完全切除后预后良好,95%以上的患者癫痫发作可完全缓解,随访无复发[6,16]。有报道确诊AG 10月后发生脊髓转移[17];一例AG转变为间变性室管膜的病例,并随后的放疗及化疗无效;因此,AG具有潜在的恶性特征。本组病例中,6例患者术后随访无癫痫,5例行全切除后症状明显缓解,肿瘤无复发;1例患者由于肿瘤累及视交叉予以大部分切除,术后随访18个月显示残留肿瘤逐渐增大,临床辅以放射治疗。
AG需与毛细胞星形细胞瘤、DNT、节细胞胶质瘤及胶质母细胞瘤相鉴别。①毛细胞星形细胞瘤是儿童最常见的胶质瘤,癫痫少见,病灶多位于幕下,囊实性多见,钙化少见,典型表现为大囊变伴壁结节,增强后壁结节明显强化,囊壁强化或不强化。②DNT多见于儿童及青少年,以癫痫为主要症状,主要位于幕上皮层,囊变多见,增强多无强化,确诊及与AG的鉴别主要依靠病理。③节细胞胶质瘤多见于30岁以下,好发于幕上脑皮层,颞叶及额叶多见,钙化、囊变常见,附壁结节明显强化是其典型影像学表现。④胶质母细胞瘤属于WHO Ⅳ级,恶性程度高,预后极差,多见于老年人,呈浸润性生长,钙化罕见,常有出血,增强呈不规则厚壁环状强化及大的团块状强化,瘤周水肿明显。
综上所述,AG是一种罕见的以儿童及青少年患者常见的低度恶性肿瘤,以难治性癫痫为主要临床症状,影像学表现具有一定特征性,手术切除是主要的治疗方式,预后良好。

