CT及MRI影像诊断对直肠癌临床术前分期价值研究
李 虎,赵 爽,陈超超,华志旺
(淮安市洪泽区人民医院影像科 江苏 淮安 223100)
直肠癌是临床多发性恶性肿瘤疾病,近年来,随着人们饮食习惯、生活方式的改变,直肠癌患病率显著升高,其发病率仅次于食管癌、肺癌与胃癌,对人们生命安全构成严重威胁。直肠癌多见于50岁以上老年人群,患者多体型肥胖,有少纤维、高热量、高蛋白、高脂等饮食习惯,且存在家族直肠癌病史[1]。直肠癌的病变是一个漫长的过程,一般由正常上皮病变到增生上皮,随着病情进展,出现腺瘤,发展为直肠癌。直肠癌发生早期缺乏特异性表现,具有隐匿性特征,表现症状不一致,发病部位不一致,早期诊断相对较为困难。国内外直肠癌指南认为,术前分期诊断在直肠癌的临床诊疗中,直接关系治疗方案的制定;直肠癌患者术前准确分期诊断,对新辅助化疗的开展具有积极作用,降低恶性肿瘤分期,为手术治疗开展创造更为有利的条件,对改善患者预后结局,降低术后复发风险等至关重要[2]。目前,临床对于直肠癌诊断方法较多,如超声检查、MRI技术、CT检查等,其中MRI检查可对直肠肠壁各层与肿瘤病灶的关系准确、清晰显示;CT技术能够对肿瘤远处器官转移、浸润深度、浸润范围等进行准确判断[3]。在结直肠癌术前T、N分期诊断与术前检查中发挥巨大作用,但两种技术诊断结果存在一定差异。本研究选取2020年3月—2022年3月淮安市洪泽区人民医院收治的直肠癌患者75 例,以术后病理诊断结果为金标准,探讨术前MRI与CT技术的诊断效果,报道如下。
1 资料与方法
1.1 一般资料
选取2020年3月—2022年3月淮安市洪泽区人民医院收治的直肠癌患者75例,所有患者接受直肠癌手术治疗。术前均行MRI与CT检查,术后肿瘤组织经病理检查诊断。75例患者中男性43例,女性32例,年龄32~81岁,平均年龄(51.34±7.62)岁,病程1~15个月,平均病程(4.65±2.14)个月。
纳入标准:①患者及家属均知情并签署知情同意书;②临床资料完整者;③患者CT与MRI影响学检查图像质量良好;④患者预计生存时间>3个月;⑤患者无禁忌证,可耐受MRI与CT检查者;⑥均为住院患者。排除标准:①检查前接受放疗或化疗者;②合并炎性肠病、遗传性直肠综合征者;③不配合或存在严重精神疾病患者;④无法耐受手术或各项检查,一般情况差;⑤合并其他恶性肿瘤者;⑥合并重要脏器系统障碍者。
1.2 方法
CT检查:检查前1 h告知患者服用适量清水,检查前12 h禁止饮食,检查前30 min肌注山莨菪碱10~20 mg。设备使用128层螺旋CT机(飞利浦256排Brilliance iCT),设备矩阵512×512,螺距1.4,管电流200 mA,管电压120 kV,重建间隔与层厚设为1 mm,进床速度17.5 mm/r,旋转时间0.8 s,扫描方式:平扫+增强扫描。首先对患者进行肛门插管,将800~1 000 mL空气注入,结肠充气后,进行平扫,调整患者取仰卧位进行平扫,以水平以下至耻骨联合部位为扫描范围。结束后,将70~90 mL碘海醇对比剂注入,经肘静脉使用高压注射器针筒注入,控制2.5~3.0 mL/s注入速率,延时期150~180 s,静脉期60~70 s,动脉期30 s。
MRI检查:使用1.5T磁共振仪器(飞利浦Philips Achieva 1.5T)进行MRI检查,选择8通道体部相控阵线圈,首先让患者选择仰卧位进行扫描,扫描时头先进,定位肿瘤病灶后,以病灶为中心,展开冠状面、横断面平扫,扫描间隔5 mm、层厚5 mm。相关参数设置:常规轴位T1WI扫描参数:32 cm×32 cm扫描野,回波时间(TE)6 ms,重复时间(TR)620 ms。非抑脂常规轴位T2WI扫描:32 cm×32 cm扫描野,TE 80 ms,TR 2 600 ms。非抑脂常规矢状位T2WI扫描:20 cm×20 cm扫描野,TE 120 ms,TR 3 400 ms。非抑脂斜轴位与冠状位T2WI扫描:20 cm×20 cm扫描野,TE 120 ms,TR 3 400 ms。
所有患者完成扫描后,检验图像由两位具备十年以上临床经验的影像科医师进行阅片,采取双盲阅片方法进行,遇到意见分歧后,由两位医师共同讨论,给出统一结果。
1.3 分期标准
直肠癌患者根据第七版《AJCC癌症分期手册》[4]中相关标准进行术后病理分期诊断。
M分期诊断标准:M0分期:即术前检查未发现远处转移,M1分期:即检查显示存在远端转移,如腹膜后淋巴结转移、腹膜淋巴结转移、肝肺淋巴结转移等。
N分期标准:采取MRI与CT检查时,发现淋巴结信号不均匀、边缘模糊不清、不规则,长径超过5 mm,即可确诊为阳性。
T分期诊断标准:即患者棘手MRI或CT检查,T1~T2期:即患者病变段肠壁无向外突出结节、肠壁外缘增强扫描显示光滑,肠壁外层结构清晰。T3期:即患者病灶局部检查显示,有小斑片影存在肠管周围直肠间隙,CT检查高密度影、条索状或MRI检查低信号,增强扫描检查肠壁有向外突出结节或凹凸不平、外缘不光滑。T4期:患者接受MRI或CT扫描检查,患者病灶部位周围脏器与病变段肠管之间间隙消失,增强扫描显示界限不清楚[5]。
1.4 观察指标
①比较术后病理诊断、MRI检查、多层螺旋CT检查T分期结果;②对比术后病理诊断、MRI检查、多层螺旋CT检查N分期结果
1.5 统计学方法
采用SPSS 21.0统计软件分析数据。计量资料以均数±标准差()表示,采用t检验;计数资料以频数(n)、百分率(%)表示,采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 术前CT检查结果分析
以病理诊断结果为金标准,与病理诊断结果比较术前直肠癌患者CT诊断符合53例,符合率为70.67%;其中T1~T2期CT检查符合10例,符合率为58.82%;T3期CT检查符合26例,符合率为78.79%;T4期CT检查符合17例,符合率为68.00%。在直肠癌术前分期诊断中CT技术低估12例、高估10例。见表1。
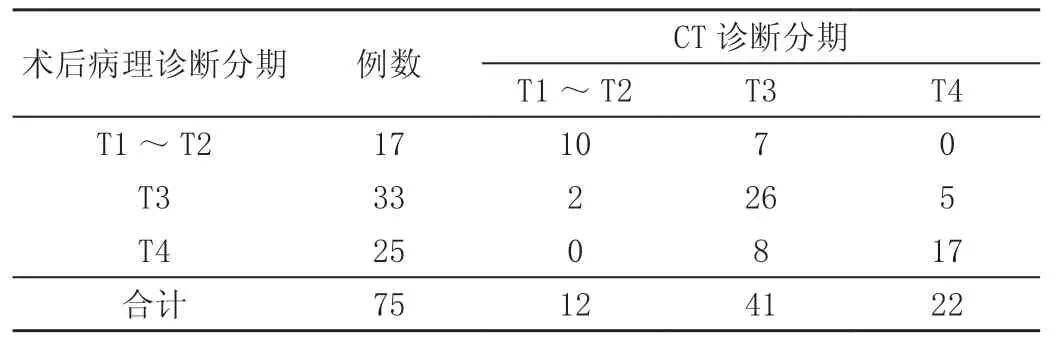
表1 术前CT与病理诊断结果对比 单位:例
2.2 MRI检查分析
与术后病理分期检查对比,术前MRI分期诊断的符合人数64例,符合率为85.33%;其中T1~T2期MRI检查符合14例,符合率为82.35%;T3期MRI检查符合29例,符合率为87.88%;T4期MRI检查符合21例,符合率为84.00%。在直肠癌术前分期诊断中MRI技术低估5例,高估6例。见表2。
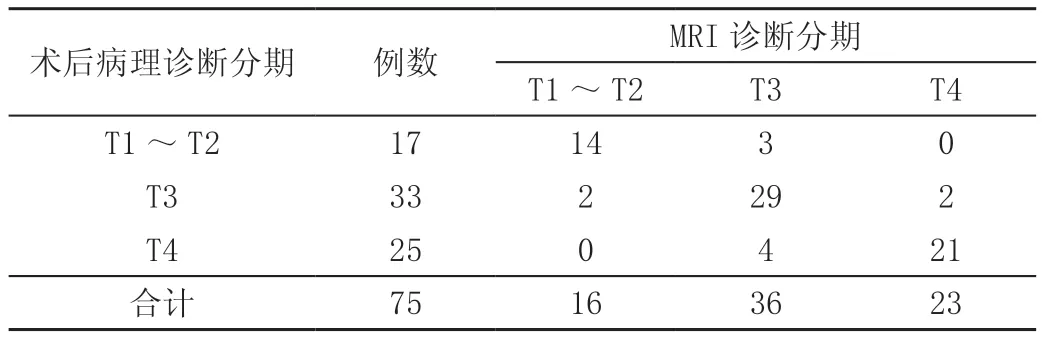
表2 术前MRI与病理诊断结果对比 单位:例
2.3 对比两种方法诊断符合率
结合表1、表2可知,术前CT检查T分期符合率70.67%(53/75)低于MRI检查的85.33%(64/75),差异有统计学意义(χ2=4.700,P<0.05)。
2.4 比较术前N分期诊断符合率
以术后病理诊断结果为金标准,MRI检查N分期阳性36例,符合率为81.82%(36/44),阴性25例,符合率为80.65%(25/31);CT检查阳性符合人数为28 例,符合率为63.64%(28/44),阴性符合人数为20例,符合率为64.52%(20/31)。两种方法诊断N分期阳性符合率对比,MRI诊断N分期61例,符合率为81.33%(61/75);CT诊断N分期48例,符合率为64.00%(48/75),MRI诊断N分期符合率显著高于CT检查(χ2=5.672,P<0.05)。见表3。
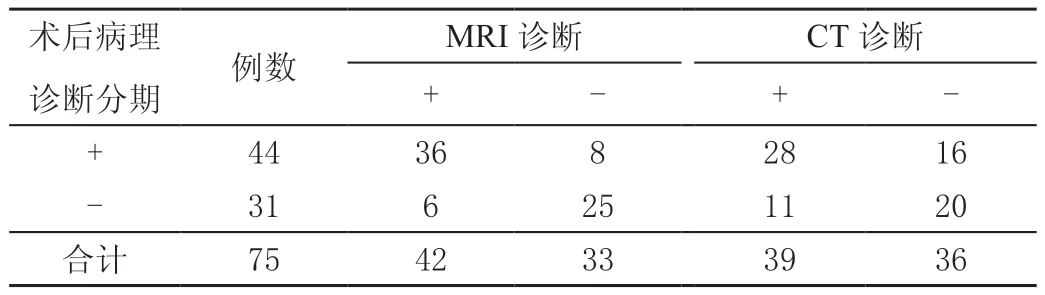
表3 不同方法诊断直肠癌N分期结果 单位:例
3 讨论
直肠癌是临床消化科多发性肠道肿瘤疾病,主要病变部位在乙状结肠与直肠交界区域、齿状线之间,其致病因素复杂多样,发病机制更是复杂,目前医学界尚无法完全阐述其发病机制与病因。大部分学者普遍认为,遗传因素、社会环境、生活饮食习惯等与直肠癌的发生、进展存在必然联系[6-7]。在很长一段时间内,直肠癌在欧美等发达国家较为常见,而近年来,随着我国社会经济发展,人们饮食结构、生活方式改变,人口老龄化加剧等,造成我国直肠癌患病率逐年升高,且出现明显年轻化趋势,已成为威胁我国人们生命安全、生存健康的主要疾病因素[8]。
直肠癌发病的早期缺少特异性症状表现,早期发现率较低,仅为10.0%左右。对于直肠癌而言,早期诊断对制定疾病治疗方案,改善患者预后至关重要[9-10]。目前,临床对于直肠癌主要采取外科手术治疗,但手术存在一定局限性,对于小息肉伴癌浸润或T1期肿瘤疾病,可进行早期局部切除手术;对于T3/T4期患者,癌灶侵袭肠壁,肿瘤分期较高,手术疗效并不理想;针对这类患者,一般需要利用放化疗等新辅助治疗手段,使肿瘤分期程度降低,为手术治疗创造更合适条件,提高手术成功率,减少术后复发与转移风险[11]。可见术前直肠癌分期诊断在疾病的诊断中意义重大。
目前,临床常用诊断方法包括MRI、CT、超声等,其中超声可重复性差,且对术者技术水平依赖较高,一般不用于直肠癌诊断。CT与MRI技术的诊断价值成为人们研究重点。本研究显示,术前CT诊断T分期符合率70.67%低于MRI检查的85.33%,差异有统计学意义(P<0.05);MRI诊断N分期总符合人数61例,符合率为81.33%;CT检查N分期总符合人数48例,符合率为64.00%,MRI诊断符合率显著高于CT诊断(P<0.05),进一步证实,在直肠癌术前分期诊断中,与CT技术相比,MRI技术更具优势。经分析,CT技术具备定位准确、伪影少、空间分辨率高等优点,在直肠癌术前诊断中被广泛应用,受到广大学者青睐。但随着研究深入,部分学者指出[12],CT技术在早期直肠癌分期诊断中,敏感性相对较低,存在较高漏诊率。MRI技术在直肠癌诊断中具备显著优势,可实现多层成像,对软组织分辨率高,不仅可对肌层结构、直肠黏膜层清晰显示,同时对肿瘤周围组织器官、形态、大小与部位等可有效显示,在T2WI上呈现出低信号影特点。
综上所述,在直肠癌术前分期诊断中,CT技术诊断准确性相对较低,建议采取MRI技术作为术前诊断的首选措施,值得推广。

