区域引流在完全腹腔镜全胃手术后瘘并发症诊疗中的应用
张迎峰,蒋 恒,方 征,周连帮
(1.安徽医科大学第二附属医院普通外科,安徽 合肥,230601;2.安徽医科大学第一附属医院普通外科)
胃位于上腹部中央位置,有肝脏、胆囊、胰腺、结肠等器官与之相邻,腹腔镜下根治性全胃切除术需要切除全胃并清扫胃周淋巴结,手术范围及创伤较大。加速康复外科理念的应用为胃癌治疗带来新的机遇和挑战。该理念认为手术后不放置腹腔引流管是安全的,并能加速患者康复[1]。国内外已有多个中心针对胃手术后是否放置引流管进行了研究[2-4],目前尚无定论,且尚无中心针对引流管在全胃手术中的治疗作用开展相关研究。本研究回顾分析了2016年11月至2020年2月接受完全腹腔镜全胃切除术的280例患者的临床资料,结合我科手术方式及围手术期管理经验提出“区域引流”的理念,旨在探讨全胃手术后建立区域引流的安全性及必要性。
1 资料与方法
1.1 临床资料 回顾分析2016年11月至2020年2月我院收治的接受完全腹腔镜全胃切除术的280例胃癌患者的临床资料,其中男158例,女122例;33~75岁,平均(60.0±7.1)岁,BMI平均(22.5±3.8)kg/m2。合并高血压132例、糖尿病56例、冠心病5例;36例有腹部手术史,吸烟史78例,饮酒史92例。ASA分级Ⅰ级50例、Ⅱ级203例、Ⅲ级27例。术后25例患者出现瘘,其中2例为吻合口漏,15例为十二指肠残端漏,8例胰瘘。发生瘘的患者及一般患者的年龄、BMI、术前营养指标、TNM分期等一般资料差异均无统计学意义(P>0.05)。见表1。
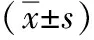
表1 两组患者临床资料的比较
1.2 纳入与排除标准 纳入标准:(1)经胃镜及病理学检查确诊为胃癌,肿瘤位于胃体、胃底、贲门,需行完全腹腔镜下根治性全胃切除术;(2)无绝对手术禁忌证;(3)无腹膜种植;(4)无远处脏器、远处淋巴结转移;(5)告知患者及家属,取得理解并签署知情同意书;(6)术后病理提示切缘阴性;(7)手术均由同一手术团队完成。排除标准:(1)不能行R0切除;(2)有腹膜或远处脏器或远处淋巴结转移;(3)须谨慎对待的相对禁忌证及注意事项:《麻醉技术分级管理制度》中所规定的3级或以上级别的患者,视为相对禁忌证,应谨慎对待,手术须充分准备;(4)严重心肺疾病不能耐受全麻手术。
1.3 手术方法
1.3.1 淋巴结清扫 采用5孔法布局,行完全腹腔镜手术,探查腹腔,根据肿块位置确定胃切除范围及淋巴结清扫范围。行D2根治性全胃切除,清扫1、2、4d、4sb、5、6、7、8a、9、10、11d、11p、12a组淋巴结。
1.3.2 消化道重建 采用食管空肠手工吻合方式[5],充分游离食管,距屈氏韧带25 cm处将空肠提至食管下方,在空肠对系膜侧肠壁用超声刀做2.5 cm开口,用3-0倒刺线由吻合口左侧向右侧全层连续缝合后壁6~8针,继而用新倒刺线缝合前壁6~8针。在两根缝合线线尾交汇处打结,完成食管空肠端侧吻合。距屈氏韧带20 cm处用切割闭合器离断近端空肠,切割闭合器距食管空肠吻合口40 cm处对近端空肠与远端空肠行侧侧吻合,采用3-0倒刺线缝合共同开口。
1.3.3 区域引流的建立 腹部区域划分[6]:(1)幽门下区:No.6组淋巴结引流区域;(2)幽门上区:No.5及No.12a组淋巴结引流区域;(3)胰腺上区:No.7、No.8a、No.9、No.11p组淋巴结引流区域;(4)脾门区:No.4sb、No.10、No.11d组淋巴结引流区域。
1.3.4 引流管的放置 经左侧、右侧腹部5 mm切口放置乳胶引流管接负压球。左侧引流管沿脾门区域放置(图1),右侧引流管经幽门区域,在胰腺上区左侧放置(图2)。左、右侧引流管尖端置于食管-空肠吻合口后壁及食管裂孔间隙内,形成交叉对流(图3)。即左侧引流管引流胰腺上区左侧区域、脾门区及食管-空肠吻合口左侧区域,右侧引流管引流幽门上区、幽门下区、胰腺上区右侧区域、十二指肠残端及食管-空肠吻合口右侧区域。
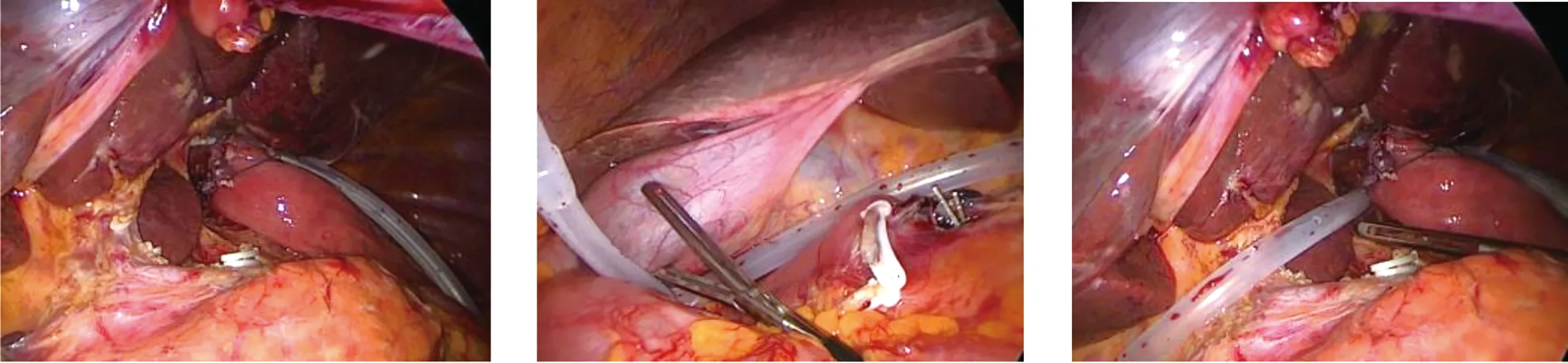
图1 左侧引流管放置 图2 右侧引流管放置 图3 区域引流建立
1.4 观察指标 详细观察并记录发生瘘的患者引流管的侧别(左/右/双侧)、引流液性状、日均引流量、伴随症状及置管时间、引流管相关并发症发生情况(管周疼痛、拔管困难、拔管断裂、腹痛、疝)。
2 结 果
2.1 瘘相关并发症引流管指标 本研究中,吻合口漏发生率为0.7%,十二指肠残端漏发生率为5.4%,胰瘘发生率为2.9%。吻合口漏、十二指肠残端漏、胰瘘患者的引流管表现(引流管侧别、引流液性状、日均瘘量、伴随症状)差异均有统计学意义(P<0.05)。见表2。
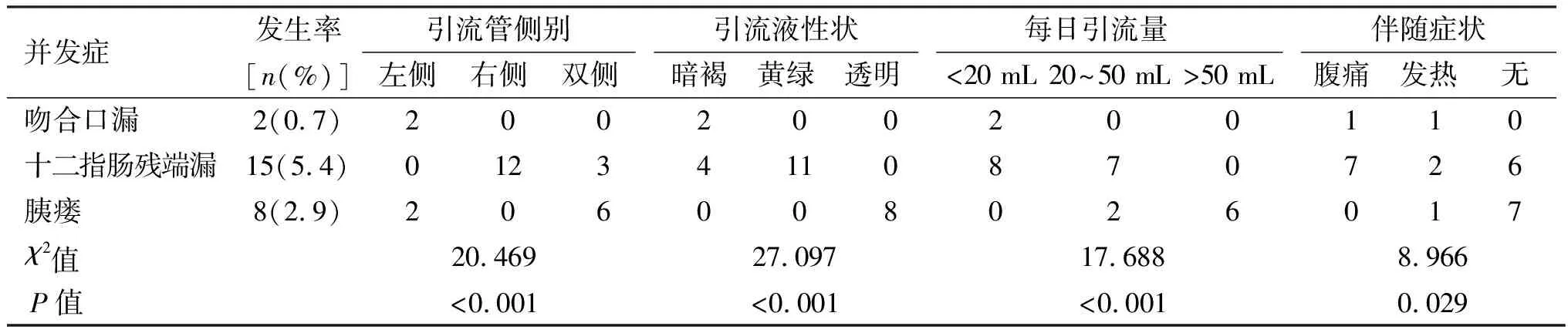
表2 瘘相关并发症引流管指标(n)
2.2 患者置管时间及并发症分布情况 瘘发生组置管时间较未发生组延长,差异有统计学意义(P<0.05),管周疼痛、拔管困难情况差异亦有统计学意义(P<0.05),腹痛例数差异无统计学意义(P>0.05)。两组患者均未发生拔管断裂及疝。见表3。
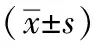
表3 患者置管时间及并发症分布情况
3 讨 论
常规胃癌手术后需放置腹腔引流管,以引流腹腔内积液、渗液,观察术后创面渗血或出血情况,术后发生胃肠道瘘时可起到引流作用。吻合口漏、十二指肠残端漏严重影响胃癌患者的预后,是围手术期死亡的重要因素[7-8]。胰瘘也是胃癌手术后的常见并发症之一,引流液淀粉酶升高系胃手术后腹腔脓肿形成的重要危险因素[9]。近年随着加速康复外科理念的提出,国内外学者亦进行了许多尝试[10-11]。而加速康复外科理念中提出的胃手术后不放置引流管,目前尚无循证医学证据支持。且国内外相关研究的重点主要针对放置引流管对患者恢复速度、并发症发生率等指标的影响,未针对瘘发生后引流管相关指标的早期诊断、早期治疗作用对患者预后的影响进行研究[2-4]。本中心采用食管空肠手工吻合的方式重建消化道,瘘发生率明显降低,吻合口漏发生率仅为0.7%,十二指肠残端漏发生率为5.4%,低于文献报道[7],但仍无法完全避免瘘的发生。且瘘在临床上诊断较复杂,对患者危害较大。因此,本中心结合手术方式及患者围手术期管理经验提出“区域引流”的理念。
根据胃的4支固有血管及系膜的集束化分布特点,将胃的手术区域分为4部分:(1)幽门下区;(2)幽门上区:(3)胰腺上区;(4)脾门区[6]。合理放置引流管需满足以下条件:(1)应用最少的管道覆盖足够的区域;(2)引流效果良好;(3)诊断并发症灵敏度高,同时具有治疗效果。我科改进引流管的放置方法,双侧引流管交叉对流,建立区域引流。本研究结果表明,吻合口漏、十二指肠残端漏、胰瘘的组间引流管表现差异有统计学意义(P<0.05)。2例患者发生吻合口漏,以腹痛、发热为症状,同时左侧引流管引出少量褐色液体。分析原因,食管空肠手工吻合方式以左侧为缝合起始部,缝合较密,局部黏膜缺血坏死导致瘘的发生,且每日引流量<20 mL,符合“迷你吻合口漏”的诊断标准[12]。发生十二指肠残端漏15例,因十二指肠残端位于幽门区,因此多为右侧引流管(12例)阳性表现;3例患者因引流量较大(每日20~50 mL),双侧引流管均引出黄绿色液体。胰瘘高发原因系切除胰腺上包膜,引流量较发生吻合口漏、十二指肠残端漏的患者更大,而左、右侧引流管均对胰腺上区域具有引流作用,因此多表现为双侧引流管同时引流出透明样液体(6例);2例患者肿瘤位于胃底,清扫时切除胰腺尾部上包膜,仅有左侧引流管引流出透明样液体。因此,建立区域引流,掌握其规律可协助早期诊断瘘的类型及严重程度。
建立区域引流对于瘘的治疗也具有重要价值。郑涛等[13]的研究表明,当确诊肠外瘘前即存在主动引流的患者病死率显著低于无主动引流的患者。本组患者经临床症状及引流管表现早期明确诊断,采取相应治疗措施,均经保守治疗顺利痊愈后出院。针对我科2例迷你吻合口漏,手工吻合法建立吻合口需游离3~5 cm食管[5],吻合完成后因食管弹性牵拉原因,吻合口缩入胸腔,如术中未放置引流管,则存在误诊风险,同时也难以准确穿刺置管引流。针对十二指肠残端漏患者,根据引流管表现,可判断瘘口大小,同时早期通畅引流也可避免消化液腐蚀残端周围血管引起病情进一步恶化。针对胰瘘患者,依据国际胰瘘研究小组发布的2016版术后胰瘘的定义和分级系统[14],8例患者均属于生化漏,早期的诊断及通畅引流,使患者均未向B级瘘或C级瘘发展。留置引流管的患者术后第1天拔除导尿管后即下床活动,恢复顺利的患者1周后即可拔除引流管。出现瘘并发症的患者正常进食、引流量连续3天<5 mL、无其他伴随症状后可拔除引流管。因发生瘘的患者置管时间延长,管周疼痛、拔管困难情况较一般患者多(P<0.05)。两组腹痛例数差异无统计学意义(P>0.05),且均未出现引流管断裂、疝等并发症。因此,放置引流管是安全的。理想的引流管特点为质软易弯曲,表面光滑易拔除,不易瘪陷,对组织刺激小,不易变质、堵塞、断裂,X线不能透过[15]。笔者采用乳胶管接负压球,直径5 mm,放置后常规采用主动引流方式,可获得良好的临床效果。
综上,完全腹腔镜下根治性全胃切除术创伤巨大,具有复杂性及特殊性。随着手术技术的提高,瘘的发生率及严重程度明显下降,但仍然无法完全避免。加速康复外科施行的前提是患者安全得到保障。因此,我们认为,全胃手术后准确放置引流管建立区域引流必要且安全,对于瘘的早期诊断、瘘类型的判断、严重程度判断及治疗均具有重要意义。

