周剂量白蛋白结合型紫杉醇联合SOX方案一线治疗晚期胃癌的临床观察
缪 敏,丁 倩,蔡培培,王 磊
(1.扬州大学医学院附属扬州市江都区人民医院肿瘤科,江苏 扬州 225200;2.扬州大学医学院附属扬州市江都区人民医院药剂科,江苏 扬州 225200)
2020年全球癌症报告显示,胃癌(GC)发病率、病死率在全球分别位于第5位、第4位。我国GC也是临床消化系统常见的恶性肿瘤之一,超过70%的患者确诊时已处于晚期,错失了最佳的手术时机[1]。主体为化疗的综合疗法能够使晚期GC患者的生存期延长,并可使其生活质量(QOL)提升。多项临床试验显示,多西他赛(DXT)+奥沙利铂(OXA)与替吉奥治疗晚期GC可获得较好效果[2-4]。白蛋白结合型紫杉醇(PTX)是一类新型抗微管药物,其借助纳米技术使疏水性PTX结合人血白蛋白,而传统PTX的助溶剂是聚乙烯蓖麻油,存在高过敏风险,因此应用白蛋白结合型PTX前不需要对其实施预处理,另外特殊结构决定了它较普通紫杉类药物有更高的疗效,同时也保证了安全性,因此成为临床应用研究的热点。三药联合方案可能会导致严重骨髓抑制,且晚期GC患者体质状况相对较差,常有并发症导致贫血、营养不良、纳差等,给予周剂量使用白蛋白结合型PTX,加强监测血常规、肝肾功能等以保证患者疗效及安全性。周剂量白蛋白结合型PTX+SOX方案用于晚期GC的一线治疗,可实现一定疗效。
1 资料与方法
1.1一般资料:对我院2017年1月~2019年12月期间医治的38例晚期GC展开回顾性分析,本次研究经过本院医学伦理委员会同意。纳入标准:①所有患者均需胃镜和病理学组织检查确诊,Her-2阴性;②均为不能手术切除的转移性GC(Ⅳ期);③CT、MRI等影像学检查证实至少有一个可测量的病灶。④根据美国东部肿瘤协作组ECOG体能情况评分(由0~1 分构成);⑤预期的生存时间≥3个月;⑥既往从未接受过化疗,且无严重并发症及化疗禁忌证;⑦未干预时血常规、心电图(ECG)基本无异常,肝肾功能≤正常水平1.5倍。⑧此项研究得到扬州市江都区人民医院伦理委员会准可,患者与其家属皆于《知情同意书》上签字。涉及患者合计38例,女17例,男21例;年龄46~68岁,平均58.5岁;骨、肝、附件、腹膜、肺与淋巴结等单部位转移12例,另有26例为多发部位转移。
1.2治疗方法:每例患者皆采取周剂量白蛋白结合型PTX+SOX治疗方案。排除化疗禁忌证,用药详情为:白蛋白结合型PTX 125 mg/m2,静脉滴注,无需抗过敏预处理,时间0.5 h,第1天、第8天给药;OXA(130 mg/m2,静脉滴注时间在2 h以上,第1天);替吉奥[40~60 mg/次(若体表面积1.25 m2以下,为40 mg/次,若为1.25~1.5 m2,为50 mg/次,若在1.5 m2以上,为60 mg/次)],2次/d,不间断口服2 w,1个周期为3 w。每周期均评价不良反应,每2个周期进行疗效评估,若患者发生美国国立癌症研究所常见毒副反应评定标准NCI-CTCAE5.0版规定的Ⅳ度化疗毒副反应,则需下调化疗药物剂量,为上一个周期剂量的75%。每例患者的化疗周期应≥2个,化疗有效的患者治疗周期不得超过8个。化疗期间予止吐、保护胃黏膜等对症支持治疗。随访截止日期为2021年3月30日,在随访期间观察治疗效果及毒副反应,定期复查血常规、尿常规、肿瘤指标、肝肾功能、凝血功能、心电图、免疫功能、CT和MRI。
1.3观察指标
1.3.1近期疗效:每2个周期对相关影像学检查(含CT、MRI等)展开复查,同时评估疗效,疗效评估的标准参考RECIST 1.1标准(实体瘤客观疗效评定标准),其中CR为目标病灶消失;PR为基线病灶长径总和下降30%;SD为基线病灶长径总和有所下降然未实现PR或有提高但未实现PD;PD为基线病灶长径总和提高20%或见1个或若干个新病灶。总有效率(RR)=(CR例数+PR例数)/总例数×100%,疾病控制率(DCR)=(CR例数+PR例数+SD例数)/总例数×100%。
1.3.2远期疗效:无进展生存期(PFS):自随机化分组治疗起到PD或死亡之间的时间。总生存期(OS)即自随机化分组治疗起到死亡(或末次随诊时间)。
1.3.3安全评定标准:根据NCI-CTCAE 5.0化疗药物毒副反应评定标准,由0~Ⅳ级构成。观察患者的血液学与非血液学毒性。
1.4免疫功能检测:测定方法为流式细胞法(FCM),患者化疗前、化疗结束分别采集2 ml外周静脉血,放到EDTA-二钾抗凝管内,充分摇动,使均匀,待用。加入20 μl标记抗体于TruCOUNT 试管,取抗凝血100 μl,加入试管中,混匀后避光染色20 min,加入FACS裂解液450 μl,摇匀,避光15 min,流式细胞仪(美国BD公司,FACS Calibur)检测外周血中CD4+T细胞、CD8+T细胞及CD4+、CD8+,利用Cellquest软件获取并分析相关数据;所有标本在送检后4 h内完成检测分析。
1.5统计学方法:采用SPSS22.0进行t及χ2检验;用 Kaplan-Meier法绘制生存曲线。
2 结果
2.1近期疗效:所有入组38例患者均可评估疗效,共完成149个周期化疗,平均3.92个周期。CR 2例(5.3%),PR 14例(36.8%),SD 15例(39.5%),PD 7例(18.4%),RR 42.1%。
2.2远期疗效:截止2021年3月30日,OS 6~21个月,中位OS 15个月;PFS、中位PFS各是3~17个月、7个月。
2.3血清肿瘤标志物水平的比较:待治疗结束,在血清CA125、CEA与CA19-9水平上,与未干预时相比,皆明显降低,差异有统计学意义(P<0.05)。见表1。

表1 化疗前后血清CEA、CA199和CA125水平比较
2.4淋巴细胞亚群在外周血中的变化:干预结束CD8+T细胞相较未干预时为降低明显,CD4+/CD8+比值与未干预时相比为明显上升,差异均有统计学意义(均P<0.05)。干预前后CD4+T细胞未见明显改变,差异无统计学意义(P>0.05)。见表2。
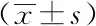
表2 化疗前后淋巴细胞亚群在外周血中变化情况
2.5毒副反应:在血液毒性上,以血小板(PLT)减少、贫血与中性粒细胞(NEC)减少为主;在非血液毒性上,以脱发、乏力、神经毒性、便秘、呕吐与恶心为主。见表3。
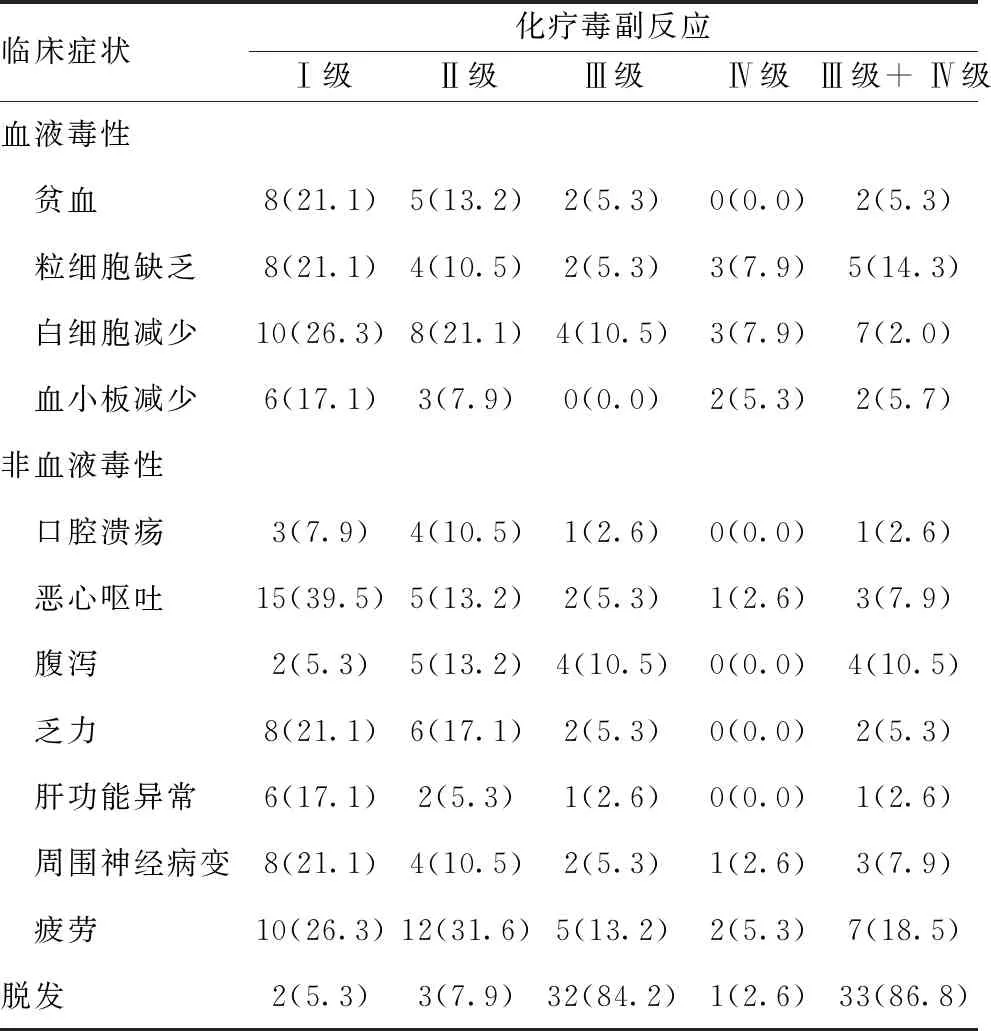
表3 不良反应发生率比较[n(%),n=38]
3 讨论
胃癌早期症状隐匿,进展迅速,易发生转移,大多数患者确诊时已为晚期而失去了根治手术机会,只能采取内科为主的综合治疗。化疗治疗晚期GC的主要途径,相较最佳支持治疗,其能够使OS延长,使QOL得到改善[5]。
晚期胃癌的化疗目前尚无公认的标准化疗方案。胃癌化疗临床上常应用氟尿嘧啶类、奥沙利铂、紫杉醇类、蒽环类等化疗药物,单药治疗晚期胃癌效果欠佳,采用多药联合化疗方案提高晚期胃癌患者的临床预后[6]。研究发现,免疫疗法、分子靶向药物的出现可显著延长GC患者的OS。
普通紫杉醇具有疏水性,需聚乙烯蓖麻油作为助溶剂,同时导致一些患者发生严重过敏反应。白蛋白结合型(PTX)是一类新型纳米PTX,其载体为人血白蛋白,紫杉醇是活性成分,利用白蛋白的自然生物特性,通过gp-60介导内皮细胞跨膜转运和蛋白SPARC的相互作用可增加肿瘤组织对紫杉醇的摄取和蓄积,其独特的作用机制显著增加了肿瘤细胞内有效药物浓度,从而显示出更强的抗肿瘤活性[7],且毒副作用较轻[8]。总之,PTX凭借自身独特结构能够使肿瘤组织内PTX浓度大幅提升,增强抗肿瘤效果,无需抗过敏与激素预处理,对输液设备也无特殊要求,0.5 h可完成输液,应用具有安全性与便捷性。
本研究予以三药联合方案化疗治疗晚期胃癌的总有效率为42.1%,疾病控制率为81.6%,中位OS 15个月,中位PFS 7个月,与国内报道大致相似。患者治疗完成后的肿瘤指标(CEA、CA199、CA125)较治疗前明显下降,说明周剂量白蛋白结合型紫杉醇联合SOX方案治疗晚期胃癌疗效可,降低相关肿瘤标志物。一般情况下,机体内部CD4+、CD8+T细胞呈动态平衡状态,若此动态平衡被打破,如CD4+T细胞减少,而CD8+T细胞增多,CD4+/CD8+之比降低,使得机体免疫机能减弱,由此引发肿瘤。研究发现,干预结束CD8+T细胞为降低表现,患者干预结束CD4+/CD8+比值与未干预时相比显著上升,可见晚期GC患者经过干预机体细胞免疫机能有所提升与恢复。CD4+T细胞比例在治疗前、后无明显变化,可能与我们研究中入组人群有关。患者不良反应一般为Ⅰ~Ⅱ级,Ⅲ~Ⅳ级少,血液毒性方面中性粒细胞减少、贫血、血小板减少较为常见,非血液毒性主要为乏力、便秘、恶心、呕吐、神经毒性、脱发,大部分患者经对症处理后均好转,均能耐受。入组病例中无严重过敏反应及严重心血管事件发生。
综上所述,周剂量使用白蛋白结合型紫杉醇联合SOX方案患者安全性较好,疗效肯定,值得临床进一步推广应用。因本研究中选择入组患者年龄<70岁,ECOG 0-1分体质较好的患者,相对更易耐受三药联合方案,本研究病例数相对较少,后期仍需进行大样本随机对照实验评估其疗效及安全性。

