藜麦粉的抗氧化能力及体外降糖降脂特性研究
佐兆杭,徐炳政,宫 雪,庞惟俏,王 颖,3,4,5
(1.黑龙江八一农垦大学 食品学院,黑龙江大庆 163319;2.青岛琅琊台集团股份有限公司,山东 青岛 266400;3.国家杂粮工程技术中心,黑龙江大庆 163319;4.粮食副产物加工与利用教育部工程研究中心,黑龙江 大庆 163319;5.黑龙江省农产品加工与质量安全重点实验室,黑龙江 大庆 163319)
藜麦(Chenopodium quinoaWilld)是一种与传统谷物相比具有更高营养价值的天然食物资源,正在成为当前和未来保证人类健康和安全的高品质食品[1]。藜麦不仅含有种类丰富的矿物质、维生素、亚油酸,其含有的高品质蛋白含有大量含硫氨基酸[2],具有较强的清除自由基能力、降糖降脂功效、抗炎抗乳糜泻和抗心血管疾病等多种生理功能[3-5],是联合国国际粮农组织(FAO)认证的唯一一种可以满足人类所有基本营养需求的植物,被誉为最适宜人体的“全营养食品”[6-7]。
评价提取物的抗氧化性被认为是分离其所含具有抗氧化性的植物化学物质之前的重要步骤[8]。抗氧化剂添加到食品中可以减少酸败,延缓有毒氧化产物的形成,保持营养品质,延长保质期[9]。藜麦作为天然抗氧化剂受到关注,因其可能在抑制组织和膜内的自由基和氧化链反应中发挥重要作用[10-11]。PAŚKO等[12]研究表明,藜麦具有较高的清除自由基能力。相启森等[13]研究发现,藜麦乙醇提取物具有良好的体外抗氧化活性,并能够有效抑制自由基引发的亚油酸过氧化和牛血清白蛋白氧化降解。此外,PAŚKO等[14]研究还发现,藜麦可减少脂质过氧化并增强大鼠血液及部分脏器的抗氧化能力。
2017年,第八版国际糖尿病联盟(IDF)数据集显示,全球约有4.25亿糖尿病患者,预计到2045年,全球糖尿病患者人数将增至7亿[15-16]。由于高流行性、高发病率及高死亡率,糖尿病目前已成为第七大死亡原因[17-18]。研究表明,长期摄入高糖高脂饮食导致体内糖脂代谢紊乱,是诱发糖尿病的主要原因之一[19-20]。通过使用体外酶测定抗高血糖和抗高血脂活性以及使用肥胖、高血糖小鼠模型测定降糖降脂效果,可以评估藜麦抑制2型糖尿病风险的潜力[21]。葡萄糖苷酶和胰脂肪酶分别是消化复合碳水化合物和吸收甘油三酯脂质的重要酶,而藜麦中酚含量显示出对其强烈的抑制作用[22]。SHI等[23]研究发现,藜麦蛋白水解物能抑制3T3-L1细胞分化过程中脂质的积累。刘盈盈等[24]研究藜麦对糖尿病模型小鼠降糖效果,结果表明,藜麦可有效降低小鼠的空腹血糖值,同时降低血清中果糖胺水平,并提高胰岛素水平。
目前对于藜麦的研究主要集中在对不同产地、不同品种以及不同加工(熟化)方式对藜麦的物化特性、营养成分及功能特性方面,对于不同制粉工艺加工出的藜麦的抗氧化和降糖降脂特性的研究较少。因此,本研究探究对比脱皮制粉工艺和传统制粉工艺对藜麦抗氧化活性和降糖降脂生理功能的影响,旨在为藜麦的脱皮加工提供理论依据,推进藜麦加工产业的发展。
1 材料和方法
1.1 材料与试剂
供试材料为青海白色甜藜麦原粮籽粒,购买于青海海西海杭生态农业科技有限公司。
1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(2,2-azinobis-(3-ethylbenzth iazoline-6-sulphonate,ABTS)、2,4,6-三吡啶基三嗪(TPTZ)、α-葡萄糖苷酶、胰脂肪酶、抗坏血酸(Vc)(美国Sigma公司);T-AOC试剂盒(南京建成生物工程研究所);福林酚、丙酮、高氯酸、无水乙醇、盐酸、氢氧化钠(均为分析纯)(天津市恒兴化学试剂制造有限公司)。
1.2 仪器与设备
XQ200型多功能高速粉碎机(上海广沙工贸有限公司);GL-20G-II离心机(北京冠普佳科技有限公司);UV2500型紫外可见分光光度计(天美科学仪器有限公司);AUW220D电子天平(沈阳科瑞永兴化玻仪器有限公司);DHG-9000电热鼓风烘箱(吴江市永联机械设备厂)。
1.3 方法
1.3.1 藜麦粉的制备方法藜麦原粮粉(FP)制备:藜麦→清理→粉碎→过筛→藜麦原粮粉。
藜麦脱皮粉(PP)制备:藜麦→清理→脱皮→粉碎→过筛→藜麦脱皮粉。
藜麦原粮粉制备操作要点[25]:选择颗粒饱满、无虫害、无霉变的藜麦加水调节水分,润麦水分调节为15%,润麦时间24 h。将藜麦置于MLU-202型磨粉机中粉碎,粉碎后粉末分别过0.180 mm网筛,筛下物即为所需的藜麦原粮粉,出粉率为84.0%。
藜麦脱皮粉制备操作要点:选择颗粒饱满、无虫害、无霉变的藜麦加水调节水分,润麦水分调节为15%,润麦时间24 h。用脱皮机除去藜麦外表的麸皮,脱皮率控制在8%左右。将藜麦置于MLU-202型磨粉机中粉碎,将粉碎后的粉末分别过0.180 mm网筛,筛下物即为所需的藜麦脱皮粉,出粉率为76.4%。
1.3.2 藜麦提取物的制备将1.0 g藜麦原粮粉样品用45 mL 60%乙醇在温度50℃、100 W条件下超声提取1 h,混合物在3 800×g条件离心15 min,过滤混合物,残渣用70%丙酮提取一次,合并2次上清液在40℃下真空浓缩,于4℃保存备用。藜麦脱皮粉提取方法同上。将提取液稀释成不同梯度溶液(0.2、0.4、0.6、0.8、1.0 mg/mL),设置Vc为阳性对照,分析体外抗氧化效果。将提取液稀释成不同梯度溶液(0.1、0.2、0.3、0.4、0.5 g/mL),分析体外降糖降脂效果。
1.3.3 总酚含量测定参考DINI等[26]的方法略有改动。吸取100 μL提取液,与1 mL Folin-Ciocalteu试剂混匀,加入3 mL 10% Na2CO3,加蒸馏水至10 mL,室温静置1 h,在765 nm处测定吸光度。
1.3.4 总黄酮含量测定吸取5 mL提取液,与0.5 mL 5%的NaNO2溶液混匀,室温静置6 min,然后加入0.5 mL的10% Al(NO3)3溶液,摇匀后静置6 min,加入4 mL 4% NaOH摇匀,加60%乙醇至25 mL,室温下反应20 min,在510 nm波长处测定吸光度[27]。
1.3.5 皂苷含量测定吸取80 μL提取液,加0.4 mL 5%香草醛-冰醋酸和1.2 mL高氯酸,密封后65℃水浴加热20 min。冷却后,加10 mL的冰乙酸,混合均匀,在波长550 nm处测定吸光度[28]。
1.3.6 总抗氧化能力测定采用T-AOC试剂盒测定,结果表示为U/g。
1.3.7 清除DPPH自由基的能力参考张雪春等[29]的方法略有改动。用DPPH和乙醇配制浓度为2×10-4mol/L的DPPH溶液,于4℃保存备用。将不同质量浓度的提取物(50 μL)加入到100 μL的DPPH溶液中。混合均匀,在室温静置30 min(避光),在517 nm处测定吸光度A1;同时测定4 mL 2×10-4mo1/L DPPH自由基溶0.5 mL的60%乙醇混合液的吸光值AC。

1.3.8 清除ABTS自由基的能力在0.2 mL提取液中加入7.8 mL ABTS+·溶液于比色皿中,充分混合,于波长734 nm处测定吸光值A1,用样品溶剂乙醇代替样品测定空白组A0,以PBS缓冲液代替ABTS+·溶液,测定吸光值

1.3.9 羟自由基清除率测定吸取提取液4.0 mL,加入2 mL 6 mmol/L FeSO4溶液、2 mL 8 mmol/L水杨酸溶液和2 mL 6 mmol/L H2O2溶液,摇匀后室温静置30 min,在510 nm处测定其吸光度[31]。
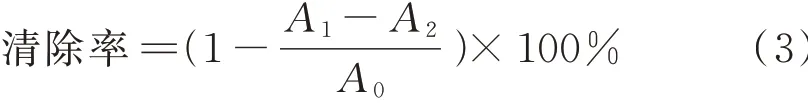
式中,A0为空白管的吸光度;A1为样品管的吸光度;A2为蒸馏水时的吸光度。
1.3.10 超氧阴离子自由基清除能力将样品提取 液、30 mmol/L PMS、338 mmol/L NADH和72 mmol/L NBT溶 解 在pH为7.4的0.1 mmol/L PBS缓 冲液中,静置反 应5 min后,在560 nm处 测定吸光度[32]。

式中,A1为对照组的吸光度;A2为样品的吸光度。
1.3.11 体外降糖试验取20 mg/mL的样品溶液150 μL,加入125 μL α-葡萄糖苷酶溶液(0.02 mg/mL)后在37℃下静置10 min,加入300 μL 1.0 mol/L HCl,加入200 μL碘液(0.01 mol/L)混合显色。加蒸馏水稀释至5 mL。用PBS缓冲液作为空白组,测定吸光度[33]。
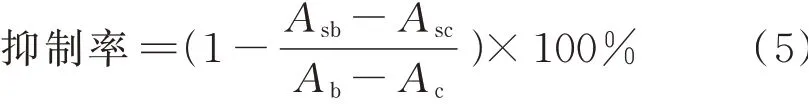
式中,Asb表示样品空白吸光度;Asc表示样品对照吸光度;Ab表示阴性空白吸光度;Ac表示阴性对照吸光度。
1.3.12 体外降脂试验参考杨龙佳等[34]的方法略有改动。在锥形瓶内加入2.5 mL 0.5 mol/L的磷酸缓冲液(pH=7.4)、4 mL 0.229 g/mL的PVA-油乳化液、1 mL不同质量浓度提取液。37℃水浴5 min,加入2 mg/mL胰脂肪酶1 mL,15 min后加乙醇15 mL终止反应,用PBS缓冲液作为对照管中提取液。
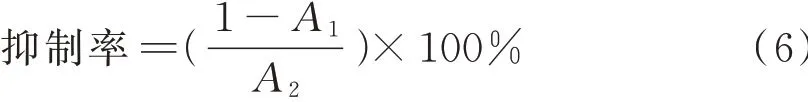
式中,A1表示样品吸光度;A2表示对照吸光度。
1.4 数据分析
平行试验3次,通过SPSS 20.0软件进行数据处理,采用Duncan's多重比较进行显著性分析(P<0.05),采用Excel、Origin软件绘制相关图表。
2 结果与分析
2.1 总酚、总黄酮和皂苷含量
由表1可知,FP粉的总酚、总黄酮和皂苷的含量均显著高于PP(P<0.05);藜麦皮中含有大量皂甙,其味苦而辛辣,采用脱皮的方法可有效除去皂甙[35]。GÓMEZ-CARAVACA等[36]研究指出,对藜麦不同程度的脱皮会降低其酚类和皂苷类物质含量,脱皮程度越大,其含量越低;HEMALATHA等[37]研究表明,藜麦原粮粉的总黄酮含量高于脱皮粉,这与本研究结果一致;熊成文等[38]研究发现,皂苷主要集中在藜麦籽粒的外壳中,种皮皂苷含量达99.2 mg/g。
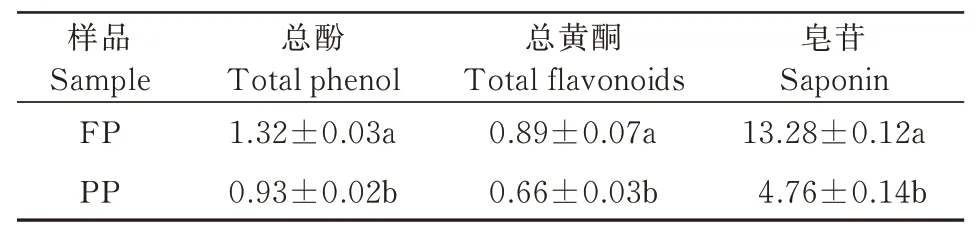
表1 总酚、总黄酮和皂苷含量Tab.1 Total phenol,total flavonoids and saponin content mg/g
2.2 总抗氧化能力
由图1可知,随样品提取物浓度的增大,其总抗氧化能力随之增大,FP提取物的总抗氧化能力显著高于PP提取物(P<0.05)。对照品Vc总抗氧化能力显著高于FP和PP提取物(P<0.05),藜麦提取物具有较强的总抗氧化能力。FP及PP提取物的总抗氧化能力差异可能在于总酚、总黄酮含量以及总酚和总黄酮的存在方式不同。

图1 不同质量浓度藜麦原粮粉和脱皮粉的总抗氧化能力Fig.1 Total antioxidant capacity of quinoa raw grain powder and peeling powder in different mass concentrations
2.3 DPPH自由基清除率
由图2可知,FP提取物的DPPH自由基清除率显著高于PP提取物(P<0.05),并随提取物质量浓度的增加而增大。对照品Vc的DPPH自由基清除能力显著高于FP和PP提取物(P<0.05),但FP提取物对DPPH自由基清除率仍达89.5%,表明藜麦具有较强的DPPH自由基清除能力。AJAYI等[39]提出藜麦叶提取物中的酚类化合物可能是其抗氧化潜力的原因。ABDERRAHIM等[40]研究进一步发现,酚类物质含量直接影响到提取物的DPPH自由基清除率,且自由酚比结合酚对DPPH自由基清除率的影响更大。

图2 不同质量浓度藜麦原粮粉和脱皮粉的DPPH自由基清除率Fig.2 DPPH radical scavenging ratio of quinoa raw grain powder and peeling powder in different mass concentrations
2.4 ABTS自由基清除率
不同质量浓度藜麦原粮粉和脱皮粉的ABTS自由基清除率如图3所示。
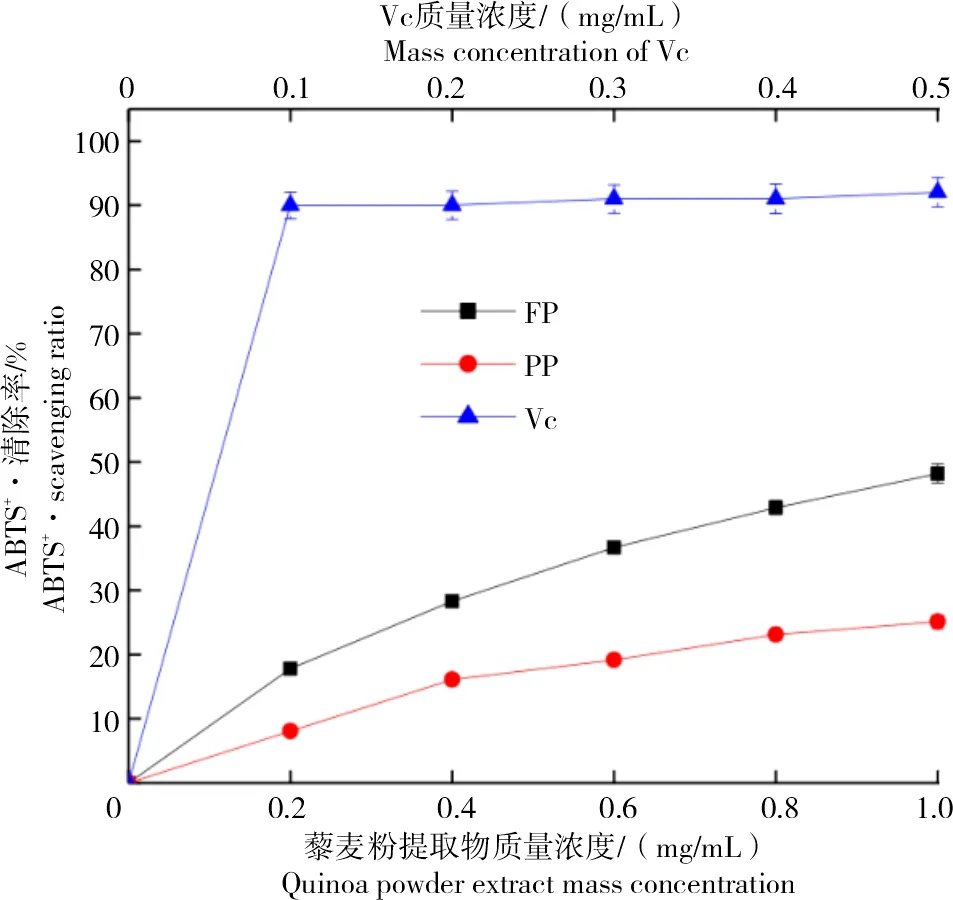
图3 不同质量浓度藜麦原粮粉和脱皮粉的ABTS+·清除率Fig.3 ABTS+·scavenging ratio of quinoa raw grain powder and peeling powder in different mass concentrations
从图3可以看出,FP提取物的ABTS+·清除率显著高于PP提取物(P<0.05),并随提取物质量浓度的增加而增大。FP和PP提取物的ABTS+·清除能力显著低于对照品(P<0.05),但FP提取物仍具有一定的ABTS+·清除能力。程安玮等[41]对4种豆类的ABTS+·清除率进行研究,发现豆类中游离态提取物的ABTS+·清除率明显低于结合态提取物。MADHUJITH等[42]研究得出,大麦中结合态多酚的自由基清除能力高于游离态多酚。因此,推测藜麦经过脱皮处理后,其酚类物质存在方式发生改变,导致ABTS+·清除率降低。
2.5 羟自由基清除率
从图4可以看出,FP提取物·OH清除率显著高于PP提取物(P<0.05),并随提取物质量浓度的增加而增大。对照品Vc与FP和PP提取物的·OH清除能力差异显著(P<0.05),但FP提取物对·OH最大清除率仍达90.4%,表明藜麦具有较强的·OH清除能力。乔丽华等[43]研究表明,·OH清除率和总酚含量及提取物浓度呈正相关;SOVRANI等[44]研究发现,脱皮程度越大,小麦粉的酚类物质含量及抗氧化活性越低。由此推测,藜麦经过脱皮处理后,其酚类物质含量减少,导致·OH清除率降低。
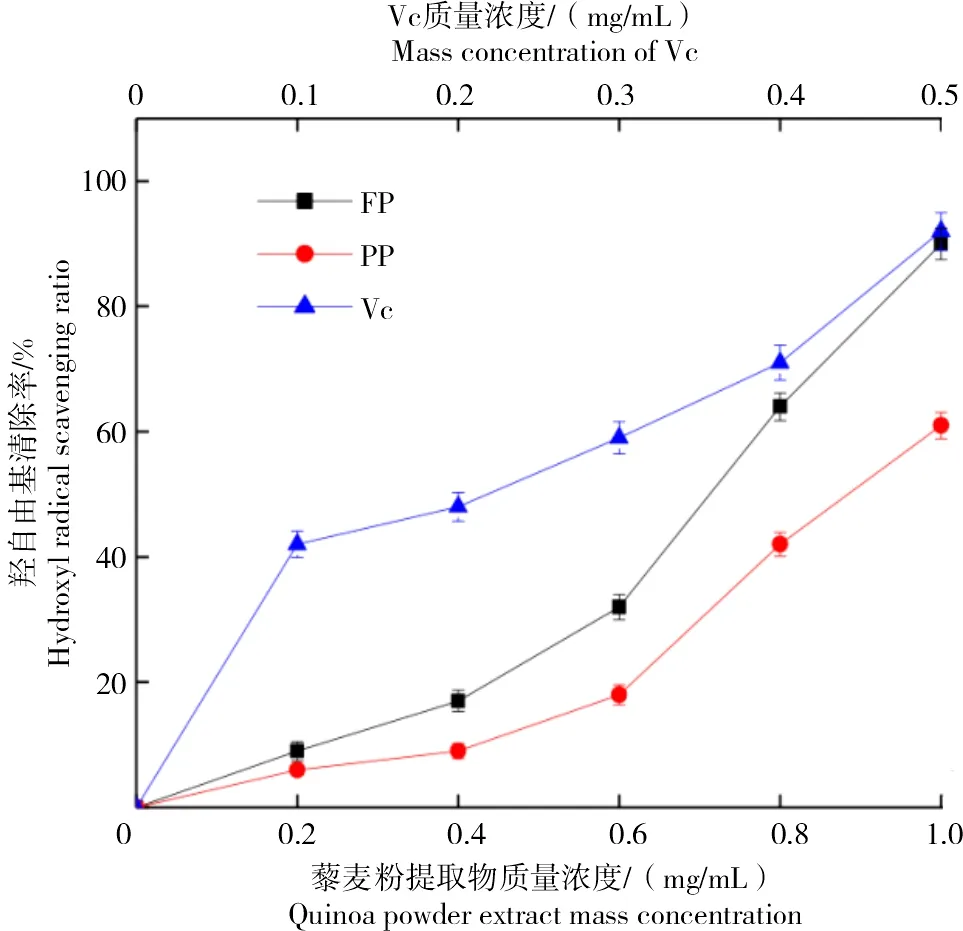
图4 不同质量浓度藜麦原粮粉和脱皮粉的羟自由基清除率Fig.4 Hydroxyl radical scavenging ratio of quinoa raw grain powder and peeling powder in different mass concentrations
2.6 超氧阴离子自由基清除率
由图5可知,FP提取物的O2-·清除率显著高于PP提取物(P<0.05),且随提取物质量浓度的增加而增大。对照品Vc与FP和PP提取物清除O2-·的能力差异显著(P<0.05),但FP提取物对O2-·最大清除率仍达86.5%,表明藜麦具有较强的O2-·清除能力。程安玮等[41]研究表明,O2-·清除率与游离态类黄酮的含量呈正相关。推测藜麦经过脱皮处理后,其游离态类黄酮的含量减少,导致O2

图5 不同质量浓度藜麦原粮粉和脱皮粉的超氧阴离子自由基清除率Fig.5 Superoxide anion radical scavenging ratio of quinoa raw grain powder and peeling powder in different mass concentrations
-·清除率降低。
2.7 α-葡萄糖苷酶抑制率
α-葡萄糖苷酶是复合碳水化合物消化的重要酶,可以通过抑制其活性来抑制淀粉的分解,将葡萄糖的吸收速率降低,从而抑制餐后血糖升高。通过使用体外酶活性测定来评估降糖效果,可以作为藜麦降低2型糖尿病风险的酶学依据[21]。从图6可以看出,随着藜麦提取物质量浓度增大,FP与PP对酶的抑制率逐渐增强;低质量浓度的藜麦提取物对酶的抑制作用表现为负值,表明其对酶有活化作用。IC50值越小表明其抑制能力越强,当酶活力为1 U/mL时,FP的IC50值(0.34 g/mL)显著小于PP(0.48 g/mL)(P<0.05),表明FP体外降糖活性高于PP。TANG等[45]研究发现,藜麦中的酚类和黄酮类物质能够抑制消化系统中的α-葡萄糖苷酶和胰脂肪酶,KWON等[46]研究证实了葡萄糖苷酶抑制活性与酚类物质有关。因此,推测可能与含有的酚类化合物及其组成差异相关。
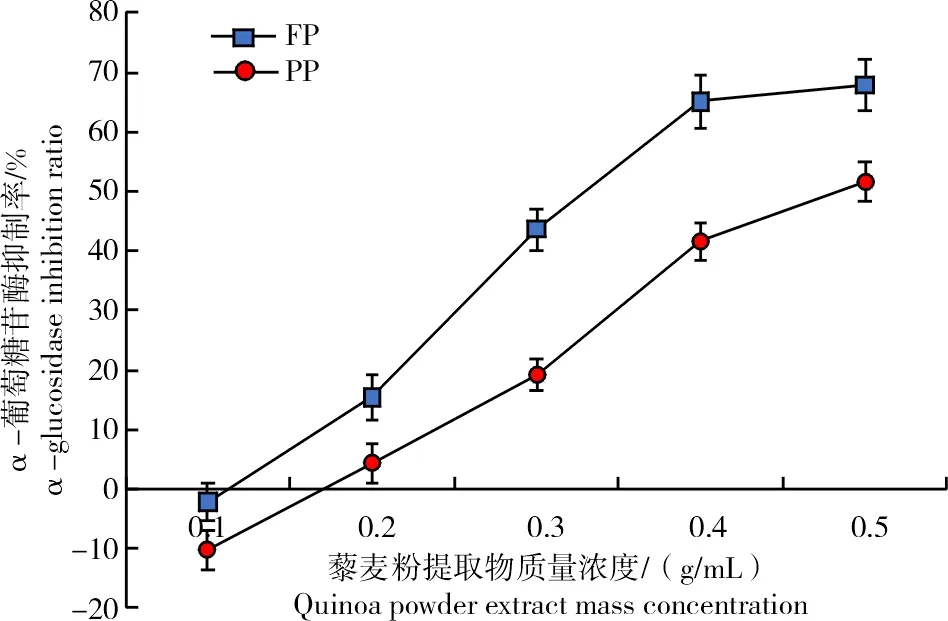
图6 不同质量浓度藜麦原粮粉和脱皮粉的α-葡萄糖苷酶抑制率Fig.6 α-glucosidase inhibition ratio of quinoa raw grain powder and peeling powder in different mass concentrations
2.8 胰脂肪酶抑制率
胰脂肪酶是吸收甘油三酯脂质的重要酶,胰脂肪酶抑制剂可有效抑制脂肪酶对脂肪的分解作用,从而减少脂肪吸收、降低血脂水平和控制体质量,因此,通过体外酶测定评估的降脂效果,可以作为藜麦降低肥胖、心脑血管疾病风险的酶学依据。由图7可知,随着藜麦提取物质量浓度增大,FP与PP对胰脂肪酶的抑制率逐渐增强;FP的最低抑制率大于PP。且当酶活力为1 U/mL时,FP的IC50值(0.28 g/mL)显著小于PP(0.41 g/mL)(P<0.05),FP的体外降脂活性高于PP。刘莉等[47]研究证实,植物多酚类物质对α-葡萄糖苷酶和胰脂肪酶具有较强的抑制作用。GAWLIK-DZIKI等[11]进一步研究表明,藜麦酚类成分具有抗氧化性抑制脂肪酸酶活性等作用。由此可推测,藜麦对胰脂肪酶表现出的抑制作用可引起血脂水平降低,进而减少心血管等相关疾病发病率及并发症。
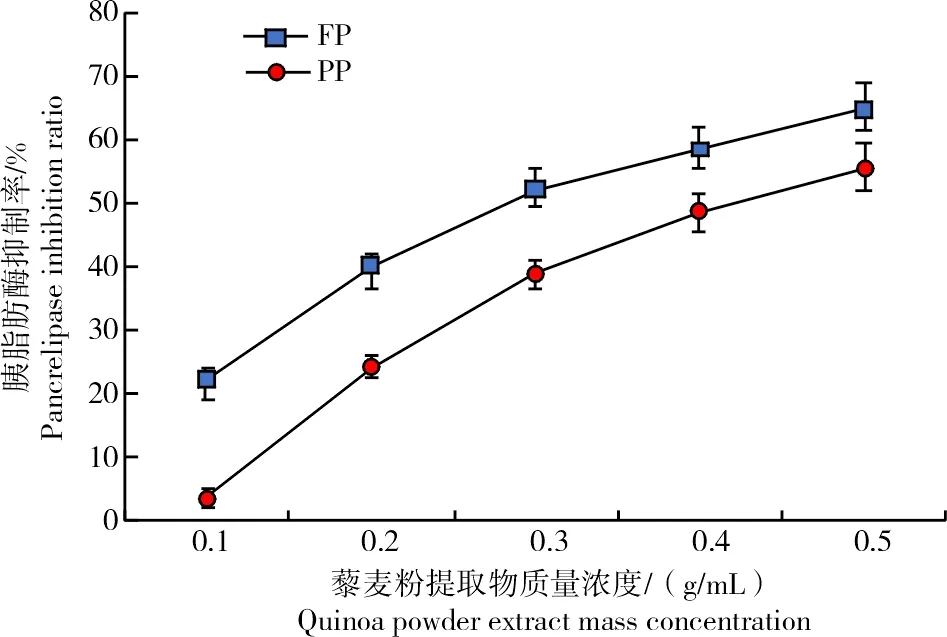
图7 不同质量浓度藜麦原粮粉和脱皮粉的胰脂肪酶抑制率Fig.7 Pancrelipase inhibition ratio of quinoa raw grain powder and peeling powder in different mass concentrations
3 结论与讨论
本研究结果表明,脱皮处理会降低藜麦粉提取物的总酚、总黄酮及皂苷含量(P<0.05)。FP提取物中的总多酚、总黄酮和皂苷含量均高于PP。同时PP提取物的总抗氧化能力、DPPH、ABTS+·、·OH和O2
-·清除能力均显著低于FP提取物(P<0.05),但仍具有较强的自由基清除能力及抗氧化活性。FP和PP提取物对α-葡萄糖苷酶和胰脂肪酶均有抑制作用,可通过抑制酶活性降低血糖血脂水平,从而在一定程度上具有预防糖尿病及心血管相关疾病的潜力。本研究证实,脱皮处理后的藜麦粉仍保留了较强的抗氧化活性和降糖降脂生理功能,为藜麦加工利用及其功能成分的开发提供了理论依据,有利于推进藜麦加工产业的发展。但本研究依旧有一定局限性,例如,关于不同制粉工艺得到的藜麦粉,其降糖降脂机制仍需要通过细胞试验和动物试验等手段进行更深入的探讨。

