对一道高考题的赏析及改编
郭军民 钟辉生
(1.江西省赣州一中 2.江西省赣州市教育教学科学研究所)
1 真题赏析与解析
真题(2022 年全国乙卷)常温下,一元酸HA的Ka(HA)=1.0×10-3.在某体系中,H+与A-不能穿过隔膜,未电离的 HA 可自由穿过该膜,如图1所示.
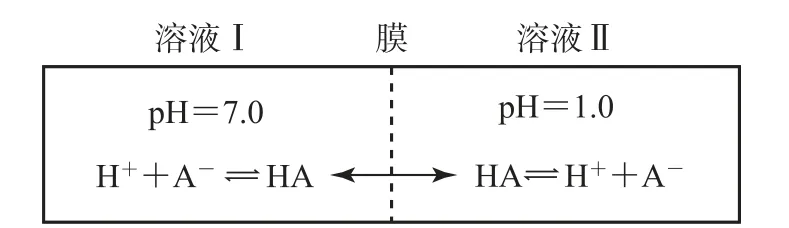
图1
设溶液中c总(HA)=c(HA)+c(A-),当达到平衡时,下列叙述正确的是( ).
A.溶液Ⅰ中c(H+)=c(OH-)+c(A-)
C.溶液Ⅰ和Ⅱ中的c(HA)不相等
D.溶液Ⅰ和Ⅱ中的c总(HA)之比为10-4
赏析试题以类似于膜电池和化学方程式的形式呈现,将化学与物理知识融合,考查弱电解质的电离平衡、溶液中微粒的关系、电离度计算等知识.HA分子可以自由穿过隔膜,导致隔膜两侧的HA 浓度保持相等,类似于物理上的连通器.试题很好地考查了高中化学核心素养——宏观辨识与微观探析、变化观念与平衡思想.
解析溶液Ⅰ的pH=7,所以c(H+)=c(OH-),故选项A 应为c(H+)<c(OH-)+c(A-),错误.常温下溶液Ⅱ的pH=1.0,即溶液中c(H+)=0.1mol·L-1,根据

2 试题改编及解析
离子交换膜,是一种含离子基团的、对溶液中的离子具有选择透过能力的高分子膜.以下2道题是根据离子交换膜的种类对高考试题进行的原创改编.
变式1常温下,一元酸HA 的Ka(HA)=1×10-3.在某体系中,H+、未电离的HA 和其他粒子不能穿过隔膜,A-可自由穿过该膜,如图2所示.下列叙述正确的是( ).

图2
A.若溶液Ⅰ中c1(A-)=0.1 mol·L-1,则溶液Ⅱ中c2(HA)=10-4mol·L-1
C.溶液Ⅰ和溶液Ⅱ的溶质种类不可能相同
D.溶液Ⅰ和溶液Ⅱ中由水电离产生的H+浓度之比为106∶1

若左侧c1(A-)=0.1mol·L-1,由Ka求得溶液Ⅰ中c1(HA)=10 mol·L-1,则溶液Ⅱ中c2(HA)=10-5mol·L-1.两侧溶液中溶质不确定,若溶液Ⅰ中只有HA 一种溶质时,则选项B 成立.溶液Ⅱ的溶质是HA 和其强碱盐,相当于中性的缓冲溶液,经计算,时溶液呈中性(注:计算公式为pH=).如果溶液Ⅰ的溶质是单一的HA,经计算:c1(HA)=10mol·L-1时,pH=1.如果溶液Ⅰ的溶质是HA 和NaA,亦相当于pH=1的缓冲溶液,经计算时满足条件;若溶液Ⅰ的溶质是HA和强酸强碱盐(如NaCl),因强酸强碱盐不影响溶液酸碱性,c1(HA)=10 mol·L-1时,pH=1,选项C 不正确.溶液Ⅰ中水电离产生的H+浓度c水(H+)=10-13mol·L-1,而溶液Ⅱ中由水电离产生的H+浓度c水(H+)=10-7mol·L-1,则两者之比为1∶106,选项D 错误.故答案为B.
变式2常温下,一元酸HA 的Ka(HA)=1×10-3.在某体系中,A-、未电离的HA 和其他粒子不能穿过隔膜,H+可自由穿过该膜,如图3所示.设溶液中c总(HA)=c(HA)+c(A-),当达到平衡时,下列说法正确的是( ).

图3
A.常温下0.01mol·L-1NaA 的pH=8
B.若溶液Ⅰ的pH=2,则溶液Ⅱ中的c(H+)=0.01mol·L-1
C.溶液Ⅰ和溶液Ⅱ中的c(HA)之比为1∶10
D.溶液Ⅰ和溶液Ⅱ的导电能力相等
解析选项A 是水解的计算,令平衡时溶液中HA浓度为xmol·L-1,可得

(完)

