胆囊癌切除术围手术期输血与术后生存和无瘤生存的关系
邢跃栊 曲 赛 倪德生 陈国梁 张 凯 杨 佳
1.浙江省金华市人民医院肝胆胰胃肠外二科,浙江金华 321000;2.浙江省金华市人民医院神经内科,浙江金华 321000;3.甘肃省人民医院普外科,甘肃兰州 730000
胆囊癌是发生于胆囊的恶性肿瘤,在全世界范围内消化道系统肿瘤种中居第三位,常见于发展中国家及一些经济不发达地区,癌症恶性程度高,患者预后极差,5 年总生存率低于5%[1-2]。目前胆囊癌的确切发病机制仍不明确,且因患者患病早期并无特异性临床症状,早期诊断较为困难,易被忽视或者误诊,大部分患者就诊时已属于局部晚期[3]。目前手术仍是胆囊癌的首选治疗方案,也是胆囊癌患者可能获得治愈的唯一途径[4]。但手术切除属于创伤性操作,患者术中出血风险较高,加之该癌症患者年龄偏高、术后发并发症较多,在围手术期进行输血有时难以避免[5]。而围手术期输血对恶性肿瘤患者术后生存及无瘤生存的影响仍存在争议。有研究指出[6-7],围手术期输血对胰腺癌、胃癌等恶性肿瘤患者术后无瘤生存、总生存期均存在不良影响,但也有报道[8]显示围手术期输血对恶性肿瘤术后生存及无瘤生存并无明显影响,而关于围手术期输血对胆囊癌患者术后生存及无瘤生存情况的影响如何则尚无针对性报道。基于此,本研究分析胆囊癌切除术围手术期输血对患者生存及无瘤生存的影响,为胆囊癌手术治疗提供一定参考。
1 资料与方法
1.1 一般资料
回顾性分析2015 年6 月至2019 年6 月于浙江省金华市人民医院和甘肃省人民医院接受胆囊癌切除术治疗的72 例患者临床资料,根据围手术期是否输血分为输血组33 例、非输血组39 例。纳入标准:顺利完成胆囊癌切除术,且经术后病理证实为胆囊癌;原发性胆囊癌;临床资料完整,随访至术后>24 个月。排除标准:术前接受其他抗肿瘤治疗;术前存在远处转移;同期合并其他恶性肿瘤;既往有肝胆手术病史;术前6 个月内有输血史;心肺肝肾功能不全;死因与胆囊癌进展或肿瘤复发无关;随访失联。本研究输血组包括在围手术期输悬浮红细胞、新鲜冰冻血浆或两者均有输注,未输血组患者未接受任何血制品的输注。本研究经医学伦理委员会批准(IBR-2017008-R)。
1.2 研究方法
1.2.1 资料收集 收集患者临床资料、术中资料和术后病理资料,统计患者的基本情况[性别、年龄、体重指数(body mass index,BMI)、临床表现、合并症、围手术期输血情况等]、病理特点(肿瘤部位、临床TNM 分期、组织学分级、组织侵犯)等。TNM 分期、组织学分级、组织侵犯参照美国癌症联合委员会与国际抗癌联盟联合制定的标准[9]。
1.2.2 随访 患者术后通过电话、住院病历、门诊等形式随访肿瘤复发情况及术后生存情况,术后第1 年每个月随访1 次,后每3 个月随访1 次,随访截至2021 年10 月。统计患者无瘤生存率、总生存率。
1.3 统计学方法
采用SPSS 22.0 软件对所得数据进行统计分析。患者一般资料的倾向性匹配评分法按1∶1 最近邻匹配法匹配。符合正态分布的计量资料以均数±标准差()表示,采用t 检验。计数资料以例数或百分比表示,采用χ2检验。生存分析采用Kaplan-Meier 法,生存率比较采用log-rank 检验,预后多因素分析采用Cox风险回归分析。以P <0.05 为差异有统计学意义。
2 结果
2.1 两组一般资料比较
由于基线资料,年龄、TNM 分期在两组中分布不均匀,经倾向性匹配评分法按1∶1 比例排除相关混杂因素,最终获得30 对基线资料均衡可比的患者。经倾向性匹配后,两组一般资料比较,差异无统计学意义(P >0.05)。见表1。
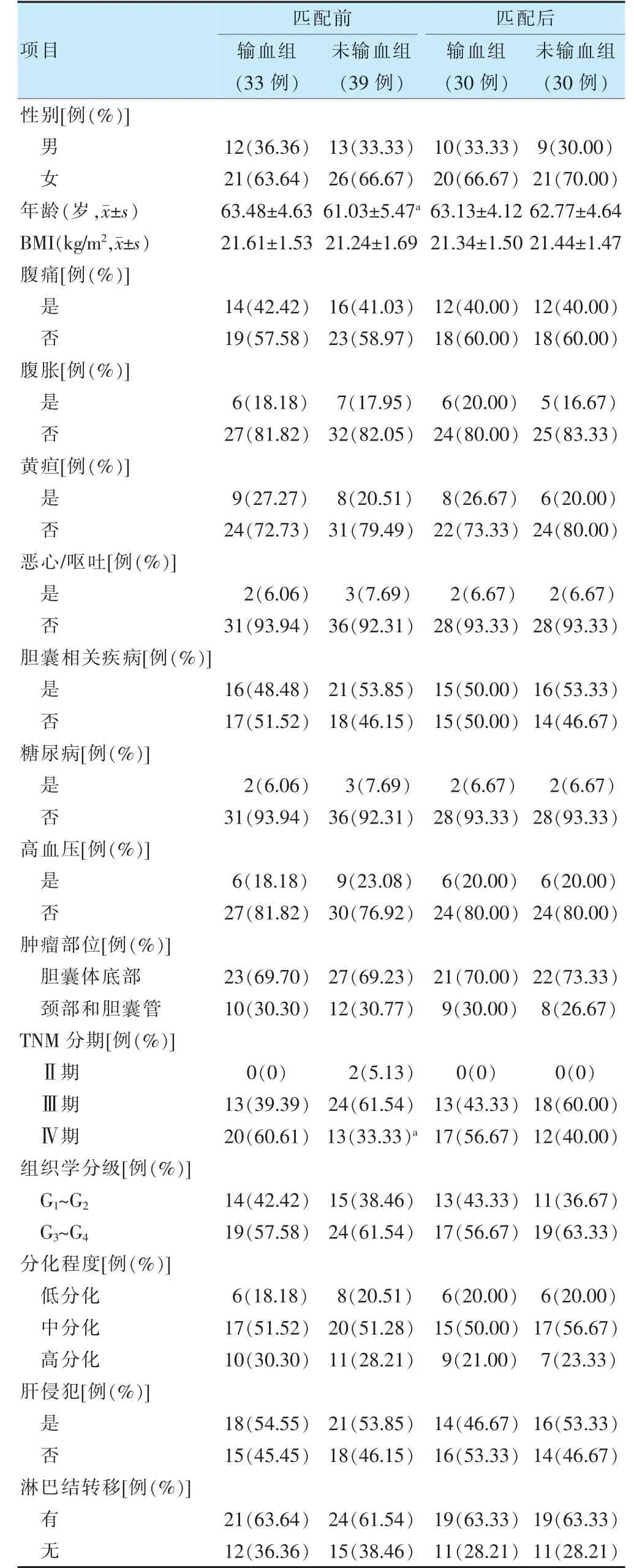
表1 两组一般资料比较
2.2 生存分析
随访截至2021 年10 月,输血组中位生存期为12 个月,未输血组中位生存期为24 个月;输血组术后1、2 年总生存率分别为50.00%和36.67%,未输血组术后1、2 年总生存率分别为73.33%和60.00%。两组总生存期比较,差异有统计学意义(χ2=4.338,P <0.05)。见图1。输血组术后1、2 年无瘤生存率分别为40.00%和26.67%,未输血组术后1、2 年无瘤生存率分别为63.33%和46.67%。两组无瘤生存期比较,差异有统计学意义(χ2=4.179,P <0.05)。见图2。
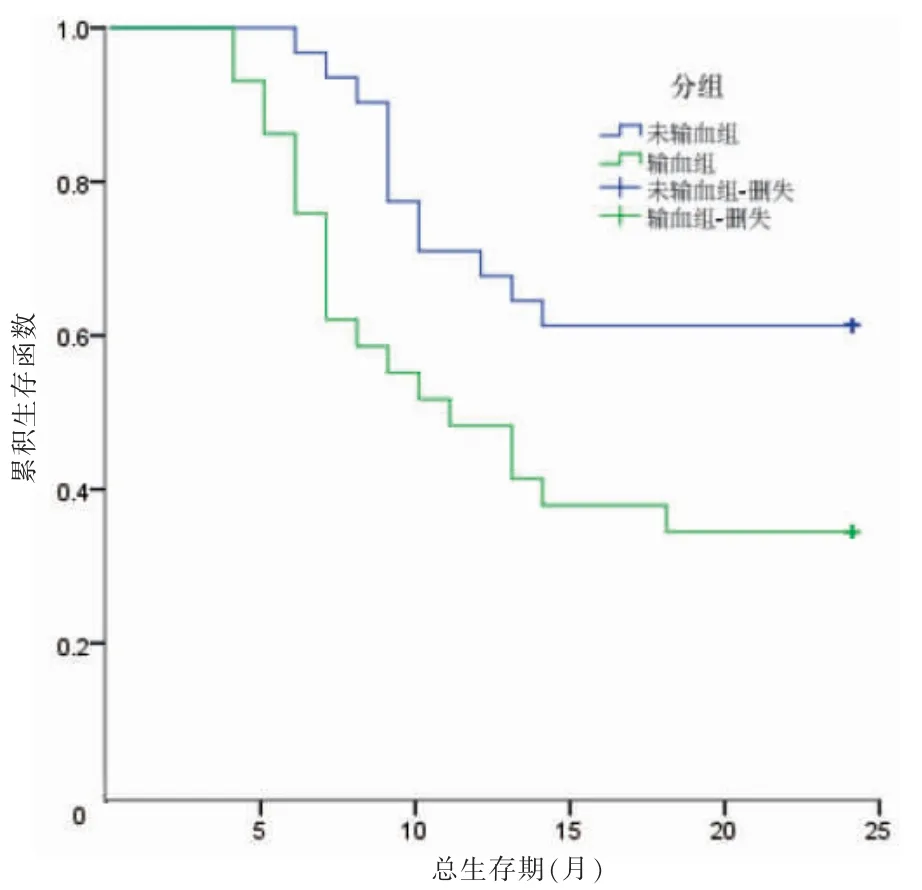
图1 两组术后2 年Kaplan-Meier 生存曲线
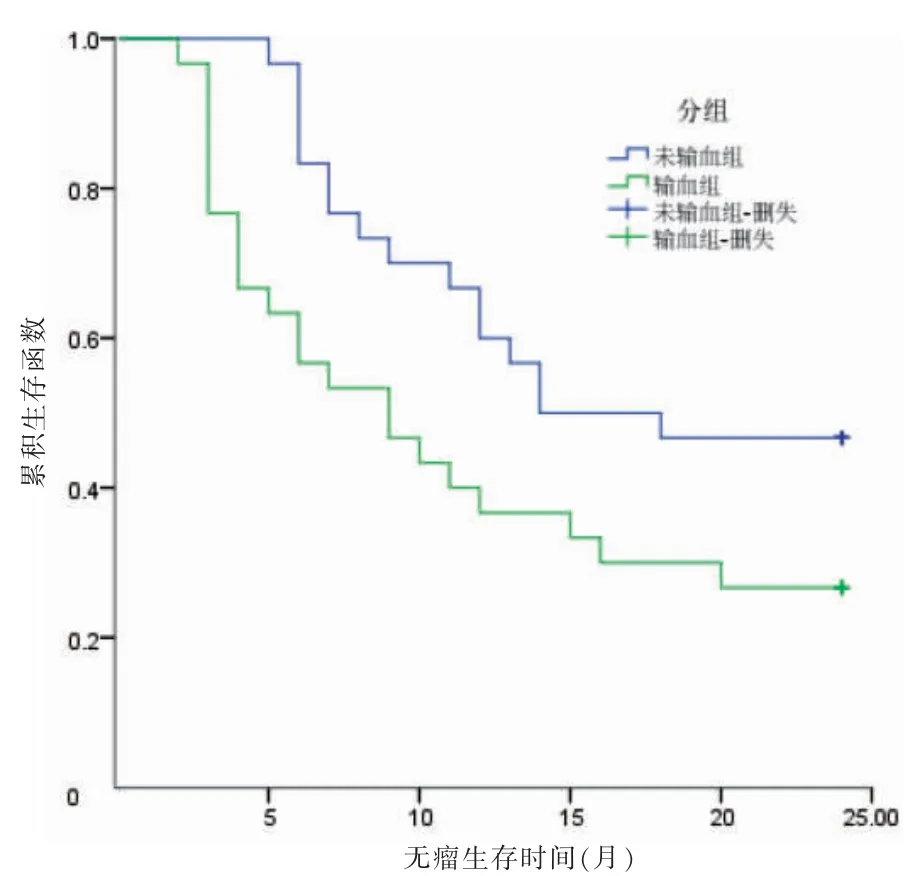
图2 两组术后2 年Kaplan-Meier 无瘤生存曲线
2.3 影响胆囊癌切除术后患者总生存、无瘤生存的Cox 风险回归模型分析
将性别(男=1、女=2),年龄(>60 岁=1、≤60 岁=2),BMI(>21.39 kg/m2=1、≤21.39 kg/m2=2),围手术期是否输血(输血=1、未输血=2),临床症状(各项症状中是=1、否=2),合并症(各项疾病中是=1、否=2),肿瘤部位(胆囊体底部=1、颈部和胆囊管=2),TNM 分期(Ⅲ期=1、Ⅳ期=2),组织学分级(G1~G2=1、G3~G4=2),分化程度(低分化=1、中分化=2、高分化=3),肝侵犯(是=1、否=2),淋巴结转移(有=1、无=2)情况纳入Cox风险回归模型。结果显示,在校正TNM 分期、肝侵犯因素后,围手术期输血使患者死亡风险增加2.021 倍,使患者肿瘤复发风险增加1.762 倍。见表2。绘制Schoenfeld 残差与实践t 的关系图判定比例风险假设,提示满足风险比例假设。见图3~4。
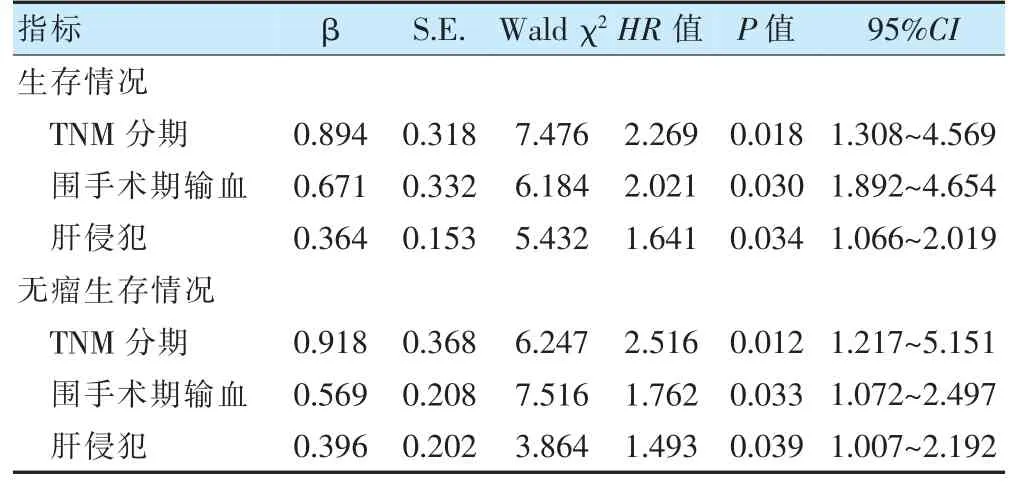
表2 影响胆囊癌切除术后患者总生存、无瘤生存的Cox 风险回归模型分析

图3 总生存期Cox 回归模型的Schoenfeld 残差趋势检验
图4 无瘤生存期Cox 回归模型的Schoenfeld 残差趋势检验
3 讨论
胆囊癌起病隐匿,具有高度恶性,且易发生区域淋巴结转移及肝脏转移,患者预后差[10]。近年来,胆囊癌发病率有逐年升高趋势,备受外科界关注[11]。手术仍是胆囊癌患者获得长期生存的首要治疗手段,但通过手术治疗后患者仍存在较高的复发风险[12]。针对行胆囊癌根治术的患者,术后如何延长其生存期及提高其生活质量仍是临床研究的重点内容之一。而李利红等[13]报道显示,围手术期输血可能通过影响机体免疫功能、增加恶性肿瘤患者术后感染及其他并发症风险等方面,增加患者肿瘤复发的风险、影响患者术后生存率。但目前围手术期输血在不同恶性肿瘤中的影响情况报道不一,部分学者[14-15]研究结果与李利红等[13]一致,认为输血会影响机体免疫、凝血等机制,进而影响患者预后;也有研究认为围手术期输血对恶性肿瘤患者预后来说是一个混杂因素[16],且关于行胆囊癌根治术的患者影响如何也少有报道,值得临床探究。
因肿瘤手术创伤性大,患者失血量大,大量失血后可造成患者术后体液紊乱、营养不良、免疫功能下降等不良影响,而输血则可增强患者携氧能力、改善患者血液微循环,进而能够改善患者术后的贫血症状和生活质量,故围手术期输血在恶性肿瘤手术中较为常见[17-18]。但现有研究显示[19],围手术期输血虽可改善患者术后贫血,但并不能提高疾病预后,甚至影响患者术后肿瘤复发率和生存率。本研究回顾性分析胆囊癌切除术患者临床资料,发现输血组与未输血组年龄、临床分期的资料存在明显差异,提示胆囊癌根治术后输血的多为高龄、临床分期晚的患者。通过倾向性匹配评分法排除混杂因素后,分析输血组和未输血患者总体生存情况和无瘤生存情况发现,输血组术后1、2 年总生存率、无瘤生存率低于未输血组,提示胆囊癌根治术患者围手术期输血可增加肿瘤复发风险,降低患者术后生存率。围手术期输血对患者术后生存及无瘤生存的影响可能与输血对机体免疫系统产生不良影响和发生输血相关并发症的等因素有关,尤其是围手术期输血可能会抑制机体免疫功能[20-21]。机体发挥正常的免疫功能需要淋巴细胞、单核细胞等免疫细胞相互作用,而有研究[22-23]指出,围手术期输血时,在输注的红细胞中不能完全清除白细胞,残留的白细胞和凋亡的细胞可能影响相关因子的生成,从而抑制激活Treg 细胞、抑制自然杀伤细胞,使机体处于免疫抑制状态,从而增加肿瘤复发风险,但具体机制仍有待深入探究。本研究Cox 风险回归分析显示,校正TNM 分期、肝侵犯后,围手术期输血使患者死亡和肿瘤复发的风险分别增加2.021、1.762 倍,但温志坚等[24]在分析BMI 与胆囊癌患者预后的关系时发现,有无输血并非影响胆囊癌患者预后的独立危险因素,这可能与其研究纳入部分姑息治疗的患者有关。TNM 分期大、肝侵犯均意味着患者病情更为严重[25-26],针对此类患者应在术中仔细清扫淋巴组织,明确肝切除范围,术中合理使用止血工具进行充分止血,避免不必要的输血,术后则可考虑通过补充铁剂、叶酸等方式纠正患者术后贫血,且输血时尽可能避免异体输血。
综上所述,胆囊癌切除术后围手术期输血是影响患者术后肿瘤复发和生存情况的独立危险因素,应谨慎对待患者围手术期输血,尽可能避免不必要的输血。但本研究样本量较少、随访时间较短,且未能细分不同输血量对患者生存和无瘤生存的情况影响是否存在差异,仍有待在后续研究中加以改进。

