基于Wnt/β-连环素通路探讨补骨脂素对骨质疏松症大鼠的影响
王 健 张 驰
(辽宁中医药大学附属医院骨伤科,沈阳,110032)
骨质疏松症(Osteoporosis,OS)是一种全身骨代谢障碍性疾病,以骨量减少、骨微细结构破坏、骨脆性增加等为主要的病理改变[1],容易引发骨折而致残、致死,给患者造成很大痛苦。OS主要分为绝经后、继发性以及特发性3种,其中以绝经后OS最为常见。该病好发于50岁以上人群,据统计,全球骨质疏松患者约2亿,美国绝经后女性中30%左右患OS[2],我国作为老年人口最多的国家,OS患病率不断上升,50岁以上女性患病率已经高达20.7%,而这些患者中50%有可能出现骨折[3]。雌孕激素、选择性雌激素受体调节剂、双磷酸盐等骨吸收抑制剂,以及氟制剂、甲状旁腺激素等骨形成促进剂,以及骨化三醇、钙剂等骨矿化药物是临床上治疗OS的主要药物[4],但长期使用不良反应明显。因此,国内医学界将新药研究的重点放在了安全性相对较高的中药制剂。补骨脂是治疗OS的常用补益中药,具有较好的抗骨质疏松作用[5],但究竟该药何种成分如何发挥作用目前尚未明确。本研究从对Wnt/β-连环素(β-Catenin)信号通路的影响出发,探讨补骨脂主要活性成分补骨脂素对去势大鼠OS的作用。
1 材料与方法
1.1 材料
1.1.1 动物 选取12周龄无特定病原体(Specific Pathogen Free,SPF)级健康雌性SD大鼠78只,体质量240~280 g,平均体质量(262.64±10.93)g,购自中国医学科学院医学生物学研究所,动物许可证号:SCXK(滇)K2014-0002。该研究经辽宁中医药大学动物实验伦理委员会批准(伦理审批号:20170311)。将大鼠分笼饲养,每笼4只,饲养室内安静,温度设定为19~23 ℃,相对湿度设定为45%~55%,定时通风换气,昼夜节律为12 h/12 h,饲以普通标准饲料和无菌过滤水,大鼠在笼内自由活动,每周更换垫料2~3次并严格消毒。
1.1.2 药物 补骨脂素(安徽永纯生物技术有限公司,货号:YC-0139),CAS号:66-97-7,纯度:用高效液相色谱检测含量≥98%,规格:10 mg/支,使用时用二甲基亚砜(Dimethyl Sulfoxide,DMSO)溶解,双蒸水稀释配制成浓度为0.4 mg/mL、0.8 mg/mL、1.6 mg/mL的补骨脂素溶液,现用现配;阿仑膦酸钠片杭州默沙东制药有限公司,批号:20170321),规格:10 mg/片,使用时研碎成末,用DMSO溶解,双蒸水稀释配制成浓度为0.2 mg/mL的阿仑膦酸钠溶液,现用现配;注射用青霉素钠(桂林南药股份有限公司,批号:20170402),规格:每支80万单位。
1.1.3 试剂与仪器 DMSO(北京凯瑞基生物科技有限公司,批号:201700526);戊巴比妥钠(湖北鸿运隆生物科技有限公司,批号:20170418);大鼠护骨因子(Osteoprotegerin,OPG)、骨钙蛋白(Osteocalcin,BGP)酶联免疫吸附试验试剂盒(无锡市东林科技发展有限责任公司,批号:20170602/20170722);OPG、BGP免疫组化试剂盒(上海雅吉生物科技有限公司,批号:20170704/20170629);二氨基联苯胺(Diaminobenzidine,DAB)显色试剂盒(北京索莱宝科技有限公司,批号:20170421);总RNA抽提试剂盒(Trizol法)(上海康朗生物科技有限公司,批号:20170317);cDNA第一链合成试剂盒(深圳子科生物科技有限公司,批号:20170519);低密度脂蛋白受体相关蛋白6(Low Density Lipoprotein Receptor-Related Protein 6,Lrp6)、糖原合酶激酶-3β(Glycogen Synthase Kinase-3,GSK-3β)、β-连环素(β-catenin)、Runt相关转录因子2(Runx2)、甘油醛-3-磷酸脱氢酶(Glyceraldehyde-3-phosphate Dehydrogenase,GAPDH)上游引物、下游引物合成(无锡英纽瑞生物医药科技有限公司,批号:20170427、20170409、20170418、20170329、20170506)。小动物双能X射线骨密度仪(MEDIKORS公司,韩国,型号:InAlyzer型),Micro-CT小动物活体影像系统(PerkinElmer公司,美国,型号:Quantum GX型),离心机(Thermo Scientific公司,美国,型号:Sorvall ST 40R型),全自动酶联免疫吸附分析仪(Tecan公司,瑞士,型号:Freedom EVO 75型),核酸蛋白测定仪(Eppendorf公司,德国,型号:BioPhotometer D30型),实时荧光定量PCR仪(Bio-Rad公司,美国,型号:iQ5型)。
1.2 方法
1.2.1 分组与模型制备 经1周适应性饲养后,将所有大鼠编号,之后按随机数字表法分为对照组13只及造模组65只。所有大鼠均禁食12 h,不禁水,称重后给予0.2%戊巴比妥钠溶液10 mL/g,腹腔注射以麻醉大鼠,麻醉满意后将大鼠仰卧位固定于手术台上,下腹部常规备皮、消毒、铺巾,于腹白线处作长度为2 cm的纵切口,逐层打开腹腔,造模组暴露两侧卵巢组织并切除,将卵巢周围的血管以及输卵管结扎;对照组大鼠仅暴露卵巢而不行切除术;依次缝合伤口,消毒。所有大鼠给予青霉素,每天10万单位,腹腔注射,连续7 d以预防感染。手术12周后,采用InAlyzer型小动物双能X射线骨密度仪测定大鼠4、5腰椎及左、右股骨骨密度(Bone Mineral Density,BMD),造模组BMD值低于对照组,差异有统计学意义,即为骨质疏松模型建立成功[6]。实验过程中意外死亡或造模失败的大鼠及时予以补充。然后将造模成功大鼠随机分为模型组、阿仑膦酸钠组及补骨脂素低、中、高浓度组,每组13只。
1.2.2 给药方法 模型组及对照组分别给予双蒸水5 mL/kg灌胃;阿仑膦酸钠组给予0.2 mg/mL阿仑膦酸钠溶液5 mL/kg灌胃,1次/周;补骨脂素低、中、高浓度组分别给予0.4 mg/mL、0.8 mg/mL、1.6 mg/mL的补骨脂素溶液5 mL/kg灌胃。各组大鼠均给药12周。
1.2.3 检测指标与方法
1.2.3.1 大鼠BMD检测 末次给药第2天,称重后0.2%戊巴比妥钠溶液15 mL/g,腹腔注射以麻醉大鼠,采用In Alyzer型小动物双能X射线骨密度仪检测大鼠第4腰椎及左、右股骨BMD。
1.2.3.2 Micro-CT测定大鼠骨形态学指标 BMD检测完成后,采用Quantum GX型Micro-CT小动物活体影像系统扫描大鼠右侧股骨,扫描参数为:电压60 kV,功率40 W,4帧,每转0.72°;用配套软件进行整体和局部重建,截取二维、三维及局部骨小梁图片,同时分析测定骨小梁分离度(Tb.Sp)、骨小梁厚度(Tb.Th)及骨小梁数量(Tb.N)。
1.2.3.3 酶联免疫吸附试验法检测血清OPG、BGP水平 Micro-CT检测完成后,打开腹腔,自腹主动脉取血4 mL,置于含有肝素的抗凝管内,1 200×g离心10 min,分离血清,保存于-80 ℃冰箱内备检;取冻存的血清,迅速解冻并恢复至室温,按照酶联免疫吸附试验法检测试剂盒说明书进行操作,采用Freedom EVO 75全自动酶联免疫吸附分析仪,通过酶联免疫吸附试验法检测血清OPG、BGP水平[7]。
1.2.3.4 免疫组织化学法检测大鼠骨组织OPG、BGP水平 处死大鼠,取双侧股骨组织,其中左股骨组织用10%中性甲醛进行固定,然后采用脱钙剂进行脱钙[8],常规脱水、透明、石蜡包埋,制成厚度为5 μm的石蜡切片→常规采用二甲苯脱蜡→梯度浓度乙醇逐级水化→3%过氧化氢处理20 min,使内源性过氧化氢酶消除→磷酸盐缓冲液(Phosphate-Buffered Saline,PBS)。洗片3次,5 min/次→胰蛋白酶处理切片30 min→PBS洗片3次,5 min/次→根据免疫组织化学试剂盒,采用1∶1 000稀释的兔抗OPG、BGP一抗处理切片,室温2 h→PBS洗片3次,5 min/次→1∶2 000稀释的二抗处理切片,室温30 min→PBS洗片3次,5 min/次→试剂盒内的卵白素-生物素-酶复合物染色(ABC)试剂处理切片1 h→PBS洗片3次,5 min/次→用DAB显色试剂盒使切片显色→常规脱水、透明、中性树脂封固。在光学显微镜下对染色结果进行观察,OPG、BGP表达阳性的细胞被染成棕黄色,每张切片随机选取5个高倍视野(×400)采集图像,用Image J软件分析OPG、BGP蛋白表达的平均光密度值(IOD)[7]。
1.2.3.5 实时定量PCR法检测大鼠骨组织Lrp6、GSK-3β、β-catenin、Runx2 mRNA表达水平 右股骨组织用生理盐水浸湿,保存于-80 ℃冰箱内→将冻存的股骨组织剪碎后液氮研磨成粉→加入TRIzol溶液,充分匀浆10 min→按照RNA抽提试剂盒的说明操作提取总RNA→用焦碳酸二乙酯水溶解RNA→采用BioPhotometer D30型核酸蛋白测定仪检测总RNA浓度和纯度→按照cDNA第一链合成试剂盒说明操作,把RNA逆转录成为cDNA→于冰上配制PCR液(含SYBR荧光染料10 μL+Lrp6 mRNA、GSK-3βmRNA、β-catenin mRNA、Runx2 mRNA以及内参GAPDH上、下游引物各0.4 μL+cDNA模板2 μL+灭菌蒸馏水2 μL)→采用iQ5型实时荧光定量PCR仪进行引物扩增,反应条件为:95 ℃预变性5 min,40个循环(95 ℃,15 s→60 ℃,15 s→72 ℃,32 s)→获得Lrp6 mRNA、GSK-3βmRNA、β-catenin mRNA、Runx2 mRNA以及内参GAPDH生成溶解曲线,计算Lrp6 mRNA、GSK-3βmRNA、β-catenin mRNA、Runx2 mRNA的相对表达量[9]。
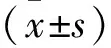
2 结果
2.1 各组大鼠第4腰椎及左、右股骨BMD比较 与对照组比较,模型组大鼠第4腰椎及左、右股骨BMD显著降低,差异有统计学意义(P<0.05)。与模型组比较,补骨脂素低、中、高浓度组及阿仑膦酸钠组大鼠第4腰椎及左、右股骨BMD均较高,且补骨脂素低浓度组<补骨脂素中浓度组<补骨脂素高浓度组和阿仑膦酸钠组,差异有统计学意义(P<0.05)。见表1。
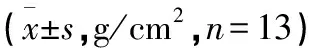
表1 各组大鼠第4腰椎及左、右股骨BMD比较
2.2 各组大鼠Tb.Sp、Tb.Th及Tb.N比较 与对照组比较,模型组大鼠Tb.Sp显著升高,Tb.Th、Tb.N明显降低,差异有统计学意义(P<0.05)。与模型组比较,补骨脂素低、中、高浓度组及阿仑膦酸钠组大鼠Tb.Th、Tb.N均较高,且补骨脂素低浓度组<补骨脂素中浓度组<补骨脂素高浓度组和阿仑膦酸钠组,差异有统计学意义(P<0.05)。与模型组比较,补骨脂素低、中、高浓度组及阿仑膦酸钠组大鼠Tb.Sp均较低,且补骨脂素低浓度组>补骨脂素中浓度组>补骨脂素高浓度组和阿仑膦酸钠组,差异有统计学意义(P<0.05)。见表2,图1。

表2 各组大鼠Tb.Sp、Tb.Th及Tb.N比较

图1 各组大鼠骨组织形态学Micro-CT观察结果
2.3 各组大鼠血清OPG、BGP水平比较 与对照组比较,模型组大鼠血清BGP水平显著升高,OPG水平明显降低,差异有统计学意义(P<0.05)。与模型组比较,补骨脂素低、中、高浓度组及阿仑膦酸钠组大鼠血清OPG水平均较高,且补骨脂素低浓度组<补骨脂素中浓度组<补骨脂素高浓度组和阿仑膦酸钠组,差异有统计学意义(P<0.05)。与模型组比较,补骨脂素低、中、高浓度组及阿仑膦酸钠组大鼠血清BGP水平均较低,且补骨脂素低浓度组>补骨脂素中浓度组>补骨脂素高浓度组和阿仑膦酸钠组,差异有统计学意义(P<0.05)。见表3。

表3 各组大鼠血清OPG、BGP水平比较
2.4 各组大鼠骨组织OPG、BGP表达水平比较 与对照组比较,模型组大鼠骨组织BGP表达水平显著升高,OPG表达水平明显降低,差异有统计学意义(P<0.05)。与模型组比较,补骨脂素低、中、高浓度组及阿仑膦酸钠组大鼠股骨组织OPG表达水平均较高,且补骨脂素低浓度组<补骨脂素中浓度组<补骨脂素高浓度组和阿仑膦酸钠组,差异有统计学意义(P<0.05)。与模型组比较,补骨脂素低、中、高浓度组及阿仑膦酸钠组大鼠股、骨组织BGP表达水平均较低,且补骨脂素低浓度组>补骨脂素中浓度组>补骨脂素高浓度组和阿仑膦酸钠组,差异有统计学意义(P<0.05)。见表4,图2、3。
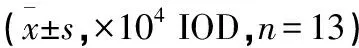
表4 各组大鼠股、骨组织OPG、BGP表达水平比较

图2 各组大鼠骨组织OPG表达结果(免疫组织化学染色,×400)
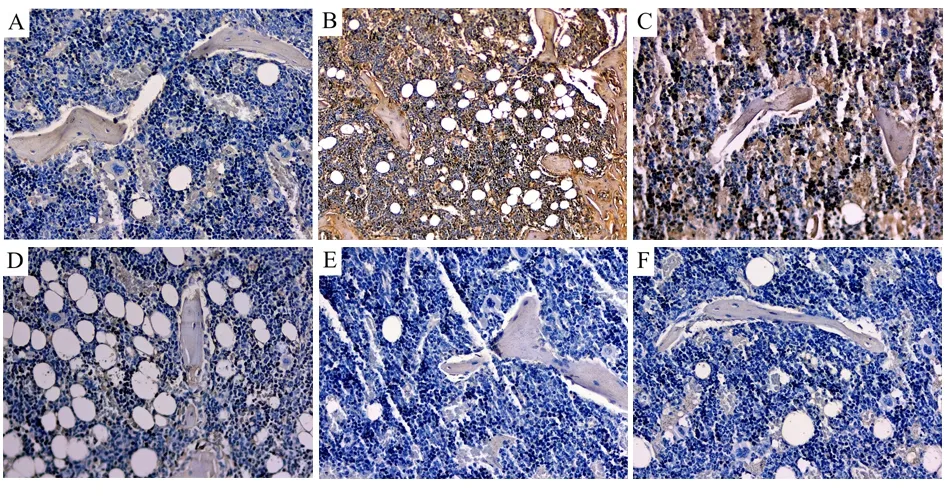
图3 各组大鼠骨组织OPG表达结果(免疫组织化学染色,×400)
2.5 各组大鼠骨组织Lrp6、GSK-3β、β-catenin、Runx2 mRNA表达水平比较 与对照组比较,模型组大鼠骨组织GSK-3β mRNA表达水平显著升高,骨组织Lrp6、β-catenin、Runx2 mRNA水平明显降低,差异有统计学意义(P<0.05)。与模型组比较,补骨脂素低、中、高浓度组及阿仑膦酸钠组大鼠骨组织Lrp6、β-catenin、Runx2 mRNA表达水平均较高,且补骨脂素低浓度组<补骨脂素中浓度组<补骨脂素高浓度组和阿仑膦酸钠组,差异有统计学意义(P<0.05)。与模型组比较,补骨脂素低、中、高浓度组及阿仑膦酸钠组大鼠骨组织GSK-3β mRNA表达水平较低,且补骨脂素低浓度组>补骨脂素中浓度组>补骨脂素高浓度组和阿仑膦酸钠组,差异有统计学意义(P<0.05)。见表5,图4。
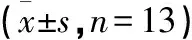
表5 各组大鼠骨组织Lrp6、GSK-3β、β-catenin、Runx2 mRNA表达水平比较

图4 各组大鼠骨组织Lrp6、GSK-3β、β-catenin、Runx2 mRNA表达结果
3 讨论
中医认为,OS属于“骨痿”“腰痛”“骨痹”“骨枯”等范畴[10],属于本虚标实之证,本虚为肝肾气血亏虚,标实为痰饮、瘀血、气滞,肾主骨生髓,肾精亏虚则骨髓生长乏源,骨骼失于濡养,致骨枯骨痿,肾虚日久出现瘀血、气滞等,可影响骨的气血运行,进一步加重病情,骨治疗上应以补肾为主,兼以活血行气。补骨脂属于补益药,味辛苦,性大温,归肾、脾经,有补肾壮阳、温脾止泻等功效,临床应用广泛。刘振海等[11]研究发现,补骨脂常作为中药复方中的一味药用于肝肾不足型OS的治疗。现代药理研究显示,补骨脂内含有香豆素类、单萜酚类、黄酮类等多种活性成分,具有升高白细胞延缓老年痴呆进程、改善细胞免疫功能、抗骨质疏松、抗肿瘤、调节肾上腺皮质功能、抗菌抗病毒等多种药理作用[12]。补骨脂素为补骨脂中的呋喃香豆素类化合物,被认为是补骨脂内抗骨质疏松的主要有效成分,杨琳等[13]研究发现,补骨脂素能通过上调骨组织转化生长因子-β的表达水平,来促进骨形成过程,发挥对去势骨质疏松雌鼠的治疗作用。邢贞武[14]的体外研究则发现,补骨脂素能够激活骨髓间充质干细胞的Notch信号通路,促进成骨细胞分化,从而影响绝经后骨质疏松发展。由此可见,补骨脂素可以通过多种途径发挥抗骨质疏松作用,但具体机制尚未完全明确,需要更全面地进行研究。
本研究采用不同浓度的补骨脂素对去势OS大鼠模型进行治疗,结果发现,补骨脂素低、中、高浓度组及阿仑膦酸钠组大鼠第4腰椎及左、右股骨BMD及骨组织Tb.Th、Tb.N均较高,Tb.Sp均低于模型组,且药物浓度越高,变化幅度越大,BMD是评价OS治疗效果的主要指标,Tb.Th、Tb.N、Tb.Sp等骨形态学指标则可反映骨微细结构的变化,该结果表明补骨脂素能够有效增加OS大鼠BMD,同时改善骨组织的微细结构和骨强度,且补骨脂素浓度越高作用效果越好。血清骨代谢相关指标研究结果显示,补骨脂素低、中、高浓度组及阿仑膦酸钠组大鼠血清及骨组织OPG水平高于模型组,BGP水平低于模型组,且补骨脂素高浓度组和阿仑膦酸钠组改变最为明显,骨质疏松的发生是骨形成与骨吸收失衡的结果,BGP由成骨细胞合成分泌,为骨转换标志,能够反映骨更新率,绝经后OS属于高转换型,故该病发生后BGP处于较高水平;OPG是由成骨细胞分泌的糖蛋白,抑制破骨细胞分化、成熟并诱导其凋亡,从而抑制骨吸收,加速骨形成,发挥骨保护作用[15]。该结果表明高浓度的补骨脂素能够有效调节骨形成和骨吸收过程,保护骨组织。
Wnt/β-catenin信号通路是骨髓间充质干细胞向成骨细胞分化的重要途径,能影响成骨细胞活性和功能,参与骨形成和骨代谢过程[16-17],在骨质疏松的发生发展过程中也起到重要作用。Lrp6、GSK-3β和β-catenin是Wnt/β-catenin信号通路的主要分子,一般认为,Wnt/β-catenin信号通路被激活后,细胞膜上的Wnt能够与Lrp6特异性结合,形成的复合体可以促使GSK-3β磷酸化并丧失活性,无法促进β-catenin磷酸化,从而引起细胞内β-catenin积聚,然后进入细胞核内,控制相关基因转录,激活Wnt下游靶基因Runx2,Runx2为骨形成和发育的必要基因[18-21],能调节成骨细胞分化并促进其成熟。若Wnt/β-catenin信号通路被抑制,则成骨细胞分化受到影响,可导致骨质疏松发生。本研究发现补骨脂素低、中、高浓度组及阿仑膦酸钠组大鼠骨组织Lrp6、β-catenin、Runx2 mRNA表达水平高于模型组,GSK-3β mRNA表达水平低于模型组,且补骨脂素高浓度组和阿仑膦酸钠组变化最明显,表明补骨脂素能通过激活Wnt/β-catenin信号通路来促进成骨细胞分化,这可能是补骨脂素发挥抗骨质疏松的作用机制之一。
综上所述,补骨脂素能剂量依赖性地提高OS大鼠的BMD,提高血清及骨组织BGP水平,降低BGP水平,增加骨组织骨小梁厚度和数量,降低骨小梁分离度,其作用可能与激活Wnt/β-catenin信号通路有关。

