基于网络药理学对紫苏-百合药对治疗原发性失眠的作用机制研究
王振亦 常 泽 胡文悦 林景峰 王育纯 马华萍 刘甘露 韩振蕴
(1 北京中医药大学东方医院,北京,100078;2 北京中医药大学深圳医院(龙岗),深圳,518172)
失眠是指尽管有合适的睡眠机会和睡眠环境,却依然对睡眠时间和(或)质量感到不满足,并且影响日间社会功能的一种主观体验,是最常见的睡眠问题之一[1]。失眠分为原发性失眠和继发性失眠,其中原发性失眠是指不是因其他疾病、精神障碍和药物/物质滥用所引起的失眠[2]。
中医古籍中多称失眠为“不寐”“目不瞑”“不得眠”等,现代中医学与现代医学称谓相同[3]。紫苏-百合是中医治疗失眠的对药,国医大师王琦治疗失眠的常用方“高枕无忧汤”就有此药对[4]。两药相合为用最早见于《侣山堂类辨》,其载“余植百合,其花朝开暮合,紫苏之叶,朝挺暮垂,俱能引阳气而归阴分”[5],但书中并不用本方治疗失眠。后陈修园在其著作《医学实在易》中,以上述理论为基础,用百合、紫苏、龙骨、牡蛎、茯神、枣仁等治疗“阳不归阴”的失眠[6]。后近代名医范文甫以此二药治疗黄振声“苦不寐,百药不能治”,最后“三贴而安”[7]。
中药网络药理学研究旨在从系统层次和分子水平揭示中药方剂的奥秘,促进中药研究从当前的“单一靶标,单一药物”模式转向“网络靶标,多成分药物”的新模式[8]。李梢教授在1999年提出了中医药与分子网络之间的可能关系[9],这一猜想的提出成为了中药网络药理学的开端。在此之后,李梢教授搭建了中药网络药理学的研究框架,并进行了对寒/热中药配伍和寒/热证候的研究[10-11]。在2013年,李梢教授首次运用其建立的网络药理学研究平台,进行了清络饮(苦参、青风藤、黄柏、萆薢)与类风湿性关节炎的研究,这一研究不仅预测了清络饮的活性成分和协同成分,而且还解释了该配方的组合规则。并且得到了文献证据的证实,证明了网络药理学研究的可行性[12]。《世界中医药》杂志于2021年发布了《网络药理学评价方法指南》,为网络药理学研究的规范发展提供了基础[13]。
本研究基于网络药理学策略,通过目前已有的在线数据库,挖掘并整理紫苏-百合药对的入血成分及相关作用靶点,并与疾病数据库中的原发性失眠靶点相匹配,筛选共有靶点。然后通过基因本体(Gene Ontology,GO)富集分析和京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)信号通路富集分析,筛选得到紫苏-百合药对治疗原发性失眠的相关通路,旨在揭示其分子作用机制并为其进一步研究与临床应用提供参考。
1 资料与方法
1.1 数据资料 中药系统药理学数据库与分析平台(Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform,TCMSP,https://www.tcmspw.com/tcmsp.php),中药综合数据库(Traditional Chinese Medicine Integrated Database,TCMID,http://119.3.41.228:8000/tcmid),Uniprot蛋白质序列数据库(https://www.uniprot.org/),GeneCards数据库(https://www.genecards.org/),在线人类孟德尔遗传数据库(Online Mendelian Inheritance in Man,OMIM,https://omim.org/),STRING数据库(https://string-db.org/),Cytoscape 3.7.2软件,R4.0.2软件,Perl语言。
1.2 研究方法
1.2.1 紫苏-百合药对的活性成分的筛选及作用靶点的预测 使用TCMSP分别检索紫苏、百合,以得到紫苏-百合药对的化学成分及作用靶点。以口服生物利用度(Oral Bioavailability,OB)≥30%和类药性(Drug Likeness,DL)≥0.18作为活性化合物的筛选条件。通过TCSMP平台查询所得活性成分的靶点信息,运用Perl语言及uniprot数据库得到紫苏-百合药对作用的基因靶点。
1.2.2 收集原发性失眠的靶点并预测共同作用靶点 本研究以GeneCards、OMIM数据库为平台。以“Primary Insomnia(原发性失眠)”为检索词条,对原发性失眠相关基因进行检索和收集,并去除重复项,共得到2 405个相关疾病靶点。然后使用R语言将原发性失眠相关基因靶点与之前所得的紫苏-百合药对作用相关靶点进行比较,筛选出共同靶点,绘制韦恩图。
1.2.3 网络模型的构建及分析 使用Cytoscape 3.7.2软件绘制紫苏-百合药对与原发性失眠的“成分-靶点-基因-疾病”相互作用网络图。然后将共同作用靶点输入到STRING数据库中进行检索,将蛋白种属设置为“Homo Sapiens”,获得蛋白质-蛋白质相互作用(Protein-protein Interaction,PPI)网络图,并用Cytoscape 3.7.2软件进行可视化。
1.2.4 通路富集分析 利用David网站中的Functional Annotation Tool功能,对药物-疾病共同作用基因靶点进行GO功能与KEGG信号通路富集分析,并将结果以条形图和气泡图的形式输出。
2 结果
2.1 紫苏-百合药对的活性成分的筛选及作用靶点的预测 通过在TCMSP、TCMIP数据库中检索紫苏的全部化学成分共116个、百合的全部化学成分共21个。紫苏的主要有效成分为紫苏醛[(S)-p-Mentha-1,8-dien-7-al],虽然未满足筛选条件,仍纳入到有效成分中,共得到紫苏有效活性成分16个;得到百合的有效化学成分共7个,其中Beta-sitosterol(已在表1中标黄)为二者共有,故总共得到紫苏-百合药对22个有效化学成分,化合物详细信息见表1。在TCSMP数据库查询上述22个有效化合物的作用靶点,除去Supraene无相应靶点,并删除重复靶点,共得到120个药物作用靶点。用Uniprot数据库和perl语言对120个药物作用靶点寻找靶基因,共得到97个药物作用靶基因。

表1 紫苏-百合药对活性成分基本信息
2.2 筛选紫苏-百合药对活性成分与原发性失眠共同作用靶点 在GeneCards、OMIM数据库中,以“Primary Insomnia”为检索词条,对原发性失眠相关基因进行检索和收集,并去除重复项,共得到2 402个相关疾病靶点。然后将这2 402个靶点与97个紫苏-百合药对活性成分靶点运用R语言绘制韦恩图,图中绿色圆形代表原发性失眠相关基因,橙色圆形代表紫苏-百合药对活性成分靶点,图中交集即为药物-疾病共同靶点53个即紫苏-百合药对治疗原发性失眠的重要靶点。见图1。
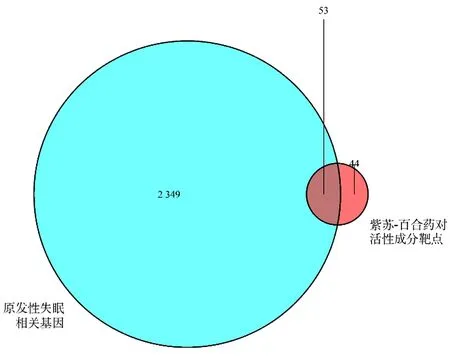
图1 紫苏-百合治疗原发性失眠共同靶点的韦恩图
2.3 药物-活性成分-靶点-疾病网络构建与分析 “药物-活性成分-靶点-疾病”网络图中粉红色正方形节点代表“原发性失眠”,绿色菱形节点分别代表“紫苏”和“百合”;紫色六边形圆形节点代表作用靶点,淡蓝色圆形节点代表药物活性成分,二者之间的连线代表相互作用关系。使用Cytoscape软件对图2进行分析后,得到度值排名前五的活性成分为木犀草素(Luteolin)、豆甾醇(Stigmasterol)、β-谷甾醇(Beta-sitosterol)、β-胡萝卜素(Beta-carotene)、3-去甲基秋水仙碱(3-Demethylcolchicine)。见图2。
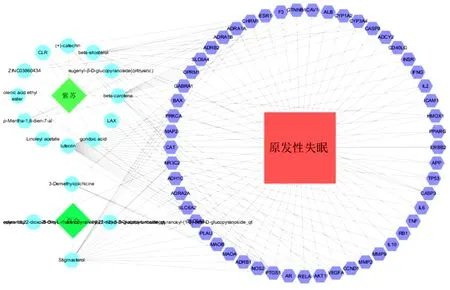
图2 紫苏-百合药对“药物-活性成分-靶点-疾病”网络图
2.4 PPI网络构建 在STRING数据平台输入所得药物—疾病共同靶点,分析得到PPI网络图,共包含53个节点,477条边,平均度值为18,用Cytoscape 3.7.2软件,按度值从大到小,由内向外排列可视化后可得到图3。其中度值越大图中圆形面积越大、颜色越深,度值越小,圆形面积越小、颜色越浅,每条边代表PPI关系,线条越多代表关联度越大,PPI图中的靶点排序如图4。

图3 PPI网络

图4 PPI图中靶点排序
2.5 关键靶点GO生物功能注释 将上述53个药物—疾病共同靶点经过David网站GO富集分析选取生物学过程(Biological Process)、细胞组分(Cellular Component)及分子功能够(Molecular Function)3部分。结果显示,交集基因集合共富集至284条生物学过程通路中;富集至35条细胞组分通路中;富集至58条分子功能通路中,按照富集基因数由多到少排序,按基因富集数目由多到少排序,前10个GO功能富集柱状图和气泡图见图5,柱状图中纵坐标表示基因富集数量,气泡图中纵坐标表示通路名称。由柱状图可以看出,生物学过程通路主要涉及RNA聚合酶Ⅱ启动子转录的正调控(Positive Regulation of Transcription from RNA Polymerase Ⅱ Promoter)、药物应答(Response to Drug)、凋亡过程的负调控(Negative Regulation of Apoptotic Process)等通路;细胞组分通路主要涉及细胞质膜(Plasma Membrane)、膜的组成部分(Integral Component of Membrane)、细胞质(Cytoplasm)等通路;分子功能通路主要涉及蛋白结合(Protein Binding)、相同蛋白结合(Identical Protein Binding)、酶结合(Enzyme Binding)等通路。表明紫苏-百合药对可能通过多个GO生物功能发挥治疗作用。
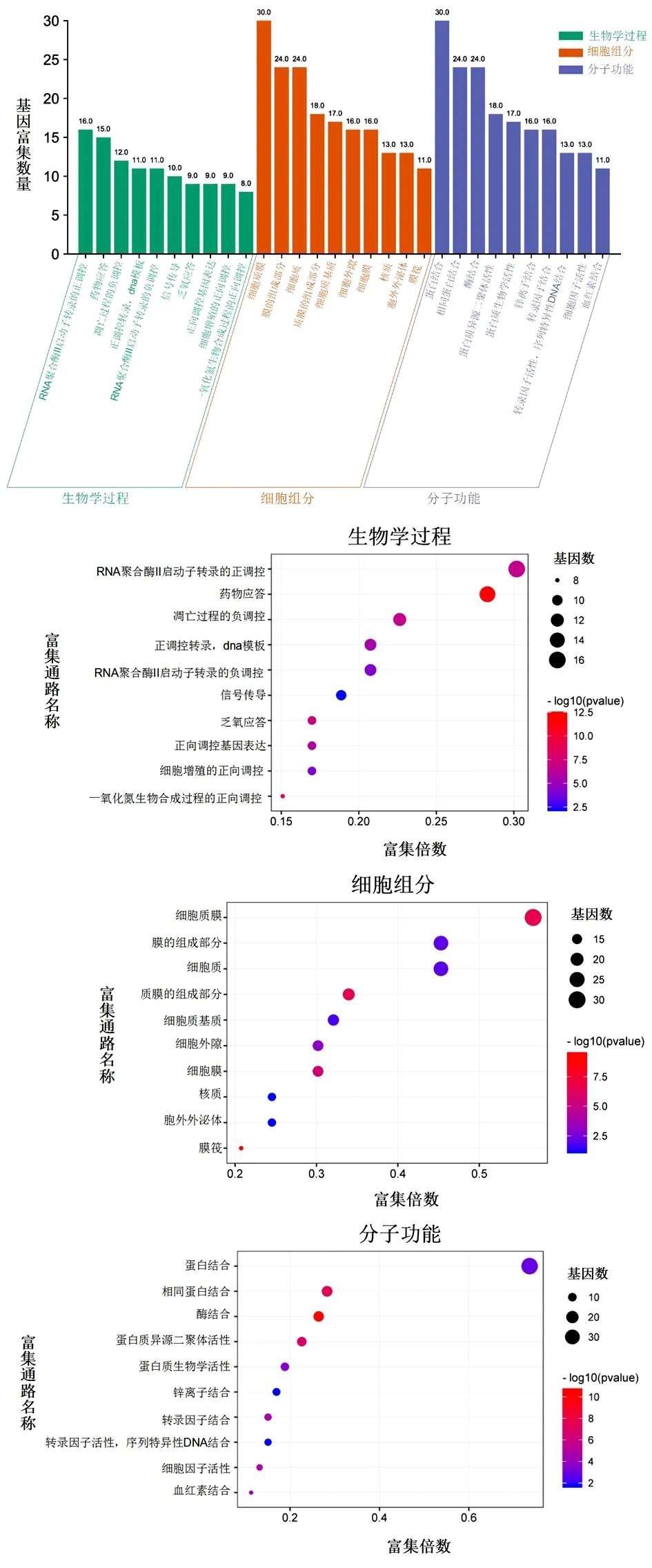
图5 GO富集分析中BP、CC、MF通路的柱状图和气泡图
2.6 KEGG信号通路富集分析 将53个药物-疾病共同靶点经David网站运行,共得到102条KEGG信号通路,按照富集基因数由多到少排序,前25个GO功能富集柱状图见具体信号通路图见图6。P代表富集的显著性,颜色越红则显著性越高。主要涉及HIF-1信号通路(HIF-1 Signaling Pathway)肿瘤坏死因子信号通路(TNF Signaling Pathway),5-羟色胺突触(Serotonergic Synapse),PI3K-AKT信号通路(PI3K-AKT Signaling Pathway)等。
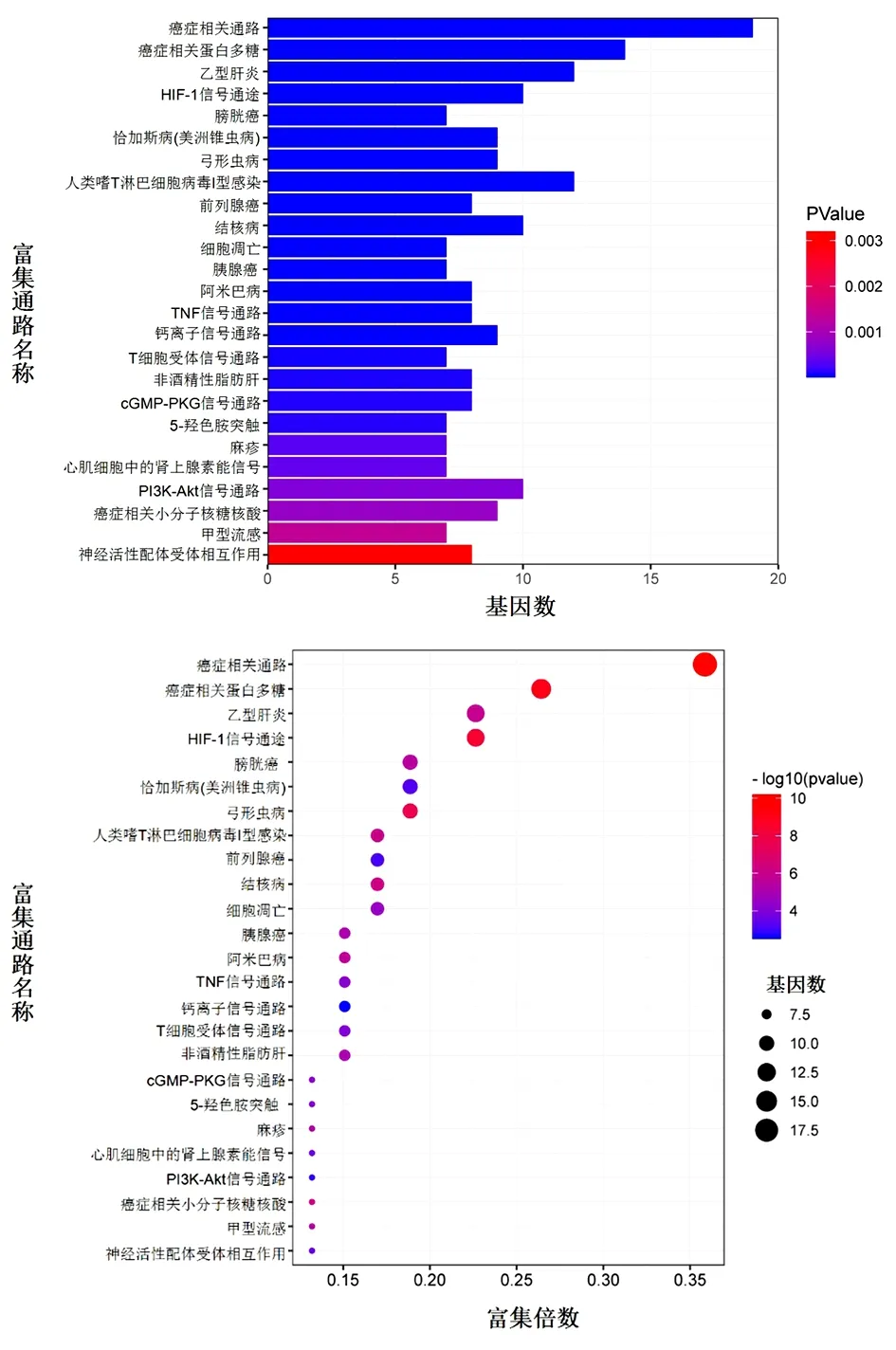
图6 KEGG信号通路富集分析
3 讨论
失眠对个人和社会均有很大的危害,失眠不仅会导致患者罹患内科疾病的发生率显著高于非失眠人群,也会导致精神障碍的发病率增高。失眠除了会导致精神和身体的疾病,对公共卫生也会造成影响,如社会经济损害、医疗设施使用增加、工作表现下降,甚至死亡率增加[14]。
由“药物-活性成分-靶点-疾病”网络图可知,紫苏-百合药对主要的活性成分是木犀草素。木犀草素是一种常见的膳食类黄酮,广泛存在于中草药中。Kim等[15]在一项小鼠实验中发现,口服木犀草素可以降低睡眠潜伏期,增加总睡眠时间,并通过脑电图和肌电图发现了木犀草素增加了非快速眼动睡眠时间,减少了清醒时间。而且现已有研究证实木犀草素可以抑制多种炎症介质[16],而失眠与炎症介质的产生有着一定的相关性[17],推测木犀草素是通过抑制炎症介质的产生来调控睡眠。在对豆甾醇的研究中发现,小鼠在经过20 d的豆甾醇给药后,会导致肝脏脂质中氧化氢酶、超氧化物歧化酶、谷胱甘肽活性增高[18]。而已有研究发现非器质性失眠的患者血清中氧化氢酶、超氧化物歧化酶、谷胱甘肽含量均降低[19],我们可以推测豆甾醇可能会通过提高氧化氢酶、超氧化物歧化酶、谷胱甘肽活性来治疗失眠。
由PPI网络图可知,紫苏-百合治疗原发性失眠的关键基因靶点是蛋白激酶B1、白蛋白、白细胞介素6、血管内皮生长因子A、肿瘤坏死因子等。蛋白激酶B是PI3K/AKT信号通路的一部分,此通路也是本研究发现的紫苏-百合治疗原发性失眠的可能通路之一。目前已有研究表明,该信号通路与失眠存在相关性[20-21]。在动物实验中发现,慢性睡眠剥夺可以导致小鼠海马组织中磷酸化蛋白激酶B表达下降,从而抑制下游部分蛋白的表达,进而影响周围炎性环境,促进炎症介质肿瘤坏死因子-α的释放[22]。通过比较原发性失眠患者与健康患者血清中肿瘤坏死因子-α的表达水平发现,原发性失眠患者血清中肿瘤坏死因子-α的含量明显高于健康对照组,证明了肿瘤坏死因子-α的表达水平与原发性失眠有密切的相关性[23]。Irwin等[24]在一项研究成人睡眠障碍、睡眠持续时间和炎症的Meta分析中发现,白细胞介素-6与睡眠障碍有相关性,同时Nowakowski等[25]在一项对295名围绝经期妇女的调查中发现较低的睡眠效率与较高的白细胞介素-6水平有关。
KEGG富集分析表示,紫苏-百合药对可能从多个通路对原发性失眠发挥治疗作用。失眠患者体内肿瘤坏死因子-α含量增高,而增多的肿瘤坏死因子-α可以通过肿瘤坏死因子信号通路激活核因子κB的释放[26],而王志伟等在临床研究中发现原发性失眠患者血清中核因子κB水平升高[27]。我们可以推测紫苏-百合药对可以减少患者体内肿瘤坏死因子-α的含量从而减少核因子κB的释放,以改善失眠。
5-羟色胺突触通路具有动态调节的体内5-羟色胺受体水平作用,当升高5-羟色胺水平后,会导致5-羟色胺2A[28]、5-羟色胺2C[29]的功能下调,Landolt等[30]通过回顾性研究发现5-羟色胺2A、5-羟色胺2C受体拮抗剂可以延长慢波睡眠和深慢波睡眠时间,有临床试验发现在对失眠患者进行有效治疗后,血清5-羟色胺水平也会明显升高[31]。
综上所述,紫苏-百合药对治疗原发性失眠具有多成分、多靶点、多通路的作用机制特点,为紫苏-百合药对治疗原发性失眠提供了实验研究的方向。

