血清嗜铬粒蛋白A在嗜铬细胞瘤和副神经节瘤中的应用价值
高洪波 邸玉青 刘建通 李隆敏 李 赟 赵春元 邵玉军
(1.北京核工业医院核素诊疗中心,北京,102413;2.北京核工业医院心内科,北京,102413;3.北京核工业医院普通外科,北京,102413)
嗜铬细胞瘤(pheochromocytoma,PCC)与副神经节瘤(paraganglioma,PGL)都属于激素分泌功能的神经内分泌肿瘤,分别起源于肾上腺髓质与肾上腺外的交感神经链。从胚胎学来说,它们均起源于外胚层的神经嵴细胞[1],二者合称嗜铬细胞瘤和副神经节瘤(pheochromocytoma and paraganglioma,PPGL)[2]。PPGL是一种引起内分泌性高血压的少见的神经内分泌肿瘤。2017年世界卫生组织(WHO)在神经内分泌肿瘤分类中用“转移性PPGL”替换了2004年定义的“恶性PPGL”,认为所有的PPGL都具有转移潜能,故建议将PPGL分类改为转移性和非转移性,而不再用恶性和良性分类[3-4]。肿瘤复发转移有可能在第一次术后的数年或数十年后才发生,需要长期随诊观察,出现复发转移及时治疗。因此,寻找一个适合的肿瘤标记物进行复发和转移性PPGL监测及病情评估至关重要[5]。血清嗜铬粒蛋白A(chromogranin A,CgA)是嗜铬蛋白家族中最常见的一种酸性可溶性蛋白,广泛存在于神经内分泌细胞中,是神经内分泌肿瘤常用的检测指标。本研究应用血清CgA作为PPGL诊断及疗效评价的标记物进行观察和分析,现报道如下。
1 资料与方法
1.1 一般资料
选取2017年6月~2021年6月在北京核工业医院核素诊疗中心住院行131I-间位碘代苄胍(131I-metaiodobenzyl guaniodine,131I-MIBG)治 疗 的80例PPGL患 者 作 为 研 究对象。其中,男37例,女43例;年龄22~70岁,平均年龄(47.56±15.57)岁;肿瘤类型:嗜铬细胞瘤42例,副神经节瘤38例,均经手术或穿刺病理证实为嗜铬细胞瘤或副神经节瘤。所有患者均完成2次以上131I-MIBG治疗,第2次治疗后6个月完成疗效评价。根据实体瘤的疗效评价(response evaluation criteria in solid tumors,RECIST)标准(1.1版)进行疗效评价[6]。根据疗效评价结果,分为治疗有效组和治疗无效组,比较两组血清CgA水平。所纳入患者均对本研究内容知晓并已自愿签署知情同意书。本研究经过北京核工业医院医学伦理委员会审核通过。
1.2 纳入与排除标准
纳入标准:①满足131I-MIBG治疗适应证,能够选择性摄取131I-MIBG的肿瘤如嗜铬细胞瘤和副神经节瘤等,周围软组织或远处转移者,不能手术切除或术后有瘤体残留的患者;②经过病理证实为PPGL,131I-MIBG核素显像阳性、无法手术的患者;③预期存活时间1年以上的患者;④红细胞≥3.5×109/L,血红蛋白≥90 g/L,白细胞≥4.0×109/L,血小板≥100×109/L的患者;⑤近期6~12个月内无生育计划的患者。
排除标准:①妊娠及哺乳妇女;②肾功能不全者;③不能依从辐射防护指导者;④其他急危重症不能耐受核素治疗者。
1.3 方法
标本采集:所有研究对象采用带有分离胶的真空采血管,抽取晨起空腹静脉血3 mL,自然凝集30 min以上,4 000 r/min,离心半径13.5 cm,离心10 min,分离血清,吸取血清独立分装,置于-70℃冰箱保存,集中检测血清CgA。
检测方法:采用双抗体夹心酶联免疫吸附试验(enzymelinked immunosorbent assay,ELISA),在已知待测物质浓度的标准品、未知浓度的样品中加入微孔酶标板内进行检测。先将待测物质和生物素标记的抗体同时温育。洗涤后,加入亲和素标记过的HRP。再经过温育和洗涤,去除未结合的酶结合物,然后加入底物A、B,和酶结合物同时作用、产生颜色。颜色的深浅和样品中待测物质的浓度呈正比。每个样品均设复孔检测。血清CgA参考区间为27~94 ng/mL。检测仪器采用Abbott酶标仪。
1.4 观察指标
(1)根据不同病理特征分组比较血清CgA水平。记录PPGL患者的临床病理特征。临床病理特征包括性别、年龄、肿瘤原发部位、肿瘤功能状态、有无远处转移等。根据患者的一般资料年龄、性别、肿瘤功能状态、有无转移等分组比较血清CgA水平。其中,肿瘤功能状态的评估方法是根据患者血中是否有阵发性高血压和/或出现头痛、心悸、多汗的三联征及体位性低血压等临床表现,以及儿茶酚胺类物质[肾上腺素(E)、去甲肾上腺素(NE)、多巴胺(DA)]分泌是否增多,有相应的临床表现及内分泌物质增多者视为肿瘤有功能。
(2)根据疗效不同比较不同治疗疗效组PPGL患者CgA水平。疗效判定依据如下:根据实体瘤的疗效评价RECIST标准(1.1版),完成2次131I-MIBG治疗后6个月的患者肿瘤状态(肿瘤原发部位和转移部位的CT或MRI、131I-MIBG治疗后的SPECT全身核素显像)评估,分为完全缓解(CR),部分缓解(PR),稳定(SD),进展(PD)[6]。CR为所有目标病灶消失;PR为所有可测量的目标病灶直径总和低于基线≥30%;SD为基线病灶长径总和有缩小但未达PR或有增加但未达PD;PD为基线病灶长径总和>20%或出现新发病灶。131I-MIBG治疗有效组为根据上述标准被判定为完全缓解(CR)、部分缓解(PR)、稳定(SD)的患者;治疗无效组为根据上述标准被判定为进展(PD)的患者。
(3)按照发病部位的不同,将按照起源于肾上腺的PCC与起源于肾上腺外的PGL进行分组,比较PCC组和PGL组患者的血清CgA水平。
1.5 统计学分析
采用SPSS 13.0统计学软件进行数据分析。计量资料中符合正态分布的数据以(±s)表示,组间比较采用t检验。不同治疗疗效组间和患者各临床特征及病理特征组间CgA水平为非正态分布数据,以中位数[M(P25~P75)]表示,采用Mann-Whitney或Kruskal-Wallis等非参数检验方法比较的差异。以P<0.05为差异有统计学意义。
2 结果
2.1 不同临床特征及病理特征的PPGL患者CgA水平比较
80例PPGL患者血清CgA水平与患者的性别、年龄、肿瘤功能状态无关,差异无统计学意义(P>0.05)。有远处转移组的患者血清CgA水平明显升高,和无远处转移组的患者相比,差异有统计学意义(P<0.05)。见表1。
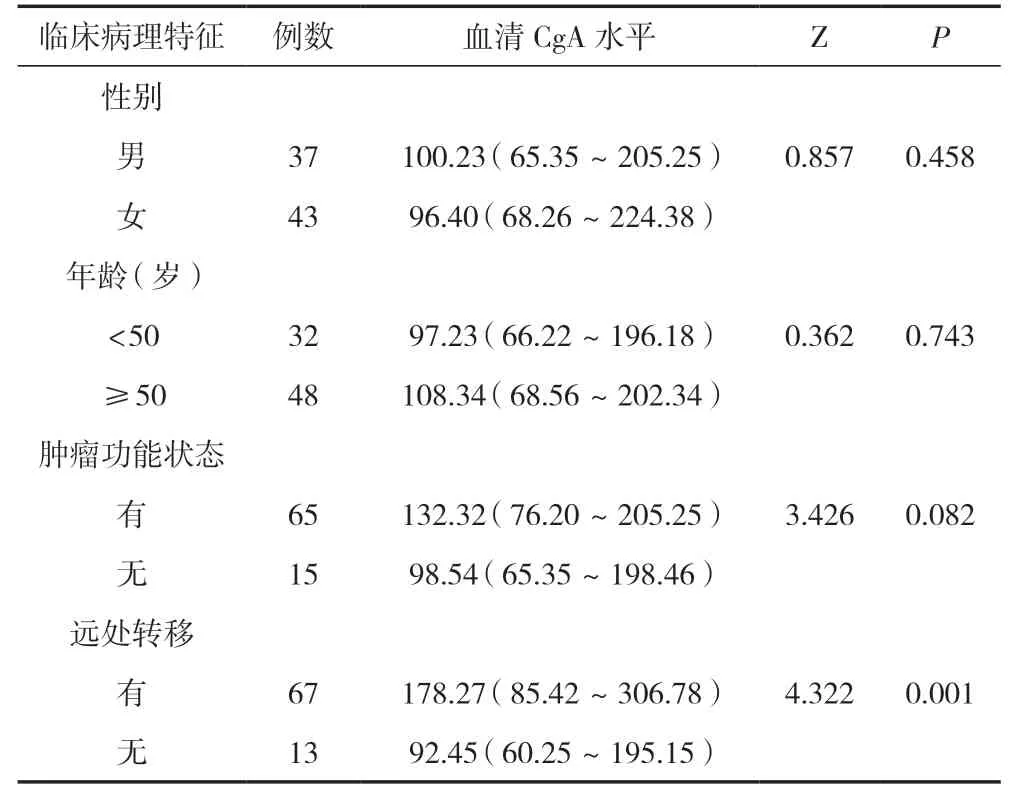
表1 不同临床特征及病理特征的PPGL患者CgA水平比较 [M(P25~P75),ng/mL]
2.2 PCC与PGL两组患者血清CgA水平的比较
42例PCC患者,38例PGL患者,两组CgA水平相当,差异无统计学意义(P>0.05)。见表2。
表2 PCC与PGL两组患者血清CgA水平的比较 (±s,ng/mL)

表2 PCC与PGL两组患者血清CgA水平的比较 (±s,ng/mL)
组别 例数 血清CgA水平PCC组 42 112.12±46.24 PGL组 38 99.45±33.58 t 5.162 P 0.084
2.3 131I-MIBG治疗后不同疗效的PPGL患者血清CgA水平的比较
80例患者均完成2次以上131I-MIBG治疗,第2次治疗后6个月完成疗效评价,完全缓解0例(0.00%),部分缓解17例(21.25%),稳定45例(56.25%),进展18例(22.50%)。分析治疗有效组的PPGL患者与治疗无效组的PPGL患者血清CgA水平,治疗有效组的PPGL患者CgA水平较低或处于阴性(CgA超过94 ng/mL即判断为阳性,CgA低于94 ng/mL即判断为阴性),治疗无效组的PPGL患者CgA水平明显升高。两组血清CgA水平比较,差异有统计学意义(P<0.05)。见表3。
表3 不同治疗疗效的PPGL患者血清CgA水平的比较(±s,ng/mL)

表3 不同治疗疗效的PPGL患者血清CgA水平的比较(±s,ng/mL)
组别 例数 血清CgA水平治疗有效组 62 98.38±26.32治疗无效组 18 188.24±43.26 t 10.246 P 0.001
3 讨论
PPGL是一种引起内分泌性高血压的少见的神经内分泌肿瘤。转移性PPGL是指在没有嗜铬组织的区域出现嗜铬细胞(转移灶),如淋巴结、肝、肺及骨等。目前,国内外学者对于PPGL的治疗主张早期手术切除及术后密切随访,出现远处转移和病情进展的患者预后较差。以往的生物学标记物尿儿茶酚胺类物质,如甲氧基去甲肾上腺素、甲氧基肾上腺素等灵敏度低,虽能够判断肿瘤是否有功能、能够帮助定性诊断,但尚不能作为肿瘤标志物判断患者的病情状态及预后评估。因此,寻找提示PPGL转移和出现进展的血清学指标,对判断患者的病情状态及随访观察至关重要[8]。手术切除一直是PPGL首选的治疗方法[2]。对于无法手术切除的并且131I-MIBG核素显像阳性的PPGL患者,可以推荐做131I-MIBG治疗。国外研究报道,68.0%的患者经过131I-MIBG治疗后肿瘤病情稳定、耐受性良好、不良反应较少[9]。国内研究报道,治疗完全有效率3%~5%,部分有效率和病情稳定率可达73%~79%,患者的5年生存率增加,达45%~68%[10]。治疗效果与靶组织的吸收剂量有关,靶组织对131I-MIBG摄取率高者,疗效相对较好[11]。
CgA属嗜铬蛋白家族,是一种酸性可溶性单体蛋白质。大量的CgA存在于肾上腺髓质嗜铬颗粒和交感神经的致密核心囊泡中,伴随去甲肾上腺素在交感神经末梢颗粒中合成、储存及释放。由于CgA在神经内分泌组织中广泛分布,所以可以作为免疫组化标记和神经内分泌肿瘤的血清标志物[12]。PPGL患者可以出现CgA水平增高,研究发现其诊断灵敏度为73.9%~100%,特异度为74.2%~96%[13-15]。研究发现,血清CgA除可用于辅助诊断和监测神经内分泌肿瘤病情外,还能作为判断预后和评估疗效的指标[16]。血清CgA在转移性和进展期PPGL中的应用价值有待于深入探讨。
本研究发现,经过131I-MIBG治疗出现了病情进展的PPGL患者血清CgA的水平表达明显升高,与131I-MIBG治疗有效的PPGL患者相比,差异有统计学意义(P<0.05)。CgA水平与患者性别、年龄、肿瘤功能状态均无关,CgA水平与PCC及PGL亦无关,差异无统计学意义(P>0.05)。本研究结果提示血清CgA可用于PPGL的转移性的诊断和疗效评价。一些研究认为,CgA或对恶性PPGL的筛查起到一定的帮助。CgA联合尿儿茶酚胺可将PPGL的诊断敏感性由90.9%提升至100%,特异性由100%降至85%[17-18]。一项纳入36例SDHB突变的恶性PPGL患者的研究显示,甲氧基去甲肾上腺素对上述患者的诊断敏感性仅为75.0%,加入CgA作为联合指标后,其诊断敏感性上升至94.4%[19]。
转移性PPGL异常的神经内分泌细胞的活性高于非转移性PPGL[7]。所有PPGL均具有恶性潜能,尤其是处于病情进展期的PPGL,其过度分泌儿茶酚胺类物质使机体处于高代谢状态,同时也加速瘤细胞本身的分裂增殖[20]。本研究中病情进展的PPGL患者血清CgA水平明显升高,可能与更大的肿瘤负荷有关,也提示CgA的升高可能与PPGL的转移及复发的病情进展有关。冯超[20]提出,高水平的血CgA浓度提示肿瘤可能为恶性,良性PPGL患者术后血清CgA浓度下降明显,而恶性患者术后未见明显下降。本研究采用的是双抗夹心ELISA检测CgA,结果准确可靠。因此,临床上如遇到嗜铬细胞瘤患者出现血清CgA水平升高,则需高度怀疑其出现远处转移可能或病情进展可能。由此可见,血清CgA可能成为反映PPGL生物学行为的一个辅助指标,阳性尤其是高水平表达需高度重视其出现远处转移和肿瘤进展的可能性。
本研究结果虽然说明血清CgA在评价转移性和进展期PPGL方面有较大的意义,但在临床工作中仍需结合患者临床资料、影像资料、生化指标及术后随访综合判断其疾病情况。
——中国居民收入分配中的逆向调节机制

