ICU 脓毒症患者发生再喂养综合征的危险因素分析及预测模型建立
王虹,杨德兴,王强,周维钰,唐杰夫,王振方,付凯,刘圣哲,刘荣
(1)玉溪市人民医院 ICU,云南 玉溪 653100;2)云南省第一人民医院急诊内科,云南 昆明 650034;3)昆明医科大学第一附属医院 ICU,云南 昆明 650032)
脓毒症可导致危及生命的器官功能障碍,是ICU 中除冠状动脉粥样硬化性心脏病外第二大死因[1],严重感染会激活机体单核细胞、巨噬细胞及其他炎症反应细胞,引起失控的炎症反应[2],应激条件下出现高分解代谢、负氮平衡而营养相对摄取不足。严重损伤后的应激反应可造成肠道黏膜屏障破坏、肠道菌群生态失调及机体免疫功能下降,从而发生肠道细菌异位,胃肠道功能受损,导致肠道喂养不耐受的机率增高,这种情况下脓毒症患者容易发生营养不良。在全身炎症反应下,营养的摄入并不能完全逆转机体营养的损失,并且在ICU 中的患者,会经历频繁的喂养中断和能量限制,医源性饥饿叠加在明显的炎症反应和内分泌介质介导的急性应激下,相互促进下进一步加重脓毒症患者营养不良的情况[3]。及时且适当的营养支持治疗[4],对营养不良的患者至关重要。营养不良的患者在重新摄入营养物质时,最常见的并发症是再喂养综合征(refeeding syndrome,RFS)。RFS 是一种潜在致命性的急性代谢反应,由Burgers 在1948 年首次定义[5]。有关RFS 的文献及2020 年美国肠外肠内营养学会(ASPEN)指南[6]中,根据血P-、血Mg2+降低来诊断RFS,而本研究尝试在血P-、血Mg2+变化的基础上使用其他常规的生物指标探讨ICU 脓毒症患者发生RFS 的危险因素并针对危险因素进行分析研究,并以此为基础建立RFS 预测模型,建立模型后,可以早期、快速及准确识别RFS,以减少其死亡率,提高临床救治率。
1 资料与方法
1.1 一般资料
收集2020 年11 月至2022 年1 月昆明医科大学第一附属医院ICU 收治的脓毒症患者。纳入标准:诊断为脓毒症患者;符合“2020 年RFS ASPEN 指南”[6]中诊断标准:为营养不良或是危重患者再次重新启动或大幅度增加能量供应后5 d 之内血P-、血Mg2-和(或)血K+下降范围达10%~30%之间,即可诊断为RFS;年龄大于18 岁。排除标准:妊娠或者年龄小于18 岁;入院后24 h 死亡的患者;因肾功能衰竭或其原因需要行血液净化的;行甲状旁腺切除的患者。本研究所有患者及家属已签署知情同意书。
1.2 研究方法
收集患者一般资料如性别、既往病史、机械通气的时间、BMI、营养评分(NRS2002 评分系统)、急性胃肠功能损伤(acute gastrointestinal injury,AGI)、急性生理学和慢性健康评分(acute physiology and chronic health evaluation -II,APACHE-II)、序贯器官衰竭评分(sequential organ failure assessment,SOFA),记录营养支持方式:完全肠外营养(total parenteral nutrition,TPN)、完全肠内营养(toyal enteral nutrition,TEN)、肠内营养(enteral nutrition,EN)联合肠外营养(parenteral nutrition,PN),开始喂养后第3 天的实验室指标如血常规、生化检验、12 项细胞因子、感染相关蛋白、淋巴亚群的测定、维生素B1(Vitamin B1)、糖代谢相关检测、肌酐-身高指数(creatinine height index,CHI)、血气分析、是否使用利尿剂、是否使用胰岛素、住院时间、记录最终转归(好转或死亡)。并根据是否发生RFS 分为RFS 组和非RFS 组。
1.3 统计学处理
使用SPSS 25.0 进行数据统计分析。基本描述计数资料采取例及构成比表示,正态分布计量资料采用均数±标准差()表示,偏态分布计量资料采用四分位数间[M(P25,P75)]表示,假设检验计数资料间比较采用χ2检验,正态分布计量资料2 组间比较采用两独立样本t检验,偏态分布计量资料采用两样本秩和检验。单因素分析采用χ2检验、t检验或Z检验。单因素分析有意义的变量采取Logistic 回归分析。以P<0.05为差异有统计学意义。
2 结果
2.1 一般情况
RFS 组和非RFS 组性别、营养支持方式、NRS2002评分、AGI分级、APACHE-II评分、SOFA 评分比较差异无统计意义(P>0.05)。BMI差异具有统计学意义(P<0.05),见表1。
表1 患者一般情况统计分析[()/n(%)]Tab.1 Statistical analysis of the general data of patients [()/n(%)]
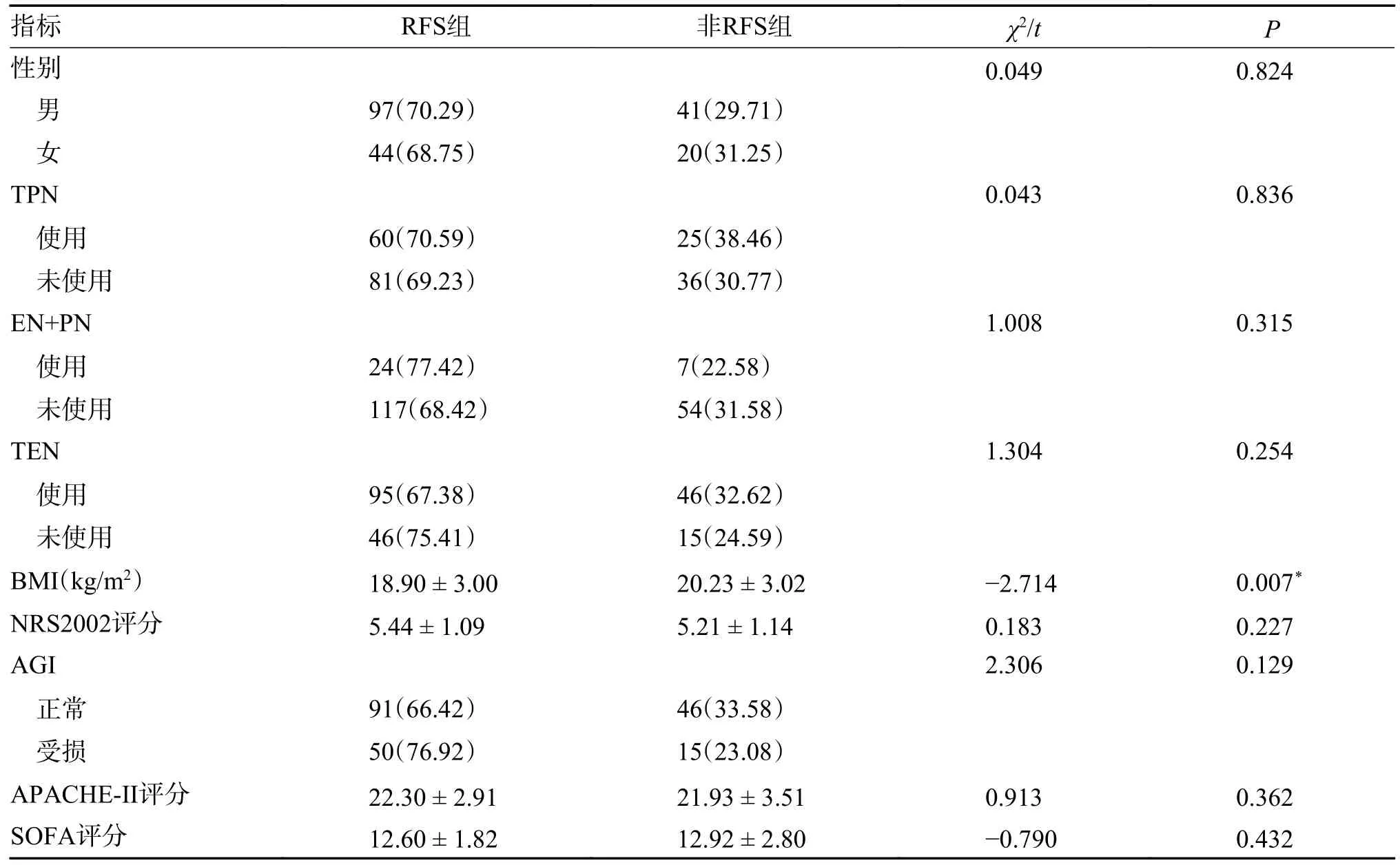
表1 患者一般情况统计分析[()/n(%)]Tab.1 Statistical analysis of the general data of patients [()/n(%)]
*P<0.05。
2.2 实验室指标分析
ALB、PA、CHI、血K+、血Mg2+、血P-、血Na+、FBG、HbA1c 均有统计学意义(P<0.05),发生RFS组中,上述指标对应的小于非RFS 组的值,见表2。
表2 患者实验室指标统计分析[()/M(P25,P75)]Tab.2 Statistical analysis of laboratory indicators of patients [()/M(P25,P75)]

表2 患者实验室指标统计分析[()/M(P25,P75)]Tab.2 Statistical analysis of laboratory indicators of patients [()/M(P25,P75)]
*P<0.05。
2.3 炎性指标与免疫情况分析
非RFS 组IL-6 比RFS 组低,差异有统计学意义(P<0.05),其余指标比较差异无统计学意义(P>0.05),见表3。
表3 2 组患者炎症指标与免疫系统情况比较[()/M(P25,P75)]Tab.3 Comparison of inflammatory indicators and immune system conditions between the two groups[()/M(P25,P75)]
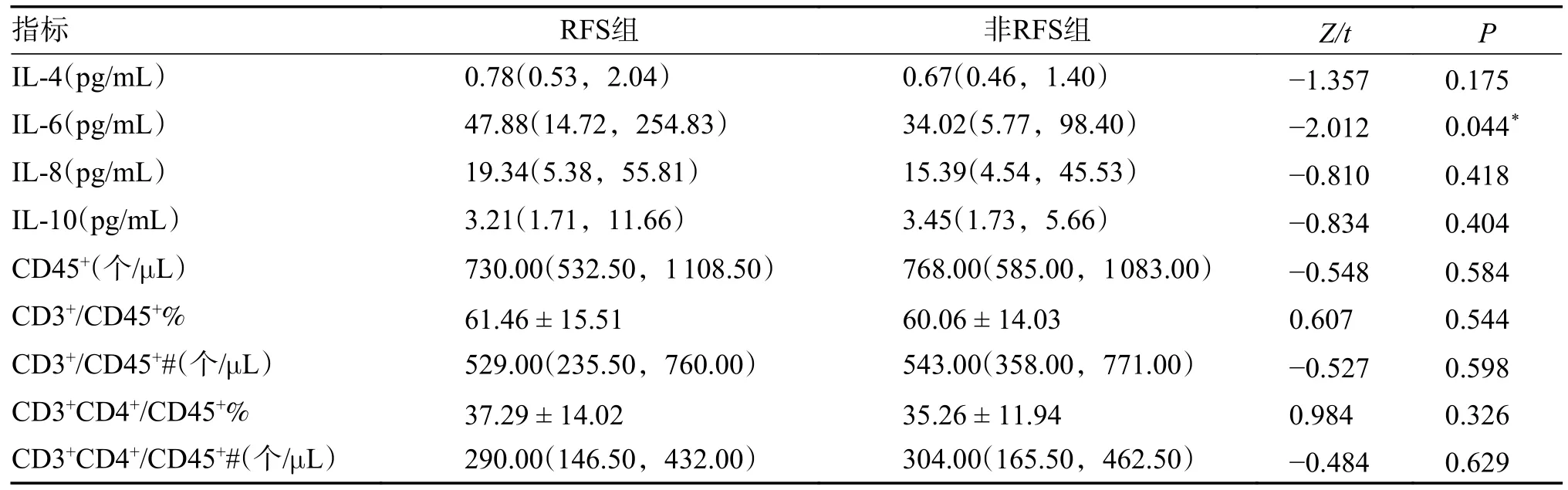
表3 2 组患者炎症指标与免疫系统情况比较[()/M(P25,P75)]Tab.3 Comparison of inflammatory indicators and immune system conditions between the two groups[()/M(P25,P75)]
*P<0.05。
2.4 药物使用及其他情况分析
使用利尿剂、使用胰岛素差异均具有统计学意义(P<0.05),其余指标均不具有统计学差异(P>0.05),使用利尿剂、胰岛素后发生RFS 的比例远大于未使用利尿剂的比例,见表4 。
表4 2 组患者药物使用与其它情况比较[()/M(P25,P75)/n(%)]Tab.4 Comparison of drug use with other conditions of patients between the two groups [()/M(P25,P75)/n(%)]
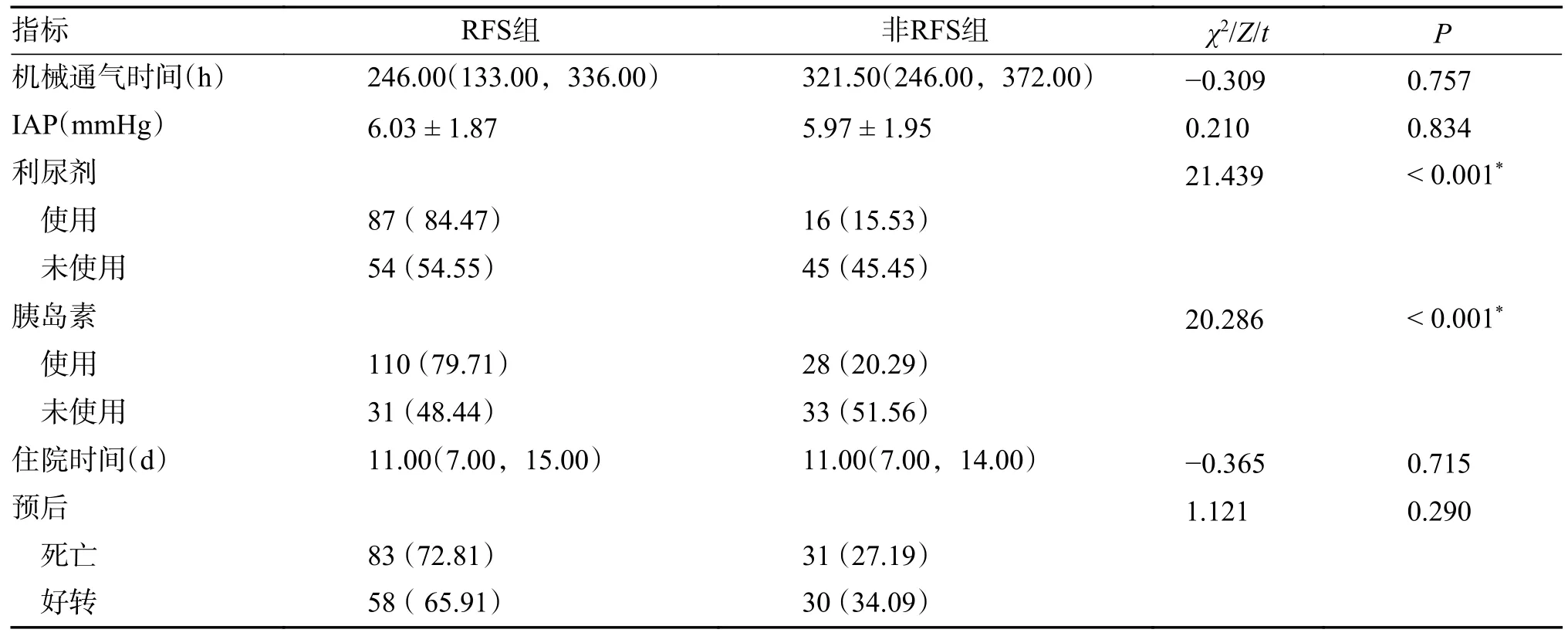
表4 2 组患者药物使用与其它情况比较[()/M(P25,P75)/n(%)]Tab.4 Comparison of drug use with other conditions of patients between the two groups [()/M(P25,P75)/n(%)]
*P<0.05。
2.5 单因素分析结果
进行统计学分析后,初步筛选出具有统计学的指标,见表5。

表5 ICU 脓毒症发生RFS 危险因素的单因素分析结果Tab.5 Results of the univariate logistics regression analysis of risk factors for the RFS development in ICU sepsis
2.6 多因素分析结果
将以上指标进一步纳入二分类非条件多因素Logistic 回归分析,最终筛选出6 个独立危险因素,分析结果显示:利尿剂、BMI、CHI、血K+、FBG、VitB1 以上6 个指标差异均具有统计学意义(P<0.05),为发生RFS 的独立危险因素,当使用利尿剂、BMI 值、CHI、血K+、FBG、VitB1 下降有发生RFS 的危险,见表6。

表6 ICU 脓毒症患者发生RFS 危险因素的多因素Logistic 回归分析Tab.6 Multivariate logistic regression analysis of the risk factors for developing RFS in ICU sepsis patients
2.7 预测模型表达式
将筛选出的6 个独立危险因素:是否使用利尿剂、BMI、CHI、血K+、FBG、VitB1 作为变量,并根据其对应的系数构建Logistic 回归模型,见表7。建立预测模型表达式为:

表7 预测模型中各个变量赋值表Tab.7 Each variable assignment table in the prediction model
L=1.39×利尿剂+0.15×BMI -0.14×CHI +0.75×血K+-0.16×FBG+0.78×VitB1 -2.94。
2.8 联合预测因子进行ROC 曲线分析
使用ROC 曲线分析本次纳入研究的脓毒症患者的多项指标联合预测因子以及各个变量分别对发生RFS 的预测价值(图1、表8)。分析后结果显示:联合预测因子构建预测模型:是否使用利尿剂、BMI、CHI、血K+、Glu、VitB1针对ICU脓毒症患者发生RFS 早期预测有一定预测价值,并且预测模型对RFS 发生危险预测效能AUC=0.83,大于全部各个变量,结果表明使用预测模型的工作性能优于使用单项指标预测RFS 工作性能。
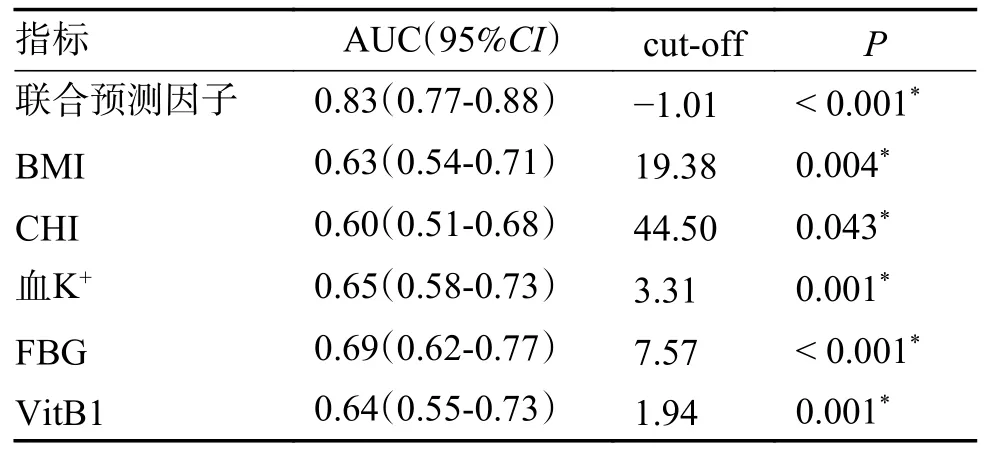
表8 联合预测指标和各个变量对ICU 脓毒症患者发生RFS 的预测价值Tab.8 Predictive value of the combined predictors and various variables for the occurrence of RFS in patients with ICU sepsis
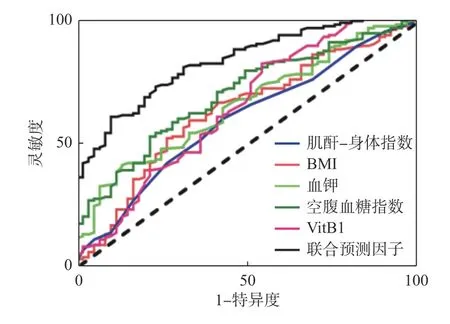
图1 联合预测因子及各个变量对RFS 诊断的ROC 曲线Fig.1 The ROC curves of the combined predictors and various variables for RFS diagnosis
预测价值:使用预测指标预测是否发生RFS的价值;联合预测因子是指使用以上6 个危险因素联合综合预测;cut-off 即为截断值,为判断标准,用于判断实验阳性与阴性的界值,这里可简单理解为是否发生RFS 的界值,代入公式中算出的L 值(预测值)与截断值相比较,若大于截断值,说明有发生RFS 的风险,越大说明发生的风险越高,相反,则说明目前未有发生RFS 的风险。
3 讨论
1948年,Burgers首次描述RFS并定义[5]。目前关于RFS 最新的定义是2020 年ASPEN 指南[6],将其定义为一类以低P-、低Mg2+和(或)低K+血症为特征的严重水电解质紊乱、循环超负荷、糖脂代谢紊乱等一系列代谢异常的临床综合征。对于RFS 来说,是一种综合征,本研究分析ICU脓毒症患者发生RFS 的相关危险因素,一定程度上可以帮助临床医师及早发现高风险患者,可以帮助临床医师及时快速关注RFS 的发生。通过统计学中的单因素和多因素Logistic 回归分析,筛选出ICU 脓毒症患者发生RFS 的独立危险因素。根据研究结果表明:是否使用利尿剂、BMI、CHI、血K+、FBG、VitB1 6 个指标是ICU 脓毒症患者发生RFS 的独立危险因素,并通过Logistic 回归方法创建预测模型,并通过ROC 曲线探讨联合指标的预测价值,临床上具有一定的实用性及创新性。
3.1 利尿剂的使用
在2006 年NICE 提出关于RFS 高危人群的风险指标[7]中明确指出利尿剂的使用属于风险指标中的次要风险指标。Tae Yang Choi等[3]根据入院后多个风险因素建立预测ICU 患者发生再喂养后低磷血症模型(RH)及Wong G J等[8]研究接受PN时发生RH 患病率高,并建立RH 预测模型中,利尿剂的使用与否均入选预测模型中因素。使用利尿剂后容易导致电解质紊乱特别是出现低K+、低Mg2+血症[9],使其成为RFS 高危因素。本研究发现利尿剂的使用差异有统计学意义(P<0.05),并且是发生RFS 的独立危险因素,这与其他研究结果相似[3,6-8]。
3.2 BMI
使用BMI 筛查营养状态,这是快速、简单了解患者营养状况的方式。对于营养状况的最新研究中,有学者[10]已经提出应将营养状况看作是基本生命体征之一,营养状态不但可以影响疾病病情的发展过程、临床结果,还可以影响未来的生存质量。有研究[11]表明即使BMI 正常的患者同样存在营养不良的风险,对于ICU 来说,患者特殊性及脓毒症代谢的特征,可导致疾病相关性营养不良(DAM)的发生。DAM 可在一定程度上加重既往营养不良的状况,出现严重营养不良。出现营养不良的情况后,应制定营养治疗计划,为营养不良的患者进行营养支持治疗时最易出现相关的营养并发症,其中以RFS 最为常见,其可严重影响临床结局。本研究分析显示:RFS 组的BMI(18.90±3.00)值明显低于非RFS 组(20.23±3.02),具有统计学差异,并且是发生RFS 的独立危险因素,这与NICE[5]及ASPEN[6]提出关于RFS 的高危人群风险诊断指标中报告结果相统一。
3.3 CHI
肌酐(Cre)是肌酸代谢后的产物,在肌肉中形成后由尿液排出,24 h 尿肌酐排泄可大致对无脂组织群(LBW)的估计,CHI 是成人营养状态敏感的指标,通过记录CHI 可对成年人的营养情况做出评估。使用CHI 可在BMI 的基础上进一步评估患者目前的营养状况,且可动态连续评估患者在整个住院期间的营养状况,在一定程度上可更加全面动态了解患者整体的营养状态。一项167 例回顾性分析显示,目前诊断营养不良最准确的指标是CHI,是机械通气患者成功脱机和预后强而有力的预测因子[12]。在本研究结果分析显示,与非RFS 患者相比,RFS 患者的CHI 指标明显更低,进一步的多因素回归分析,CHI 是ICU 脓毒症患者发生RFS 的独立危险因素。
3.4 血K+
电解质紊乱在危重患者中常发生[13],并且在危重患者中会常规检测电解质水平,而低K+血症在ICU 患者中非常常见,研究表明入住ICU 患者前2 周持续出现低K+血症与预后不良有关[14]。关于RFS 既往学者认为血P-的降低是最其重要的特征,但是最新的ASPEN 共识[6]中指出血K+的下降也是RFS 特征性表现。在一项长达2 a 对ICU患者并发RFS 危险因素和30 d 住院死亡率的队列研究[15]结果显示,低K+血症在危险因素中所占的比例(23.7%)高于低P-血症的比例(19.2%)。
细胞内的代谢反应及细胞的生物电活动都离不开K+,营养不良的患者,钠泵(Na+-K+泵)转运K+的能力下降,从而导致胞内的K+水平降低,当进行营养治疗后,胰岛素的分泌增加和Na+-K+泵摄取K+的能力增强,使细胞内外K+出现浓度差,从而引发一系列的临床症状,如神经肌肉瘫痪、呼吸肌无力、肠麻痹及心脏骤停等,增加发生RFS 机率,并可引发致命性的临床结局。
3.5 VitB1
VitB1 在能量的产生中起着不可替代的作用,VitB1 是葡萄糖通过柠檬酸循环产生细胞三磷酸腺苷(ATP)的重要辅酶,其在人体内无法合成,虽其在人体内有一定储存量,但为维持其在糖代谢中的作用,需每日摄入一定的生理需要量[16]。在ICU 中导致流失VitB1 的原因很多可能是因为液体的流失、代谢反应对其需要量增加、共病的治疗或是开始营养支持治疗后发生RFS 而降低[17]。ICU 中的患者再喂养之前可能已经存在不同程度上的VitB1 缺乏,当再次喂养后,由于糖代谢对VitB1 的需求在不断加剧,不断耗尽体内任何可用的VitB1,当人体内缺乏VitB1,导致柠檬酸循环受阻,体内糖分解供能的方式转变为无氧氧化,最终产生乳酸,引发乳酸酸中毒、代谢性酸中毒。
3.6 FBG
严格控制FBG,可使正常人体的生理机能得以正常运转[18]。将FBG 水平维持在4~6 mmol/L之间。FBG 维持在正常范围内,有利于保持内环境稳态,生命活动得以正常进行。对于脓毒症患者血糖控制的范围并未严格要求在正常范围之内,这是因为对于脓毒症患者而言,全身炎症反应明显,代谢的紊乱而导致出现反应性的高血糖。有关危重症成人中血糖目标的一项回顾性研究中[19],提出有关脓毒症患者血糖控制的范围,在7.8~10 mmol/L 之间。禁食时,体内葡萄糖含量降低,胰岛素分泌抵抗,胰高血糖素分泌增多,再次喂养后特别是碳水化合物,此时机体葡萄糖含量增加,胰岛素分泌增多,此时胰高血糖素分泌减少,体内开始进行糖代谢,胰岛素可以通过诱导Na+-K+泵重新对电解质进行分布,将细胞外的K+、Mg2+及P-转运至细胞内,致使发生电解质紊乱,增加发生RFS 的机率。
3.7 预测模型分析
本研究中使用多因素 Logistic 回归分析筛选出ICU 脓毒症患者发生RFS 的6 个独立危险因素为预测模型中的变量,根据其对应的回归系数拟合出RFS 的联合因子的预测模型。根据ROC 曲线分析显示,预测模型的AUC=0.83,大于各个变量,这表明联合因子的预测模型可在早期预测RFS 的发生,具有更好的灵敏度及敏感性。
综上所述,ICU 脓毒症患者发生RFS 预测模型拟合多种不同因素指标,观察其他常规生化指标变化与RFS 发生的相关性,联合多种不同生化指标,可以更加综合全面地评价ICU 患者发生RFS 的风险,可为临床实践中ICU 患者发生RFS的高危患者提供新的筛选方法,有利于对高风险患者进行早期干预,及时纠正高危患者异常生理生化指标,从而降低RFS 的发生,一定程度上改善危重患者的预后。

