过渡金属-联咪唑-Dawson型钨磷酸盐杂化化合物的酶固定化性能
朱浩天,金美秀,唐文思,苏芳,李阳光
(1.辽宁师范大学化学化工学院,大连 116029;2.多金属氧酸盐与网状材料化学教育部重点实验室,东北师范大学化学学院,长春 130024)
多金属氧酸盐或多酸(Polyoxometalates,POMs)是一类特殊的多齿含氧配体,可与过渡金属(TM)形成结构可调控的配合物,是构建有机-无机杂化材料优选的无机建筑单元.由于其结构中的多原子处于高氧化态及阴离子的高负电荷,使其显示出良好的电子贮存和携传能力,是优秀的光、电、磁材料[1~3].另外,POMs可与其它多种材料,如碳材料、氮化碳等复合[4~6],获得高性能不溶性复合材料.多酸基材料多用于催化领域,是光或光电催化、有机合成催化的良好催化剂[7~11].目前,多酸基材料的应用领域愈加广泛.
POMs结构稳定、催化活性高,是环境友好型催化剂,并且与生物分子之间也具有一定的生物相容性.在POM体系中引入有机或无机修饰基团,实现多酸结构调控,能明显改善和提高POMs的性能.如,Zhang等[12]制备了一种介孔氧化锆-POM盐ZrO2-P8W48,利用其与糖蛋白之间的相互作用成功地从蛋清和人血清样品中分离糖蛋白;Li等[13]通过静电纺丝法合成了POM修饰的壳聚糖纳米纤维(H5PMo10V2O40/壳聚糖纳米纤维,简称HPMoV/CS-f),实现了5-羟甲基糠醛高效氧化制备2,5-二甲酰基呋喃;Du等[14]以Cu-联咪唑(H2biim)配阳离子片断修饰Preyssler型{ZP5W30}(Z=Na,Ag)簇,得到2例拓展结构的POMs,通过简单的物理吸附法负载HRP,实现了所制备的固定化酶对H2O2的痕量检测.我们研究发现[14,15],具有平面结构的H2biim分子在POM体系中可形成多种类型的氢键,从而强化POM对生物大分子的作用,但因其在酸性条件下易质子化,遇POM阴离子时发生沉淀,一般条件下很难进入POM体系中,更难获得晶体材料.在水热条件下,这种沉淀作用可被有效抑制.
在前期工作基础上[15],本文继续尝试以Dawson型钨磷酸钾盐K6[α-P2W18O62]·14H2O(缩写为K-P2W18)为起始物,将TM和H2biim引入多酸体系,利用水热法合成了2例Dawson型晶态POM基有机-无机杂化材料[Ni(H2biim)3]4[Ni(H2biim)2(P2W18O62)2]·2H2O(1)和[CoIII(H2biim)3]2[P2W18O62]·8H2O(2);通过直接沉淀法合成了3例Dawson型POM基杂化材料,分别为[Cu(H2biim)2]3[P2W18O62]·4H2O(3),[CoII(H2biim)3]2H2[P2W18O62]·9H2O(4)和[Ni(H2biim)3]3[P2W18O62]·2H2O(5).此外,将它们作为辣根过氧化物酶(HRP)固定化载体,探究了固定化酶检测H2O2的性能.
1 实验部分
1.1 试剂与仪器
参照文献[16]方法合成母体化合物K-P2W18.HRP(同工酶C,P105528产品,K1506050批次,E.C.1.11.1.7,300 U/mg,RZ>3.0,Mw≈40 kDa)、异硫氰酸罗丹明B(RhBTC)和4-氨基安替比林(4-AAP),上海阿拉丁生化科技有限公司;苯酚(Phenol)、30%H2O2、Na2HPO4、NaH2PO4和H3PO4,分析纯,天津市科密欧化学试剂有限公司;不同pH值(3.5~8.5)的磷酸盐缓冲溶液(PBS,0.1 mol/L),使用以上磷酸及磷酸盐配制.
Bruker Smart APEXⅡ型单晶X射线衍射仪(SC-XRD)和Bruker AXS TENSOR-27型傅里叶变换红外光谱仪(FTIR),德国Bruker公司;Pyris Diamond TG-GTA型热重-差热综合分析仪(TG-DTA)和Perkin Elmer Lambda 35型紫外-可见分光光度计,美国Perkin Elmer公司;Zeiss LSM 710激光共聚焦显微镜(LSCM),德国Zeiss公司.
1.2 化合物1~5的合成
1.2.1 化合物1的合成将NiCl2·6H2O(0.070 g,0.29mmol)、H2biim(0.033g,0.25mmol)和蒸馏水(10.0 mL)混合,搅拌15 min,然后加入10.0 mL预先配制的K-P2W18(0.400 g,0.085 mmol)水溶液.将所得混合液于80℃搅拌2 h后转入20 mL带有聚四氟乙烯内衬的不锈钢反应釜中,密封后于180℃恒温反应3 d.缓慢冷却至室温后离心分离,得到褐色块状晶体,产率约45%(以W计).
1.2.2 化合物2的合成将CoCl2·6H2O(0.214 g,0.9 mmol)溶于蒸馏水(20.0 mL)中,在搅拌下缓慢加入H2biim(0.0604 g,0.45 mmol),搅拌1 h后加入10.0 mL K-P2W18(1.0183 g,0.21 mmol)水溶液,继续搅拌1 h,将所得混合液转入带有聚四氟乙烯内衬的反应釜中,密封后于120℃恒温反应3 d.缓慢冷却至室温后离心分离,得到橙色块状晶体,产率约60%(以W计).
1.2.3 化合物3~5的合成参考文献[15,17]方法,先合成配合物[Cu(H2biim)2]Cl2,[Co(H2biim)3]Cl2和[Ni(H2biim)3]Cl2.将[Cu(H2biim)2]Cl2(0.416 g,1.033 mmol)溶于40.0 mL温水中得到A溶液,将KP2W18(1.581 g,0.344 mmol)溶于40.0 mL温水中得到B溶液.然后,在搅拌下将B溶液缓慢滴加到A溶液中,立即有沉淀生成.滴加完毕后,将含有沉淀的反应液冷却至室温,过滤、自然干燥后,得到绿色粉末(化合物3).
化合物4和5的合成方法与化合物3基本相同,只是分别用[Co(H2biim)3]Cl2和[Ni(H2biim)3]Cl2代替[Cu(H2biim)2]Cl2,其产物为别为红色粉末(化合物4)和浅棕色粉末(化合物5).
1.3 化合物1和2的晶体数据收集
选取表面干净、无裂痕的形状规则、透明度好的化合物1和2的单晶,在室温下利用Bruker Smart APEXⅡ型单晶X射线衍射仪收集晶体数据(MoKα,λ=0.071013 nm);利用SHELXTL-2014程序完成数据分析、计算和校正[18];晶体解析中的非氢原子坐标采用最小二乘法进行修正;水分子及其上的氢原子可依据单晶解析和热重分析综合结果给出,直接添加在分子式中.另外,通过理论计算方法在N和C上加氢.化合物1和2的晶体学数据列于表1.
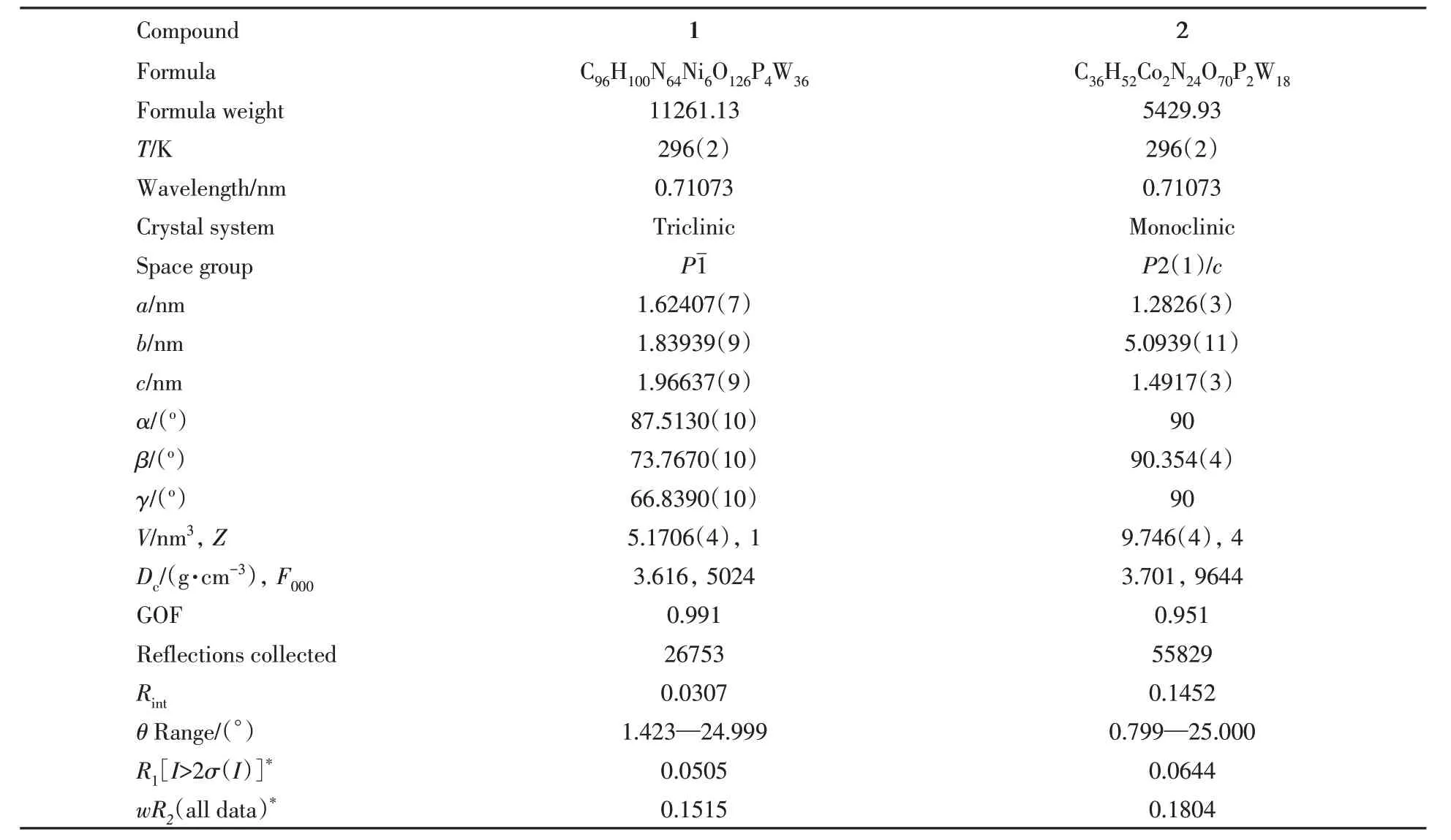
Table 1 Crystal and refinement data for compounds 1 and 2
1.4 酶的固载及固定化酶活性测定
根据文献[14,19,20]报道的酶固定化方法,选择HRP作为模型酶,化合物1~5分别为载体,采用直接吸附法制备固定化酶(HRP/1~HRP/5).选用Worthington法[21]评价酶活性,该方法是基于酶催化H2O2氧化苯酚与4-AAP的显色反应,进而利用分光光度法进行定性及定量分析,具体方法参照文献[14].
2 结果与讨论
2.1 结构描述
图1和图2分别为化合物1和2的多面体-球棍图.从图1(A)可以看出,化合物1中含有2个[P2W18O62]6-杂多阴离子单元,并通过2个[Ni(H2biim)2]2+配阳离子基团相互连接,其外围有2对对称的游离的[Ni(H2biim)3]2+配阳离子和2个H2O分子,形成对称的二聚体结构.结构中的6个Ni(Ⅱ)离子均为六配位,但其连接方式不同.其中Ni1分别与2个H2biim中的4个N和2个[P2W18O62]6-杂多阴离子单元中的2个端氧相连;而游离的4个[Ni(H2biim)3]2+配阳离子中Ni2和Ni3分别与来自3个H2biim分子中的6个N原子配位.分子间通过静电引力和氢键相互作用[d(N—H···O/OW)=0.257(5)~0.324(2)nm]堆积形成三维(3D)结构,如图1(B)所示.
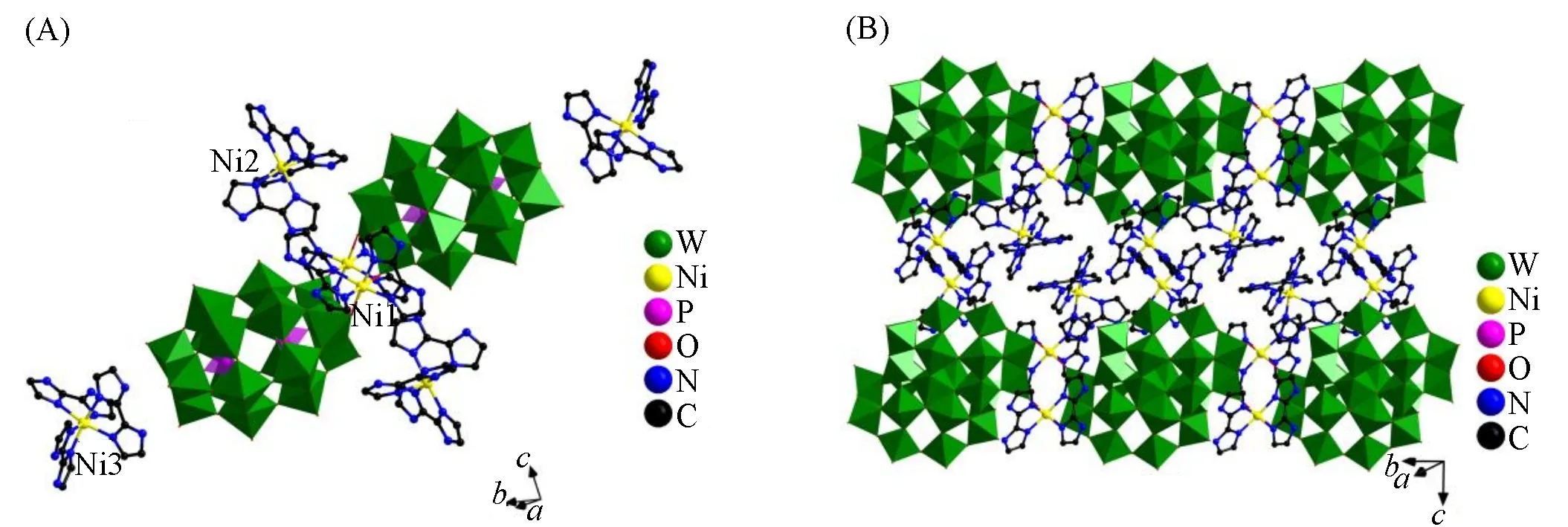
Fig.1 Coordination environment(A)and the 3D structure(B)of compound 1
SC-XRD分析结果表明,化合物2由1个Dawson型阴离子[P2W18O62]6-、2个[Co(H2biim)3]3+配阳离子和8个结晶水组成.在溶液中可能由于多酸的强氧化性,Co(Ⅱ)被氧化成Co(Ⅲ),该结果可由价键计算和电荷平衡得以验证[22,23].[Co(H2biim)3]3+配阳离子围绕在Dawson型阴离子[P2W18O62]6-周围形成荷移盐.每个[Co(H2biim)3]3+配离子中,Co配位中心与3个H2biim分子所提供的6个N配位,形成扭曲的八面体几何构型[∠N—Co—N=81.9(9)°~94.1(10)°].相邻的Dawson型杂多阴离子[P2W18O62]6-通过与H2biim之间的氢键[d(N—H···O)=0.256(6)~0.307(3)nm]以及较强的静电作用形成3D超分子结构(图2).化合物1和2的主要晶体学数据参见CCDC 2171851和2171852.另外,根据合成时添加的物料比,通过IR和TG-DTA分析并依据电荷平衡原理,计算得出化合物3~5的分子式.
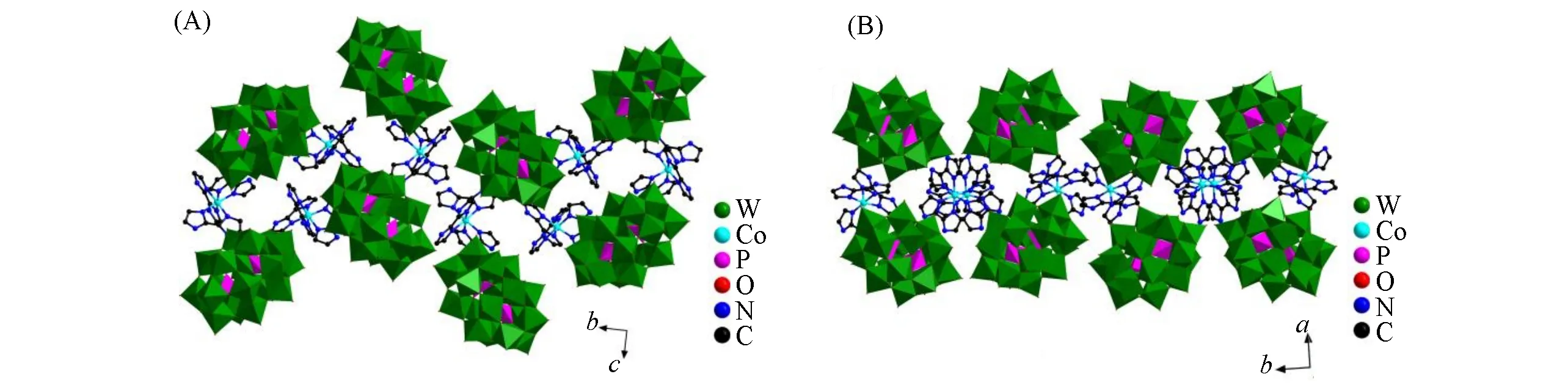
Fig.2 3D structures of compound 2 along a(A)and c(B)directions
2.2 表 征
2.2.1 FTIR光谱分析图3显示了化合物1~5的FTIR光谱.3550~3342 cm-1范围内的吸收峰归属于H2O分子中O—H的伸缩振动;3139~2788 cm-1范围内的吸收峰归属于H2biim分子中C—H和N—H的伸缩振动[24,25];1635~1178 cm-1范围内的吸收峰归属于H2biim分子的特征伸缩振动;1093~1091,966~964,914~910和806~798 cm-1范围内的吸收峰分别归属于多酸阴离子中v(P—Oa),v(W—Od),v(W—Oc—W)和v(W—Ob—W)的伸缩振动(Oa,Od,Oc/Ob分别表示四面体氧、端氧和桥氧)[26].从以上IR谱图及分析结果可知,化合物1~5均具有POM的4个特征峰,表明其具有相同的POM阴离子,即Dawson型POM阴离子.
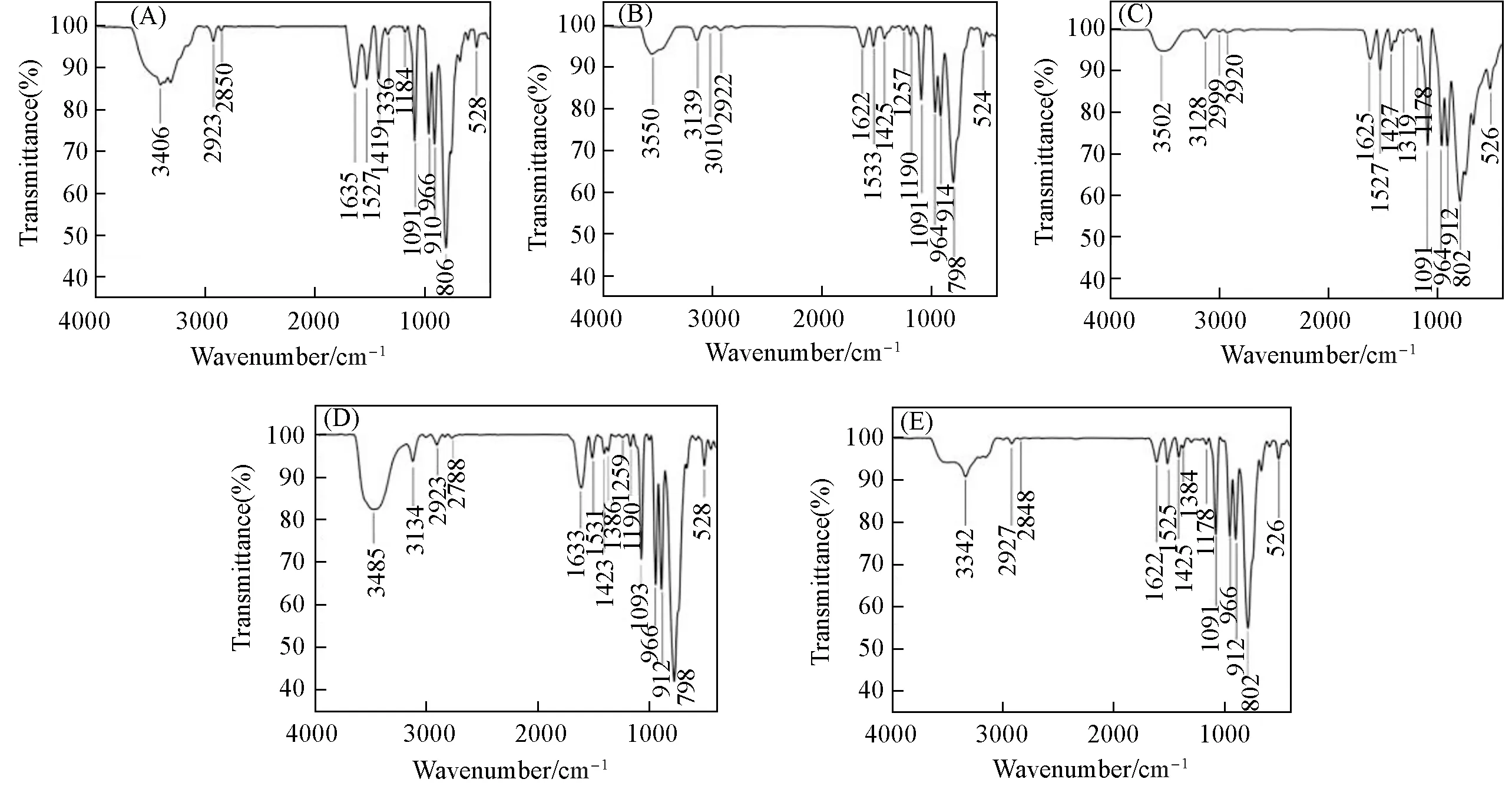
Fig.3 FTIR spectra of compounds 1—5(A—E)
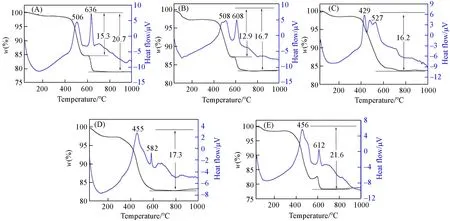
Fig.4 TG-DTA curves of compounds 1—5(A—E)
2.2.2 热重分析图4为化合物1~5的TG-DTA曲线.从图4(A)可以看出,化合物1在30~800℃的温度范围内存在两步失重,分别对应失去2个结晶H2O分子和16个H2biim分子,总失重为20.7%(理论值19.5%).化合物2也有两步失重[图4(B)],分别对应失去8个结晶H2O分子和6个H2biim分子,总失重为16.7%(理论值为17.7%).化合物3在30~800℃范围内分别失去6个H2biim分子和4个结晶H2O分子,总失重为16.2%(理论值为16.2%)[图4(C)].图4(D)显示化合物4在30~800℃范围内总失重为17.3%,两步失重分别对应失去9个结晶H2O分子和6个H2biim分子(理论值为17.9%).化合物5在30~800℃范围内分别失去9个H2biim分子和2个结晶H2O分子,总失重为21.6%(理论值为21.7%)[图4(E)].从DTA曲线可以看出,化合物1~5在429~636℃范围内均有明显的放热峰,这归因于H2biim分子的燃烧[27].以上结果表明,当温度低于800℃时,多酸骨架仍然保持,说明化合物1~5具有良好的热稳定性.
2.3 酶固定化的影响因素
pH值、酶浓度和固定时间等是影响酶固定化效率的重要因素,而载体的稳定性也是关键因素之一.为了评估POM基杂化化合物1~5的稳定性,将它们分别浸泡于不同pH值(3.5~8.5)的PBS中,12 h后离心分离并测定化合物的IR光谱.从图5可以看出,所有化合物在PBS中浸泡后仍能观察到明显的特征峰,表明化合物1~5在pH=3.5~8.5的PBS中具有良好的稳定性,可以作为载体固定HRP.从图6可以看出,化合物1~5在固定HRP前后IR特征峰位基本吻合,说明POM载体在酶固定化过程中主体结构没有发生改变,显示出良好的稳定性.
Fig.5 FTIR spectra of compounds 1—5(A—E)before and after soaking in PBS at pH=3.5—8.5 for 12 h

Fig.6 FTIR spectra of compounds 1—5(A—E)before and after enzyme immobilization
随后研究了pH值对HRP负载量(Q,mg/g)和固定化HRP活性的影响.Q由下式计算得出[28]:

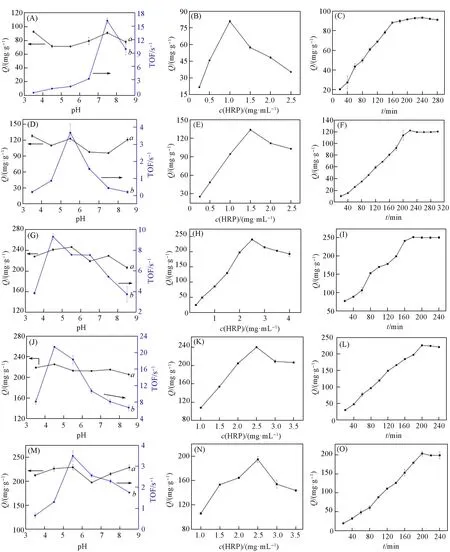
Fig.7 HRP loading and TOF change curves with pH(A,D,G,J,M),effect of HRP concentration on the HRP loading(B,E,H,K,N),and effect of immobilization time on the HRP loading(C,F,I,L,O)Supports:compound 1(A—C);compound 2(D—F);compound 3(G—I);compound 4(J—L);compound 5(M—O).
式中:c0和c(mg/mL)分别是固定前后HRP的浓度,可利用标准曲线获得;V(mL)为HRP溶液的体积;Ws(g)为POM化合物的质量.在pH=3.5~8.5范围内,HRP在化合物1上的负载量随着pH值增加呈现波动性变化[图7(A)曲线a];HRP/1的转换频率(TOF)值随着pH的增加而增加,在pH=7.5时达到最大值,而后急剧减小(pH=8.5)[图7(A)曲线b].因此,综合考虑酶负载量和固定化酶活性,HRP固定在化合物1上的最适pH值为7.5.
在pH=7.5时进一步研究了HRP浓度和固定时间对化合物1固载HRP的影响[图7(B)和(C)].当HRP浓度和固定时间分别为1.0 mg/mL[图7(B)]和240 min[图7(C)]时,酶负载量接近最大值.基于以上实验结果,化合物1固载HRP的最佳实验条件如下:HRP浓度1.0 mg/mL;pH=7.5;固定时间240 min.HRP最大负载量为91.7 mg/g.对于化合物2~5,按照上述方法,同样研究了pH,HRP浓度和固定时间对HRP负载量和固定化HRP活性的影响[图7(D)~(O)].化合物2~5固载HRP的最适pH、HRP浓度、固定时间以及HRP负载量Q分别为:5.5,1.5 mg/mL,220 min和122.7 mg/g;4.5,2.5 mg/mL,180 min和241.3 mg/g;4.5,2.5 mg/mL,200 min和225.3 mg/g;5.5,2.5 mg/mL,200 min和229.0 mg/g.上述结果显示化合物1~5对HRP的负载量均很高,表明二者之间存在很强的吸附作用.
研究表明,HRP与载体之间的吸附作用是由多种作用力决定的[12,14,29].为了确定POM化合物与HRP之间存在静电相互作用,通过Zeta电位分析了化合物1和游离HRP的表面电位.在pH=7.5时,化合物1的表面电位为-22 mV,而游离HRP表面则带正电(表面电位为5 mV),证明表面带有大量负电荷的化合物1易与表面带正电荷的HRP形成静电相互作用.同时,含N修饰基团的引入不仅使化合物分子内形成了大量的氢键,同时也易与HRP产生氢键作用[30].以上结果表明,本文合成的POM基杂化化合物可通过多种非键作用将酶稳定地固定在其表面.
2.4 固定化酶的表征
HRP可以通过简单的物理吸附直接固定在化合物1~5上,但与载体相比HRP的含量少,很难确定HRP的存在,因此采用荧光标记法检测所得固定化酶中的HRP[31].用RhBTC标记HRP(RhBTC-HRP)后,按照1.4节实验方法进行标记酶的固定化,并通过LSCM对固定化标记酶RhBTC-HRP/1~RhBTCHRP/5进行检测(图8).从图8可以清楚地观察到红色发光点,证实HRP已负载在化合物1~5上.为了研究固定化后酶的结构是否发生改变,比较了游离HRP和从载体(化合物1~5)上洗脱的HRP的CD谱.如图9所示,解吸的HRP与游离HRP的CD曲线吻合良好,表明固定化后HRP的二级结构未发生改变,同时也说明5个POM化合物具有良好的生物相容性,能够最大程度地保留HRP的活性.

Fig.8 LSCM images of RhBTC-labeled HRP/1—HRP/5(A—E)λex=543 nm.
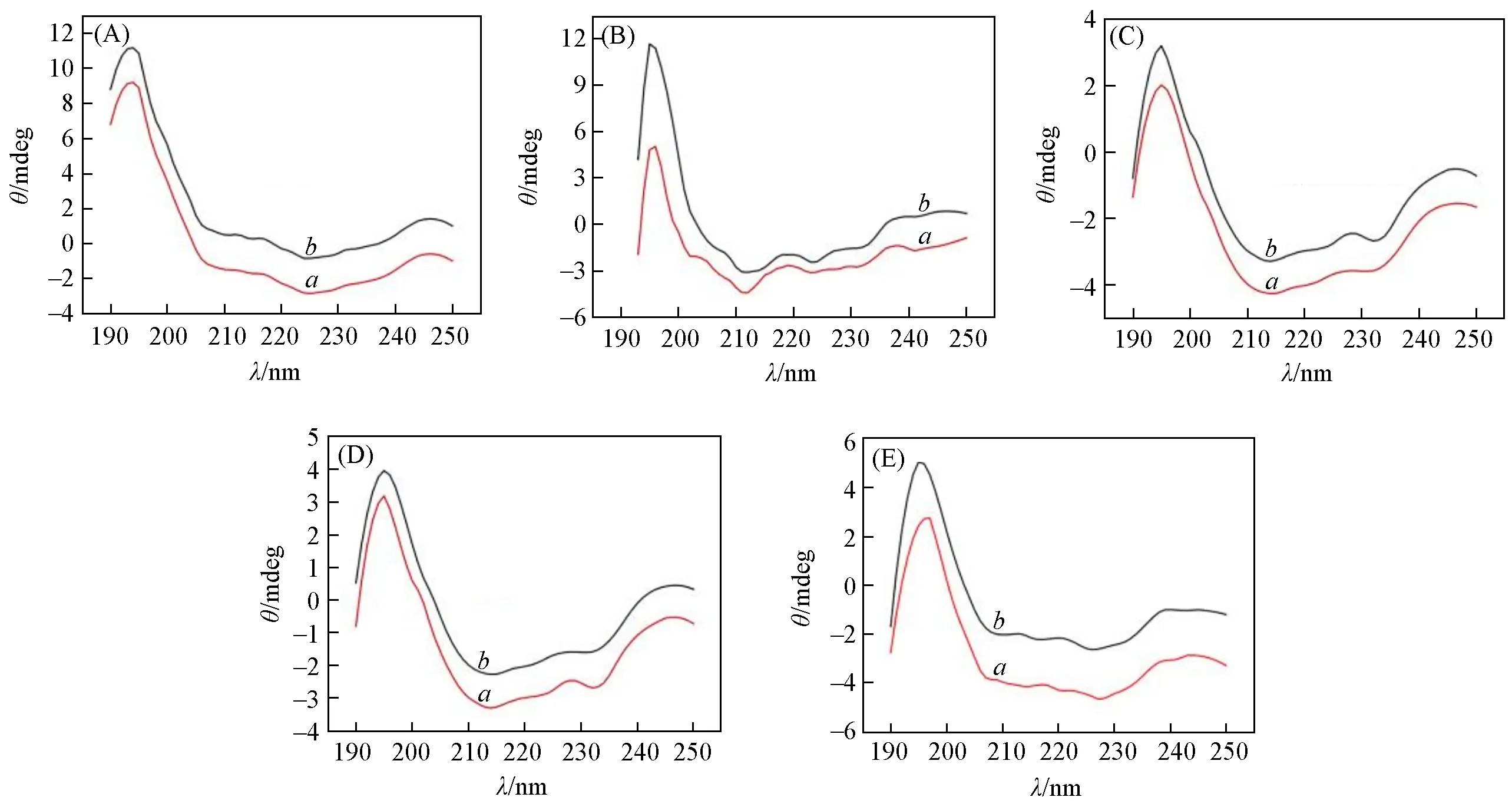
Fig.9 CD spectra of desorbed HRP(a)from immobilized enzymes HRP/1—HRP/5(A—E)and free HRP(b)
2.5 固定化酶的重复使用性和储存稳定性
相比于游离HRP,固定化酶HRP/1~HRP/5易于从反应系统中分离出来并实现重复使用.以固定化酶第一轮反应的TOF值为基准,计算其重复使用后的相对活性.如图10所示,5例固定化酶均能实现重复使用,连续使用9次后仍能保留50%以上的活性,表明HRP/1~HRP/5具有良好的可重用性.固定化酶活性的下降可能是由于反复洗涤或长时间暴露于高浓度底物中造成了HRP溶脱或失活[32].
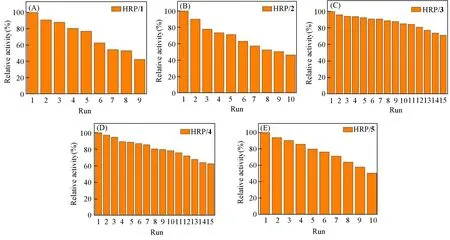
Fig.10 Relative activity of HRP/1—HRP/5(A—E)after repeated uses
在室温下保存1~12 d后,利用Worthington方法研究游离HRP和HRP/1~HRP/5的储存稳定性(图11).以第一天测得的固定化酶TOF值为基准,计算其存储后的相对活性.由图11可见,12 d后游离HRP活性显著下降至20%以下,而固定化酶在相同的储存条件下相对活性仍保持在70%以上,证明固定在这类POM载体上后,HRP的储存稳定性明显提高.即,与游离HRP相比,固定化HRP更稳定,更不易受到环境因素的影响.
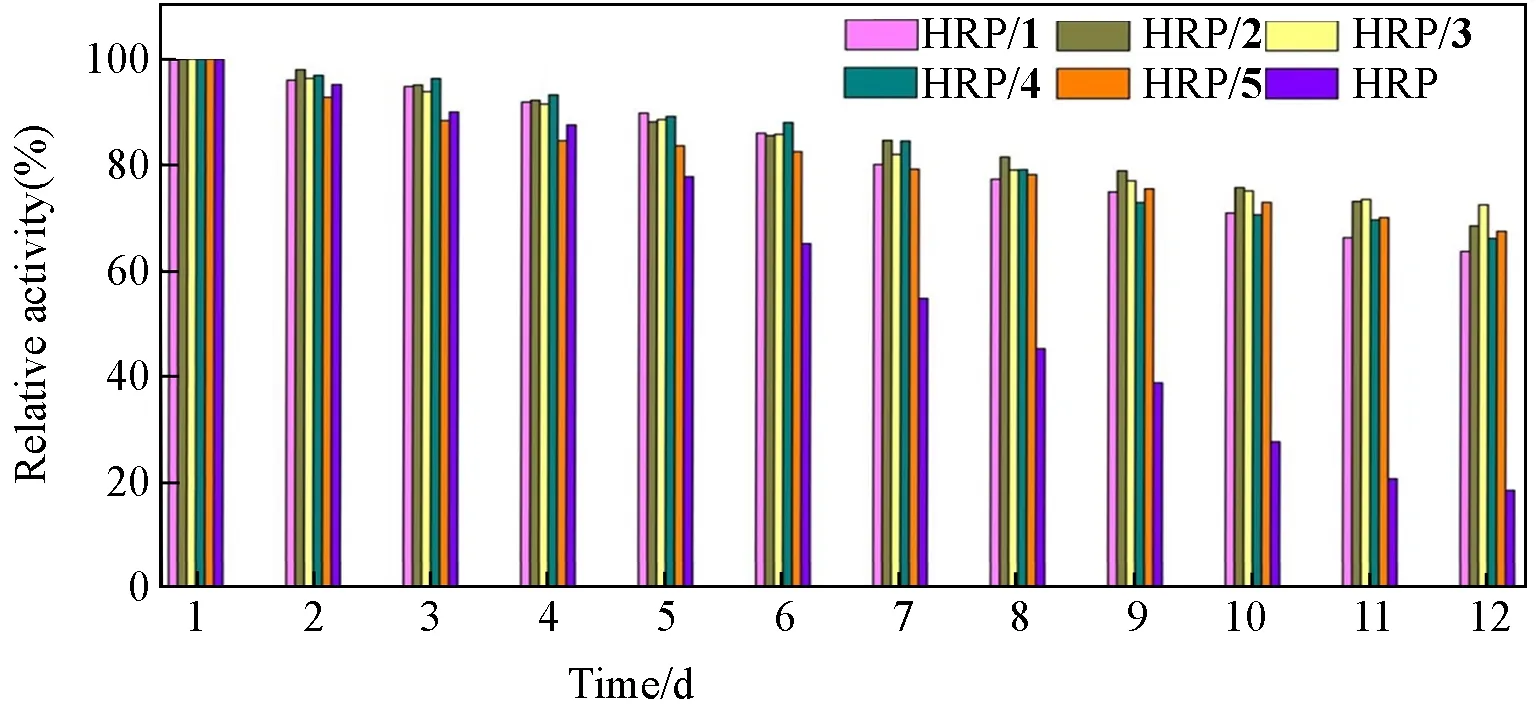
Fig.11 Relative activity of HRP/1—HRP/5 and free enzyme during storage at 25℃for 12 d
2.6 过氧化氢检测
4-APP与苯酚反应的红色产物的吸光度与H2O2的用量成正比,因此,Worthington方法可用于H2O2检测.从图12可以看出,当H2O2浓度增加时,在一定浓度范围内510 nm处吸光度的变化值与H2O2浓度呈线性关系.固定化酶HRP/1-HRP/5检测H2O2的线性范围分别为0.04~0.35,0.04~0.26,0.04~0.52,0.04~0.44,0.04~0.44 mmol/L;H2O2的检出限分别为1.49,1.35,2.58,5.75,4.09 μmol/L.其中化合物1和2的检出限甚至与电荷更高的Preyssler型POM基材料接近(1.61和1.49 μmol/L)[14].
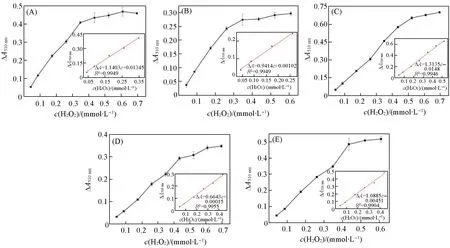
Fig.12 Linear standard curve for HRP/1—HRP/5(A—E)to detect H2O2ΔA510 nm=A(immobilized HRP,510 nm)-A(blank,510 nm).
3 结论
TM和H2biim的引入增强了传统POM的性能,使5种新的Dawson型有机-无机杂化化合物具有新的应用.该类Dawson型POM和TM-H2biim组成的有机-无机杂化化合物被用作HRP固定化的载体,固定化酶HRP/1—HRP/5具有较高的稳定性和催化活性,可以开发一种用于检测痕量H2O2的比色系统.本工作表明,基于POM的不溶性材料可能是一种优秀的酶固定化载体并可应用于酶催化反应.

