新型3-苯基特胺酸衍生物的合成与除草活性
柴源卿,杨 颖,王晓菲,温世强,吕 培
(1.安徽农业大学 资源与环境学院,安徽省农产品质量安全重点实验室,安徽 合肥 230036;2.安徽农业大学 植物保护学院 安徽 合肥 230036)
0 引言
细交链格孢菌酮酸(Tenuazonic acid,简称TeA)在1957年由Rosett[1]等人首先从链格孢菌(Alternaria alternata(Fr.)Keissler)培养液中分离得到,1959年Stickings[2]等人确定其结构为3-乙酰基特胺酸骨架的化合物,分子式为C10H15NO3(图1),Osada等人证明了TeA是由异亮氨酸和乙酰乙酰辅酶A通过TeA合成酶(TAS1)得到[3]。
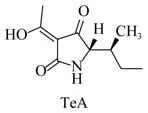
图1 TeA的结构
研究表明TeA可有效控制紫茎泽兰(Eupatorium adenophorum)及其生境的主要杂草、农田禾草及多种阔叶杂草[4],当3位为苯甲酰基、亚乙烯基、酰胺和酰肼取代的TeA衍生物的除草活性较好[5]。强胜等人发现TeA具有光谱快速、高效的除草活性,在双子叶和单子叶杂草的防治方面具有较高潜力[6-8],随后通过研究明确了TeA是一种全新的来源于真菌的光系统II抑制剂,其作用靶点是光系统II的D1蛋白[9]。
Bayer公司在原卟啉原氧化酶(PPO)抑制剂类除草剂的创制过程中意外发现的螺虫乙酯(spirotetramat)[10-12]、螺螨酯(spirodiclofen)[13]和螺甲螨酯(spiromesifen)[14]以及先正达集团开发的甲氧哌啶乙酯(spiropidion)[15]是4个最有代表性、具有螺环季酮酸骨架的3-苯基特胺酸类化合物(图2)。在对该骨架化合物进行活性筛选时发现其同时具有良好的除草活性[16]。目前报道较多的合成方法是特胺酸骨架5位为五元或六元螺环,针对性修饰3位苯基和4位羟基,关于5位为不同烷基支链的3-苯基取代特胺酸结构与除草活性尚未报道。基于TeA具有明显的除草活性和螺环季酮酸的活性基团,为了发现具有高除草活性的化合物,本研究拟利用TeA和螺环季酮酸共活性基团策略对特胺酸骨架的3、4和5位进行修饰,在5位引入不同的天然和人工合成氨基酸的R基实现多官能化并筛选目标化合物的除草活性,探讨目标化合物的构效关系。
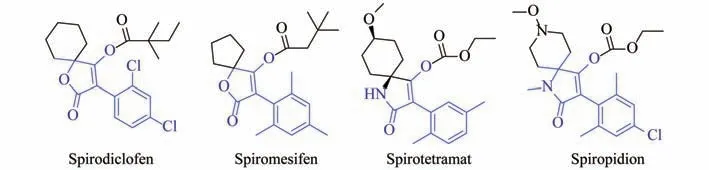
图2 螺虫乙酯、螺螨酯、螺甲螨酯和甲氧哌啶乙酯的结构
1 实验部分
1.1 仪器与试剂
核磁共振分析采用DD2 600 MHz核磁共振仪,四甲基硅(TMS)为内标,氘代试剂使用CDCl3、DMSO-d6或CD3OD;高分辨质谱采用组合型四极杆静电场轨道阱液质联用仪;熔点采用MP120全自动熔点仪;除草活性测定采用人工气候培养箱;实验所用试剂包括氨基酸甲酯盐酸盐(均为L-构型)、2,4-二氯苯乙酸、2,5-二甲基苯乙酸和2,2-二甲基丁酸,购于上海皓鸿生物医药有限公司。其他常规溶剂购于西陇科学股份有限公司,分析纯,经过分子筛干燥后使用。对照药剂:硝磺草酮,纯度97%标准品,上海百灵威科技有限公司。TeA,实验室前期化学合成所得[17]。
1.2 化合物的合成
1.2.1 中间体3a~3n的合成。参考文献方法[18]进行,在室温条件下,将氨基酸甲酯盐酸盐(10 mmol)溶解在盛有无水CH2Cl2溶液(30 m L)的茄形瓶(100 m L)中,再依次加入DMAP(1.83 g,15 mmol)和EDC·HCl(2.88 g,15 mmol),之后向上述混合溶液中滴加溶解有2,4-二氯苯乙酸(3.08 g,15 mmol)的无水CH2Cl2溶液(15 mL),反应16 h后用TLC跟踪至原料反应完全。有机相用5% NaHCO3溶液(30 mL×3)洗涤3次,再用纯水(30 m L×3)洗涤3次至溶液呈中性,将有机相置于无水Na2SO4上干燥,过滤并浓缩。通过柱层析法(EA:PE=1:3)提纯,得到中间体3a~3g;将上述反应中取代苯乙酸替换为2,5-二甲基苯乙酸(2.46 g,15 mmol),反应时间与后处理方法相同。通过柱层析法(EA:PE=1:2)提纯,得到中间体3l~3n。
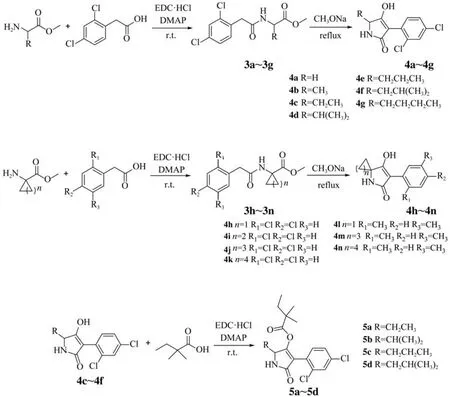
图3 目标化合物合成路线
1.2.2 目标化合物4a~4n的合成。将合成所得的中间体3a~3g(3 mmol)溶解在盛有CH3OH溶液(20 m L)的茄形瓶(100 m L)中,搅拌5 min后,向上述溶液中加入30%CH3ONa溶液(2.70 g,15 mmol),缓缓升温至回流(温度设定为75℃),反应8 h后用TLC跟踪至原料反应完全。待其冷却至室温后,旋转蒸发除去溶剂CH3OH,加入纯水(15 m L),并用1 mol/L HCl调节其p H至2~3,抽滤。通过柱层析法(EA:PE=2:1)提纯,得到目标化合物4a~4g;将中间体3l~3n与30%CH3ONa溶液的当量比改为1∶3,反应时间设为5 h,后处理方法同上。通过柱层析法(EA∶PE=1∶1)提纯,得到目标化合物4h~4n。
3-(2,4-二氯苯基)-4-羟基吡咯啉-2-酮(4a):淡红色固体,产率85%,熔点:96~99℃;1H NMR(600 MHz,DMSO-d6)δ:11.54(s,1H),7.59(d,J=1.7 Hz,1H),7.46(s,1H),7.39(dd,J=8.3,1.7 Hz,1H),7.27(d,J=8.3 Hz,1H),3.89(s,2H)。13C NMR(150 MHz,DMSO-d6)δ:173.3,169.8,135.2,134.1,132.7,130.3,128.9,127.0,104.0,45.9。HRMS[ESI+]for C10H7Cl2NO2[(M+H)+],m/z Calcd:243.992 7;Found:243.992 9。
3-(2,4-二氯苯基)-4-羟基-5-甲基吡咯啉-2-酮(4b):白色固体,产率87%,熔点:102~104℃;1H NMR(600 MHz,DMSO-d6)δ:11.20(s,1H),7.60(s,1H),7.60(s,1H),7.40(dd,J=8.3,2.2 Hz,1H),7.27(d,J=8.3 Hz,1H),4.04~4.00(m,1H),1.29(d,J=6.7 Hz,3H)。13C NMR(150 MHz,DMSO-d6)δ:173.0,171.9,135.3,134.3,132.7,130.2,128.9,127.0,103.1,51.9,18.9。HRMS[ESI+]for C11H9Cl2NO2[(M+H)+],m/z Calcd:258.008 3;Found:258.008 0。
3-(2,4-二氯苯基)-4-羟基-5-乙基吡咯啉-2-酮(4c):白色固体,产率82%,熔点:97~99℃;1H NMR(600 MHz,DMSO-d6)δ:11.15(s,1H),7.61(s,1H),7.59(d,J=1.9 Hz,1H),7.39(dd,J=8.3,2.1 Hz,1H),7.26(d,J=8.3 Hz,1H),4.02~3.96(m,1H),1.84~1.79(m,1H),1.62~1.56(m,1H),0.86(t,J=7.3 Hz,3H)。13C NMR(150 MHz,DMSO-d6)δ:172.4,171.3,135.3,134.3,132.7,130.4,128.9,127.0,104.3,56.9,24.6,8.6。HRMS[ESI+]for C12H11Cl2NO2[(M+H)+],m/z Calcd:272.024 0;Found:272.024 4。
3-(2,4-二氯苯基)-4-羟基-5-异丙基吡咯啉-2-酮(4d):白色固体,产率80%,熔点:95~97℃;1H NMR(600 MHz,DMSO-d6)δ:11.08(s,1H),7.61(s,1H),7.59(d,J=2.1 Hz,1H),7.39(dd,J=8.3,2.1 Hz,1H),7.25(d,J=8.3 Hz,1H),3.92(d,J=1.2 Hz,1H),2.18~2.13(m,1H),1.02(d,J=7.0 Hz,3H),0.76(d,J=6.8 Hz,3H)。13C NMR(150 MHz,DMSO-d6)δ:172.8,170.8,135.4,134.3,132.7,130.3,128.9,127.0,104.6,61.3,29.0,20.2,14.9。HRMS[ESI+]for C13H13Cl2NO2[(M+H)+],m/z Calcd:286.039 6;Found:286.039 7。
3-(2,4-二氯苯基)-4-羟基-5-丙基吡咯啉-2-酮(4e):白色固体,产率83%,熔点:96~98℃;1H NMR(600 MHz,DMSO-d6)δ:11.14(s,1H),7.68(s,1H),7.59(d,J=1.1 Hz,1H),7.39(dd,J=8.2,1.2 Hz,1H),7.25(d,J=8.3 Hz,1H),4.01~3.96(m,1H),1.81~1.75(m,1H),1.50~1.44(m,1H),1.43~1.31(m,2H),0.90(t,J=7.3 Hz,3H)。13C NMR(150 MHz,DMSO-d6)δ:172.3,171.7,135.3,134.3,132.7,130.3,128.8,127.0,103.9,56.0,34.3,17.8,14.3。HRMS[ESI+]for C13H13Cl2NO2[(M+H)+],m/z Calcd:286.039 6;Found:286.039 4。
3-(2,4-二氯苯基)-4-羟基-5-异丁基吡咯啉-2-酮(4f):白色固体,产率86%,熔点:97~100℃;1H NMR(600 MHz,DMSO-d6)δ:11.14(s,1H),7.76(s,1H),7.59(d,J=2.1 Hz,1H),7.39(dd,J=8.3,2.1 Hz,1H),7.25(d,J=8.3 Hz,1H),4.06~3.91(m,1H),1.88~1.79(m,1H),1.68~1.63(m,1H),1.34~1.28(m,1H),0.93(d,J=6.0 Hz,3H),0.92(d,J=6.6 Hz,3H)。13C NMR(150 MHz,DMSO-d6)δ:172.4,172.3,135.3,134.3,132.7,130.3,128.8,127.0,103.5,54.8,42.1,24.9,24.2,22.1。HRMS[ESI+]for C14H15Cl2NO2[(M+H)+],m/z Calcd:300.055 3;Found:300.055 6。
3-(2,4-二氯苯基)-4-羟基-5-丁基吡咯啉-2-酮(4g):白色固体,产率85%,熔点:99~111℃;1H NMR(600 MHz,DMSO-d6)δ:11.13(s,1H),7.65(s,1H),7.59(s,1H),7.39(d,J=8.3 Hz,1H),7.25(d,J=7.8 Hz,1H),4.05~3.97(m,1H),1.85~1.77(m,1H),1.53~1.45(m,1H),1.36~1.27(m,4H),0.88(t,J=5.8 Hz,3H)。13C NMR(150 MHz,DMSO-d6)δ:172.3,171.6,135.3,134.2,132.7,130.3,128.9,127.0,104.0,56.1,31.6,26.5,22.5,14.3。HRMS[ESI+]for C14H15Cl2NO2[(M+H)+],m/z Calcd:300.055 3;Found:300.055 6。
3-(2,4-二氯苯基)-4-羟基-1-氮杂螺[2.4]庚-3-烯-2-酮(4h):白色固体,产率85%,熔点:103~105℃;1H NMR(600 MHz,DMSO-d6)δ:11.09(s,1H),7.70(s,1H),7.60(d,J=2.1 Hz,1H),7.40(dd,J=8.4,2.2 Hz,1H),7.30(d,J=8.3 Hz,1H),1.31~1.28(m,2H),1.24~1.21(m,2H)。13C NMR(150 MHz,DMSO-d6)δ:174.1,171.5,135.6,134.5,133.5,130.5,128.8,127.0,103.5,33.1,11.4(2C)。HRMS[ESI+]for C12H9Cl2NO2[(M+H)+],m/z Calcd:270.008 3;Found:270.008 5。
3-(2,4-二氯苯基)-4-羟基-1-氮杂螺[3.4]辛-3-烯-2-酮(4i):白色固体,产率88%,熔点:104~107℃;1H NMR(600 MHz,DMSO-d6)δ:11.28(s,1H),8.03(s,1H),7.59(d,J=2.0 Hz,1H),7.41(d,J=8.3 Hz,1H),7.24(d,J=8.3 Hz,1H),2.47(dd,J=7.1,3.9 Hz,1H),2.35~2.29(m,1H),2.16~2.11(m,1H)。13C NMR(150 MHz,DMSO-d6)δ:174.8,168.5,134.5,133.4,132.3,130.2,128.8,127.0,101.5,65.3,31.2(2C),15.6。HRMS[ESI+]for C13H11Cl2NO2[(M+H)+],m/z Calcd:284.024 0;Found:284.024 1。
3-(2,4-二氯苯基)-4-羟基-1-氮杂螺[4.4]壬-3-烯-2-酮(4j):白色固体,产率86%,熔点:106~109℃;1H NMR(600 MHz,DMSO-d6)δ:11.14(s,1H),7.94(s,1H),7.59(d,J=2.1 Hz,1H),7.38(dd,J=8.3,2.1 Hz,1H),7.26(d,J=8.3 Hz,1H),2.09~2.03(m,2H),1.82~1.72(m,4H),1.62~1.58(m,2H)。13C NMR(150 MHz,DMSO-d6)δ:173.2,171.0,135.5,134.4,132.6,130.4,128.8,127.0,102.4,67.8,36.7(2C),25.2(2C)。HRMS[ESI+]for C14H13Cl2NO2[(M+H)+],m/z Calcd:298.039 6;Found:298.039 5。
3-(2,4-二氯苯基)-4-羟基-1-氮杂螺[4.5]癸-3-烯-2-酮(4k):白色固体,产率81%,熔点:105~107℃;1H NMR(600 MHz,DMSO-d6)δ:11.05(s,1H),8.17(s,1H),7.59(d,J=1.6 Hz,1H),7.38(dd,J=8.3,1.8 Hz,1H),7.25(d,J=8.3 Hz,1H),1.84~1.79(m,2H),1.67~1.56(m,5H),1.38~1.34(m,2H),1.21~1.15(m,1H)。13C NMR(150 MHz,DMSO-d6)δ:175.2,171.1,135.5,134.5,132.7,130.3,128.8,127.0,101.9,60.5,33.9(2C),25.0,22.1(2C)。HRMS[ESI+]for C15H15Cl2NO2[(M+H)+],m/z Calcd:312.055 3;Found:312.055 1。
3-(2,5-二甲基苯基)-4-羟基-1-氮杂螺[2.4]庚-3-烯-2-酮(4l):白色固体,产率80%,熔点:104~107℃;1H NMR(600 MHz,DMSO-d6)δ:12.31(s,1H),8.54(s,1H),7.01(s,1H),6.99(s,1H),6.91(d,J=7.5 Hz,1H),2.22(s,3H),2.17(s,3H),1.33~1.29(m,2H),0.97~0.93(m,2H)。13C NMR(150 MHz,DMSO-d6)δ:174.3,171.4,135.0,134.7,133.8,131.1,130.0,127.4,110.0,33.1,21.0,19.2,16.8(2C)。HRMS[ESI+]for C14H15NO2[(M+H)+],m/z Calcd:230.117 6;Found:230.117 7。
3-(2,5-二甲基苯基)-4-羟基-1-氮杂螺[4.4]壬-3-烯-2-酮(4m):白色固体,产率85%,熔点:110~113℃;1H NMR(600 MHz,DMSO-d6)δ:12.08(s,1H),8.25(s,1H),7.00(s,1H),6.99(s,1H),6.91(d,J=7.5 Hz,1H),2.22(s,3H),2.17(s,3H),2.06~2.02(m,2H),1.89~1.84(m,2H),1.67~1.63(m,4H)。13C NMR(150 MHz,DMSO-d6)δ:175.67,170.24,135.26,134.63,133.75,131.01,129.94,127.29,99.43,65.39,36.67(2C),24.42(2C),20.98,19.19。HRMS[ESI+]for C16H19NO2[(M+H)+],m/z Calcd:258.148 9;Found:258.148 4。
3-(2,5-二甲基苯基)-4-羟基-1-氮杂螺[4.5]癸-3-烯-2-酮(4n):白色固体,产率82%,熔点:109~111℃;1H NMR(600 MHz,DMSO-d6)δ:12.06(s,1H),7.95(s,1H),7.02(s,1H),6.99(s,1H),6.91(d,J=7.6 Hz,1H),2.22(s,3H),2.19(s,3H),1.90~1.80(m,2H),1.66~1.59(m,5H),1.39~1.30(m,2H),1.22~1.18(m,1H)。13C NMR(150 MHz,DMSO-d6)δ:176.0,170.2,135.4,134.6,133.7,131.1,129.9,127.3,104.9,60.2,32.2(2C),25.5,21.5(2C),21.0,19.2。HRMS[ESI+]for C17H21NO2[(M+H)+],m/z Calcd:272.164 5;Found:272.165 0.
1.2.3 目标化合物5a~5d的合成。在室温条件下,将合成所得的目标化合物4(5 mmol)溶解在盛有40 mL无水CH2Cl2溶液的100 m L茄形瓶中,再依次加入DMAP(0.92 g,7.5 mmol)和EDC·HCl(1.44 g,7.5 mmol),之后向上述混合溶液中滴加2,2-二甲基丁酸(0.87 g,7.5 mmol),反应24 h后用TLC跟踪至原料反应完全,后处理方法同1.2.1。通过柱层析法(EA∶PE=2∶1)分离,得到中间体5a~5d。
3-(2,4-二氯苯基)-4-(2,2-二甲基丁酸酯)-5-乙基吡咯啉-2-酮(5a):白色油状液体,产率74%,沸点:123~126℃;1H NMR(600 MHz,CD3OD)δ:7.54(d,J=1.1 Hz,1H),7.38(dd,J=8.2,1.3 Hz,1H),7.26(d,J=8.2 Hz,1H),4.64~4.57(m,1H),1.93~1.88(m,1H),1.68~1.63(m,1H),1.59~1.54(m,2H),1.17(s,3H),1.14(s,3H),0.98(t,J=7.4 Hz,3H),0.73(t,J=7.4 Hz,3H)。13C NMR(150 MHz,CD3OD)δ:173.3,171.0,164.3,134.8,134.5,132.4,128.8,128.4,126.7,118.7,57.4,43.0,32.6,23.5,23.5,23.3,12.6,7.9。HRMS[ESI+]for C18H21Cl2NO3[(M+H)+],m/z Calcd:370.097 1;Found:370.097 3。
3-(2,4-二氯苯基)-4-(2,2-二甲基丁酸酯)-5-异丙基吡咯啉-2-酮(5b):白色固体,产率72%,熔点:118~121℃;1H NMR(600 MHz,DMSO-d6)δ:8.47(s,1H),7.67(d,J=1.9 Hz,1H),7.46(dd,J=8.4,2.0 Hz,1H),7.25(d,J=8.3 Hz,1H),4.41~4.35(m,1H),2.04~1.96(m,1H),1.52~1.45(m,2H),1.10(s,3H),1.07(s,3H),1.03(d,J=6.9 Hz,3H),0.81(d,J=6.4 Hz,3H),0.62(t,J=7.4 Hz,3H)。13C NMR(150 MHz,DMSO-d6)δ:173.3,169.7,162.9,134.3,134.1,133.2,129.1,128.4,127.5,119.9,61.2,43.2,32.8,29.3,24.6,24.3,19.9,15.6,9.1。HRMS[ESI+]for C19H23Cl2NO3[(M+H)+],m/z Calcd:384.112 8;Found:384.112 4。
3-(2,4-二氯苯基)-4-(2,2-二甲基丁酸酯)-5-丙基吡咯啉-2-酮(5c):无色油状液体,产率75%,沸点:125~127℃;1H NMR(600 MHz,DMSO-d6)δ:8.54(s,1H),7.67(d,J=1.9 Hz,1H),7.46(dd,J=8.3,2.0 Hz,1H),7.26(d,J=8.3 Hz,1H),4.52~4.42(m,1H),1.72~1.66(m,1H),1.52~1.47(m,2H),1.44~1.32(m,3H),1.11(s,3H),1.08(s,3H),0.90(t,J=7.2 Hz,3H),0.65(t,J=7.4 Hz,3H)。13C NMR(150 MHz,DMSO-d6)δ:173.4,169.2,163.7,134.3,134.1,133.3,129.1,128.3,127.5,119.1,55.9,43.2,33.6,32.8,24.6,24.4,17.9,14.2,9.1。HRMS[ESI+]for C19H23Cl2NO3[(M+H)+],m/z Calcd:384.112 8;Found:384.113 2。
3-(2,4-二氯苯基)-4-(2,2-二甲基丁酸酯)-5-异丁基吡咯啉-2-酮(5d):白色固体,产率70%,熔点:116~119℃;1H NMR(600 MHz,DMSO-d6)δ:8.64(s,1H),7.68(d,J=1.9 Hz,1H),7.47(dd,J=8.3,1.9 Hz,1H),7.26(d,J=8.3 Hz,1H),4.56~4.38(m,1H),1.86~1.78(m,1H),1.52~1.48(m,2H),1.38~1.33(m,1H),1.11(s,3H),1.08(s,3H),0.92(s,3H),0.91(s,3H),0.65(t,J=7.4 Hz,3H)。13C NMR(150 MHz,DMSO-d6)δ:173.4,169.1,164.3,134.3,134.2,133.2,129.1,128.3,127.5,118.9,54.8,43.2,41.4,32.7,24.9,24.6,24.4,24.0,22.2,9.1。HRMS[ESI+]for C20H25Cl2NO3[(M+H)+],m/z Calcd:398.128 4;Found:398.128 1。
1.3 除草活性测定
1.3.1 供试杂草与试验依据。供试杂草:马齿苋(Portulaca oleracea L)、反枝苋(Amaranthus retroflexus L)、稗草(Echinochloa crus-galli(L.)Beauv)、油菜(Brassica napus L)和马唐(Digitaria sanguinalis(L.)Scop),均由安徽农业大学植物保护学院植物病理学教研室提供。试验依据:《中华人民共和国农业行业标准》(NY/T 1155.4-2011)——农药室内生物测定试验准则 除草剂 第4部分:活性测定试验 茎叶喷雾法。
1.3.2 处理方法与调查统计。在塑料盆中先装入约4/5的健康土壤(取自安徽农业大学农萃园),方法为盆钵底部渗灌,待土壤完全湿润后将预处理完的供试杂草种子(油菜、苋菜、稗草和马唐)各20粒均匀撒播于土壤表面,根据种子大小覆土0.5~2.0 cm,播种后移入温室常规培养并适量补水至饱和状态,杂草出苗后进行间苗定株,保证杂草的密度一致。药剂筛选剂量设定为40 g·hm-2,试验设空白对照和溶剂对照,将配置好的药液进行茎叶喷雾,每个处理设3次重复。当杂草幼苗长到2叶期,测定每盆植株鲜重,计算鲜重抑制率η,计算方法如下,结果使用Excel等软件进行数据处理与计算。

2 结果与讨论
2.1 化合物的合成
本实验以氨基酸甲酯盐酸盐为起始原料,与取代苯乙酸在EDC·HCl/DMAP的作用下进行酰胺缩合得到中间体3a~3n,根据Dieckmann酯缩合成环机理进行关环反应,使用新制备的甲醇钠并保证反应体系无水,在其提供的碱性环境下,分子内成环形成对应的钠盐,后经过盐酸酸化得到目标化合物4a~4n,最后与2,2-二甲基丁酸发生酯化反应得到目标化合物5a~5d。结构均通过1H NMR、13C NMR、DEPT、HSQC和HRMS得到确证。
解析以化合物5d为例:在1H NMR中共有14组吸收峰,对应25个氢原子。低场区,δ:8.64(s,1H)为胺基上的一个活泼氢原子出峰;δ:7.68(d,J=1.9 Hz,1H)为苯环上相连两个氯原子之间的次甲基出峰,δ:7.47(dd,J=8.3,1.9 Hz,1H)和δ:7.26(d,J=8.3,1H)分别为苯环上距离乙酰基较远和较近的次甲基出峰。高场区,δ:4.56~4.38(m,1H)为母体结构连接脂肪支链的次甲基出峰,δ:1.86~1.78(m,1H)为支链上的次甲基出峰,δ:1.47~1.43(m,1H)和δ:1.38~1.33(m,1H)由支链上的亚甲基裂分而成,δ:0.92(s,3H)和δ:0.91(s,3H)为支链上的两个甲基出峰;δ:1.52~1.48(m,1H)为酯基部分的亚甲基出峰,δ:0.65(t,J=7.4,3H)为酯基部分最远端的甲基出峰,δ:1.11(s,3H)和δ:1.08(s,3H)为中间的两个甲基出峰。
13C NMR中准确的给出了20组吸收峰,对应20个碳原子。DEPT(135°)中出现12组吸收峰,2组仲碳的负吸收峰,5组伯碳和5组叔碳的正吸收峰。在HSQC中给出了该结构中直接相连的碳氢关系,具体数据见表1。高分辨质谱分析中,5d分子式C20H25Cl2NO3([M+H]+)理论分子质量为398.128 4,实测值为398.128 1,综合以上谱图可以确证其分子结构。
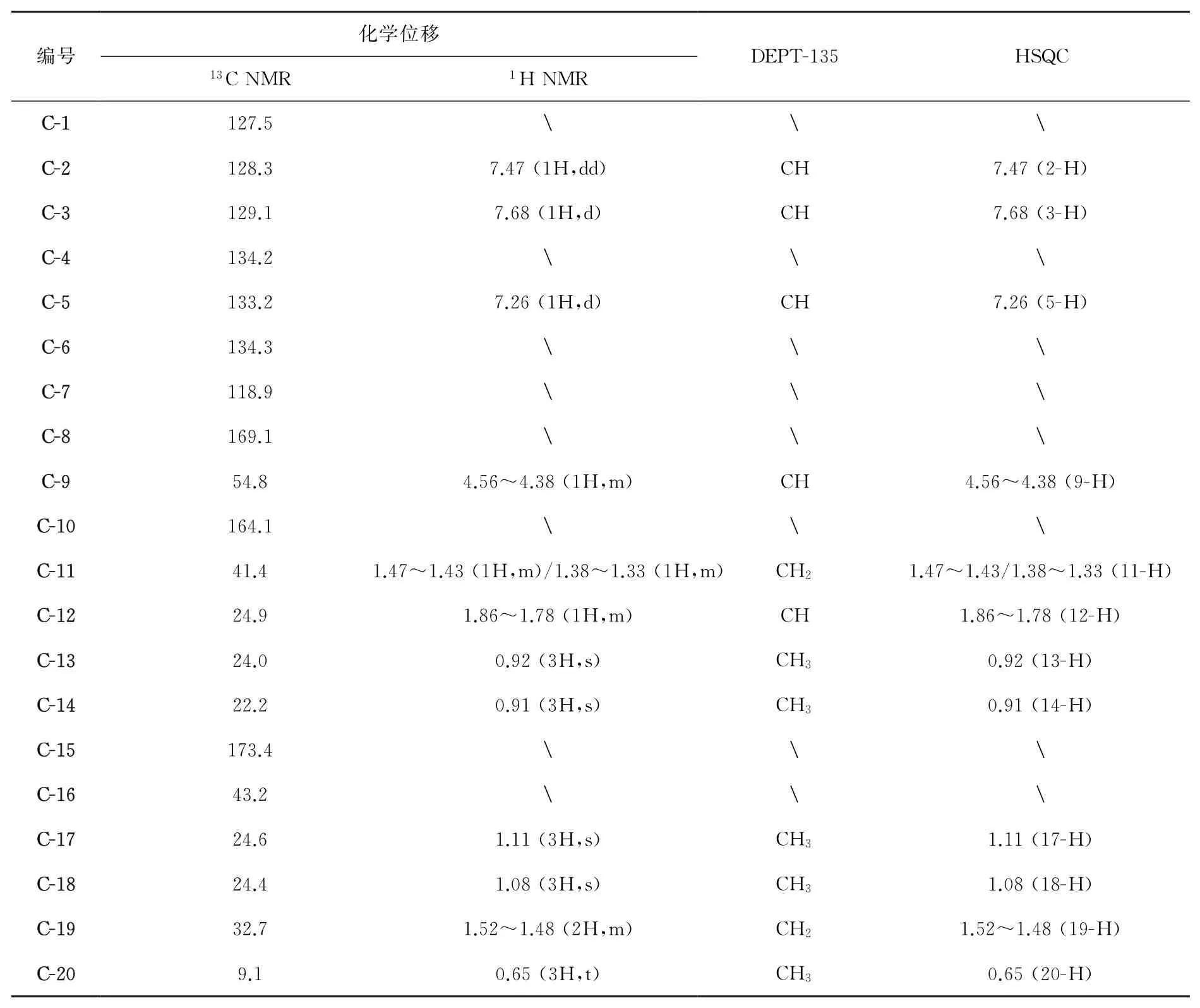
表1 目标化合物5d的1 H NMR、13 C NMR、DEPT和HSQC具体数据
2.2 除草活性测定
在100 g·hm-2有效施药剂量下,大部分化合物对稗草和马唐有明显活性,对油菜和苋菜无明显活性。4b、4c、4d、4h、4j和4k对马唐的鲜重抑制率均为100%,高于天然产物TeA(0.71%),与阳性对照药硝磺草酮(100%)相当;对稗草的鲜重抑制率分别为93.3%、89.0%、91.3%、92.2%、87.4%和75.6%,高于天然产物TeA(1.86%)。4d对苋菜的鲜重抑制率为57.2%,4k对油菜的鲜重抑制率为64.2%。
初步构效关系表明,当特胺酸骨架化合物的3位为2,4-二氯苯基、5位为甲基、乙基、异丙基、环丙基、环戊基和环己基时,除草活性较强;3位为2,5-二甲基苯基时,无明显除草活性;4位引入酯基后活性消失。
3 结论
本文运用共活性药效团策略,以天然产物TeA为先导化合物,以不同结构的氨基酸甲酯盐酸盐为起始原料,经酰胺缩合、Dieckmann分子内成环和酯化反应,合成了18个新型3-苯基特胺酸类衍生物,通过1H NMR、13C NMR、DEPT、HSQC和HRMS等结构表征对目标化合物进行确证,并对其除草活性进行了初步研究。结果表明大部分化合物对稗草和马唐有较强活性,其中4b、4c、4d、4h、4j和4k对马唐的鲜重抑制率均为100%,高于天然产物TeA(0.710%),与阳性对照药硝磺草酮(100%)相当;对稗草的鲜重抑制率分别为93.3%、89.0%、91.3%、92.2%、87.4%和75.6%,高于天然产物TeA(1.86%),有作为先导化合物的潜力和研究价值。初步构效关系表明,当特胺酸骨架化合物的3位为2,4-二氯苯基、5位为甲基、乙基、异丙基、环丙基、环戊基和环己基时,除草活性较强;3位为2,5-二甲基苯基时,无明显除草活性;4位引入酯基后活性消失。
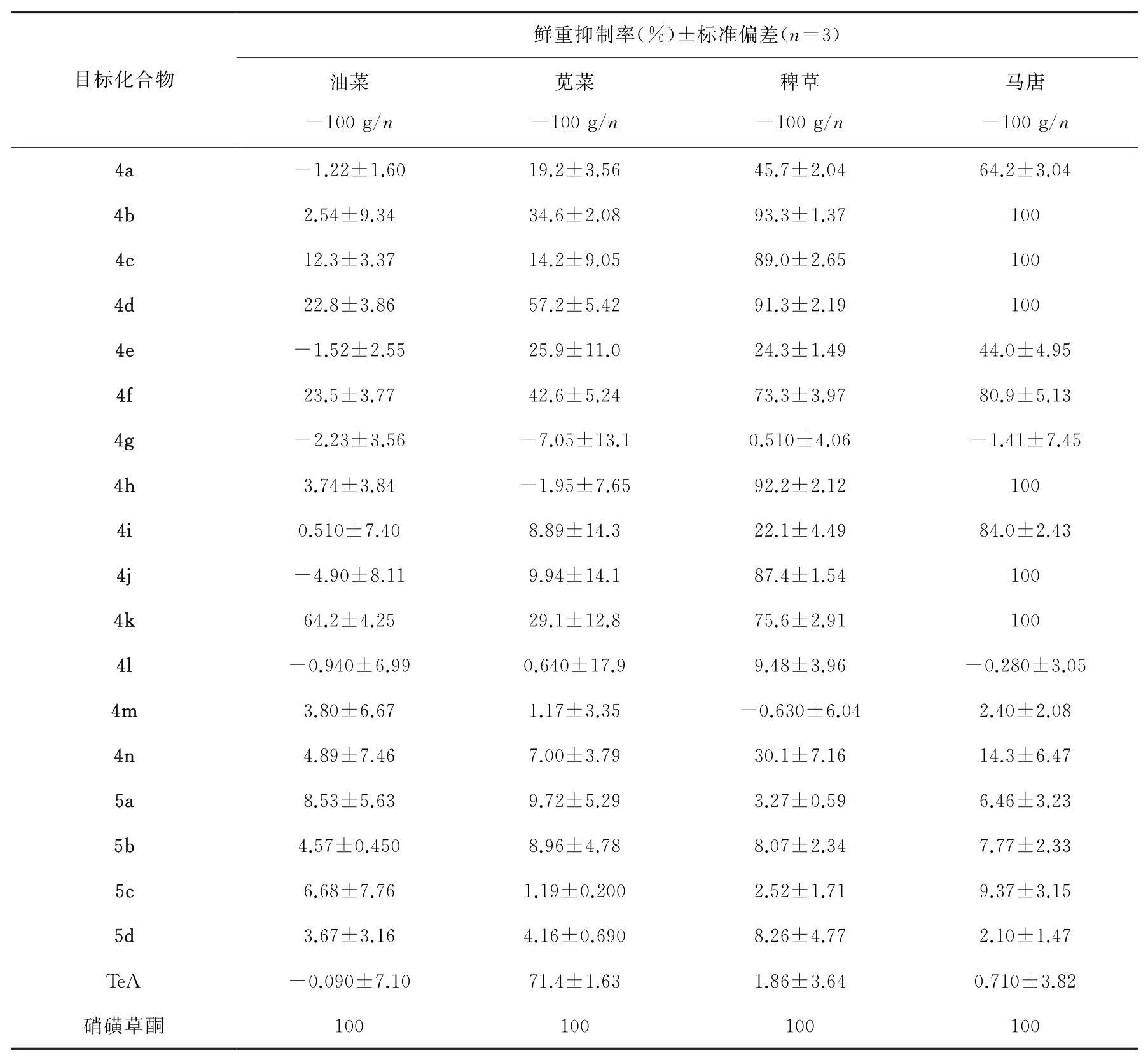
表2 目标化合物室内盆栽除草药效测定结果

