三种发酵剂发酵猪粪优势菌种筛选及除臭试验研究
易诚,刘永鑫,龙九妹,邓景衡
(衡阳师范学院 生命科学与环境学院,湖南 衡阳 421001)
我国是一个畜牧大国,畜牧生产的清洁化在生产环节中至关重要,加强畜禽粪便清洁化生产,可以保护生态环境,增强资源化利用效率[1]。因此,畜禽养殖的粪便资源化尤为重要,畜禽粪便的资源化可以使之成为农业生产中的有机肥料,使农作物产量得到提高。有机肥还具有易于被植物吸收的特点,而化学肥料,容易对土壤造成破坏,长期使用化学肥料还会使得土壤肥力下降,改变土壤原本的有机构成[2-5]。目前,许多大型畜禽养殖场没有合理的处理粪便,这些未经处理的畜禽粪便会产生恶臭气体,还会携带有大量的病菌,间接的污染当地的环境,对人体造成危害[6]。
目前畜禽养殖的粪便普遍的处理方法是自然堆肥。自然堆肥虽然可以利用高温杀死病菌和寄生虫,但存在堆肥时间长和产生臭气等问题。在畜禽粪便堆肥发酵中加入菌肥发酵剂可以解决堆肥时间长和堆肥温度高的难题,但堆肥臭气的处理仍是目前研究的重点[7-8]。
复合微生物菌剂可以缩短发酵时间,彻底分解有机质,在堆肥发酵过程中可以杀死细菌和寄生虫卵,提高肥效。更重要的是生物菌剂含有多种微生物,可以大大改善发酵堆肥的微生物生态环境,并筛选出高效除臭的优势菌种。日本曾首次研发出的EM菌包含多种菌种,是放线菌、乳酸菌、酵母菌等80多种微生物混合生物菌剂[9]。EM微生物复合发酵剂原本是土壤中辅助剂,通过一代代的改良,应用到更加广阔的领域,包含畜牧、养殖业和除臭等[10]。刘益仁等人通过控制变量法,研究是否加入复合微生物菌剂对堆肥发酵等各方面影响,结果表明接种微生物发酵剂具有缩短发酵时长和保持高温期时长等优势[11]。徐同宝等人分离出解脂耶罗威亚酵母菌、嗜热脂肪芽孢杆菌、地霉菌、奴卡菌和凝结芽孢杆菌5株,将这些单株菌剂各自复合,分成15个不同组合进行正交试验,以此试验不同发酵剂菌种复合后的实际效果[12]。
微生物除臭法具有环保、可再生、高效等优点,越来越被广泛用于畜禽养殖除臭方面,市场前景广阔[13-15]。微生物除臭法的原理主要有两种,一是微生物能够吸收分解臭气,二是微生物可以抑制发酵过程臭气产生[16]。廖新悌[17]等人的研究结果表明,在动物饲料中加入少量复合菌剂,可以使猪舍的臭气降低。叶芬霞等人[18]将热带假丝酵母、巨大芽孢杆菌和灰色链霉菌按照一定配比制作成生物除臭剂,试验结果表明,堆肥5 d后的氨气(NH3)的浓度降解率达到了84.39%。柴来云等人[19]用粉红掷孢酵母、植物乳杆菌、细黄链霉菌按照不同的质量比制成生物除臭剂,对养猪场进行无害化处理,NH3的去除率最高可达到81.98%。刘婕等人[20]将乙酰氧肟酸、啤酒酵母、枯草芽孢杆菌和地衣芽孢杆菌进行复配添加到猪饲料中,发现添加量为0.15%的复合剂能显著降低猪舍内NH3的浓度。
目前,除臭优势菌种的筛选是国内外的主要研究方向,但国内选育的微生物除臭菌剂还不是很常见。因此,本试验从三种发酵剂发酵新鲜猪粪中筛选出具有除臭功能的微生物,通过筛选和纯化,筛选出具有高效除臭功能的菌株,为养猪场生物除臭提供依据。
1 材料与方法
1.1 试验材料
1.1.1 堆肥材料
试验使用的新鲜猪粪来自于湖南省衡阳市本地,锯木屑产自湖南省邵阳市,将锯木屑与新鲜猪粪一定比例混合可以调节猪粪含水率。红糖用于活化发酵剂。水壶、木铲,塑料桶用于新鲜猪粪的搅拌混合。
1.1.2 培养基配制
(1)纯化分离培养基:牛肉膏5 g,蛋白胨10 g,氯化钠5 g,琼脂20 g,800 mL纯净水和1 mol/L的盐酸和氢氧化钠溶液。
大烧杯中装约800 mL纯净水,置于加热炉上加热,分别称取牛肉膏5 g,蛋白胨10 g,氯化钠5 g,琼脂20 g,依次加入试剂,确保第一种试剂完全溶解方加入第二种试剂,至加入琼脂完全溶解,整个溶解过程在加热和不断搅拌的过程中完成。
(2)NH3选择培养基:蔗糖50.0 g,氨水10.0 mL,KH2PO42.0 g,MgSO40.5 g,FeSO40.1 g,1%ZnSO45.0 mL,纯净水3 000 mL。
在大烧杯中加入3 000 mL纯净水,依次称取蔗糖50.0 g,KH2PO42.0 g,MgSO40.5 g,FeSO40.1 g,1%浓度ZnSO45.0 mL加入其中,使用玻璃棒搅拌至全部溶解,然后装入24个150 mL锥形瓶中,使用棉花塞和报纸包裹后,在121 ℃高压蒸汽灭菌20 min,然后在超净工作台中加入浓氨水各1.25 mL配置成NH3液体选择培养基。
1.1.3 主要仪器
SKY8000-M4便携式四合一气体检测仪(深圳元特)、恒温发酵罐(上海恒跃医疗器械有限公司)、恒温水浴摇床(莱普特科学仪器有限公司)、水分检测仪(深圳冠亚电子科技有限公司)、高压灭菌锅(上海东亚压力容器制造有限公司)。
1.2 试验方法
1.2.1 发酵试验
(1)使用恒温发酵桶容器承装猪粪,每个发酵罐各自称量4千克的新鲜猪粪。通过使用湿度检测仪器测量新鲜猪粪的含水率,设置试验猪粪含水率为50%,在新鲜猪粪中加入锯木屑调节含水率,可以使用下列公式(1)和(2)进行计算锯木屑的用量。
(1)
x=2m1-3m2
(2)
公式中,ω1为新鲜猪粪含水率,m1位称取猪粪质量,m2为猪粪干重,联立以上两公式,可以求得X为木屑的添加量。按照算出的结果,在猪粪中加入相应的锯木屑后混合均匀。
(2)复合发酵剂的活化:称取5 g复合发酵剂(农富康发酵剂,强兴发酵剂和农保有机肥发酵剂)、20 g红糖和100 mL蒸馏水放置在广口三角瓶中,摇晃混合均匀,进行活化(使用时,先与猪粪混合后,测量其含水率,然后加入适量木屑调节含水率)。
(3)好氧堆肥发酵:首先使用恒温发酵罐进行好氧堆肥,通过终端控制器保持发酵罐温度保持在30 ℃。通过供氧泵供氧,并调节流量剂为0.4 L/min。监测发酵管内堆肥发酵温度和罐底水温,并记录数据。堆肥发酵预计进行10 d左右。并设置空白对照组,对比加入三种发酵剂对发酵的影响。
1.2.2 菌株的初筛
分别选取升温阶段和发酵完成阶段,进行取样。在两个不同时间段的加入不同发酵剂的堆肥发酵罐中,分别每个阶段取3份发酵罐内的固液混合物10 g,加到3个容量为250 mL三角瓶中,其中含有80 mL灭菌的纯水。每个实验组一共接种6个选择培养基,3个为发热阶段取样,3个为发酵完成阶段取样。
在30 ℃、180 r/min的恒温震荡培养箱震荡30 min,随后静置20 min。然后在超净工作台中,取上清液10 mL,各自接种到配置好的NH3选择培养基中,使用棉花塞好瓶口。并对18个选择培养基进行编号。然后放在30 ℃、180 r/min摇床上培养5 d后观察菌液的变化,若菌液变浑浊,这说明该菌株具有降解臭气能力。
1.2.3 菌株的分离纯化
观察18个选择培养基的浑浊程度,提取变浑浊的NH3选择培养基中培养液1 mL,经过无菌水的梯度稀释后,取10-3、10-4、10-5的稀释液,分别在分离纯化培养基中,用平板划线法接种。将接种后的培养皿放置在30 ℃的恒温培养箱内培养24~72 h,24 h后开始观察菌的生长情况。选取生长快、菌落大、数量多的菌进行纯化,经过多次分离纯化后,将单一的菌株在显微镜下根据形态特征及生化性质,鉴别并编号,并进行斜面保存。
1.2.4 除臭试验
将分离纯化好的菌株,使用牛肉膏蛋白胨液体培养基,在恒温摇床中培养24 h。待完成培养完成后,取新鲜猪粪,加入活化好的发酵剂和锯木屑,调剂含水率为50%后,分别接种10%的除臭菌株,使其菌株与猪粪混合充分。将混合后的菌株分别放入恒温堆肥发酵罐内,保持温度在30 ℃,设置智能温控器的上限温度为33 ℃、下限温度为28 ℃对堆肥体进行控温,保持温度在30 ℃。供氧0.4 L/min,并设置高清录像系统对准桶盖上的温度显示仪,实时记录发酵温度数据。
试验的变量预计分组为自然发酵为一组、加了农富康发酵剂的为一组、接种了除臭菌为一组,复合除臭菌分成一组,分组进行发酵试验,使用便携式四合一气体检测仪每天检测,直到最终发酵阶段完成,氨气和臭气浓度(Odor)没有较大变化后可结束检测。

Odor去除率的计算参照此公式。
1.2.5 复合菌种发酵培养影响试验
(1)原料含水率对发酵的影响。新鲜猪粪中含有水合有机物,不同的菌种适宜生存的含水率不同,会影响发酵除臭效果。本次试验设置30%、40%、50%、60%、70%含水率进行发酵实验,以测定臭气浓度,得出最佳的原料含水率。
(2)接种量对发酵的影响。不同的菌种接种量会影响堆肥发酵的除臭效果,若接种量过少,则可能造成发酵不完全,发酵时间延长,而过多则会造成材料浪费。本试验采用单一变量法,以菌种接种量分别为4%、8%、12%、16%、20%加入至堆肥发酵罐内,发酵完成后,测定臭气浓度,得到最佳接种量。
(3)温度对发酵的影响。将发酵温度分别置于20、24、28、32、36 ℃的条件下,在最佳接种量,得出最佳发酵温度。
2 结果与分析
2.1 发酵试验结果
使用水分检测仪量出新鲜猪粪含水率为60%,锯木屑的含水率为2%。通过公式计算可得,加入2 kg猪粪,需要加入250 g左右的锯木屑调节含水率,最终可以得到含水率为50%的发酵堆肥的原料。
通过试验设置一组为不加复合发酵剂的空白对照组,另外分成农富康发酵试验组、强兴堆肥发酵剂试验组和农保有机肥发酵剂试验组。发酵罐温度控制在28 ℃~33 ℃之间发酵,实时监控发酵温度,记录发酵温度变化可得以下结果。
发酵试验结果如图1所示,空白组的发酵时长较长,在堆肥后6 d前后时温度才大于50 ℃进入高温阶段,由于温控发酵罐设置水温为30 ℃,因此试验发酵前期升温速度升温较快,直至温度升高到35 ℃后,堆体温度缓慢升高。当堆肥进行第7天,空白组堆肥体温度达到整个发酵阶段的最高温59.1 ℃,然后又开始降温,24 h左右温度就下降到了50 ℃,随后温度一直下降直到整个发酵过程结束。在未加入堆肥发酵剂发酵的整个过程中,高温阶段维持了48 h左右。
而加入了农富康发酵剂后的猪粪的堆肥发酵的时长明显缩短,在堆肥后的3 d左右温度就升高到了50 ℃,正式进入高温阶段,在发酵后的第4天左右,温度升高到最高温65.7 ℃,随后温度又开始慢慢下降,直至发酵后的第6天左右,温度下降至50 ℃左右结束了高温阶段,随后,随着发酵的结束,温度回到了保温桶设置的30 ℃左右;强兴菌肥发酵剂后的猪粪的堆肥,在第5天左右温度到了50 ℃进入高温阶段,在发酵后的第6天左右,温度升高到最高温61.7 ℃;农保有机肥发酵剂后的猪粪的堆肥第5天达到最高温度59.1 ℃。
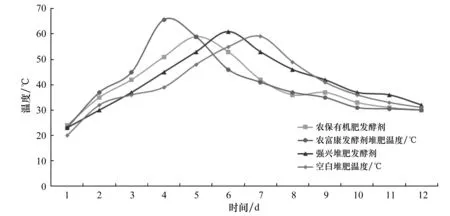
图1 堆肥发酵温度变化Figure 1 Temperature variation of compost fermentation
从上数据我们可以看出,加入了复合发酵剂的堆肥高温期要比空白发酵组提前,在高温期的峰值也要高。这说明了复合发酵剂可以有效的减少发酵时长,其中加入了农富康发酵剂的升温最快。而且在堆肥发酵过程中,由于复合发酵剂含有大量的各种菌株,这些菌种会在发酵过程中快速繁殖,分解堆肥过程中的有机质,并使堆肥温度上升迅速,也对后续菌株筛选提供优秀的生态环境。
从试验结果来看,复合发酵剂因为有着丰富的微生物,可以促进发酵进程,加速有机质的分解速度,从而促进发酵。在本试验中,可以发现,加入农富康菌肥发酵剂可以提高升温的速度,使其堆肥温度高温阶段的最高温更高,还可以使其缩短发酵时间,也有助于后续筛菌的进行;复合发酵剂中富含丰富菌种,也可以改变猪粪中微生物的生态环境,有助于筛选出目的菌种。
2.2 菌株分离纯化结果
2.2.1 菌株分离、纯化
将加入了复合发酵剂的发酵罐,在监控温度时,选取发热阶段和发酵完全阶段。取4份固液混合物,在发酵完成后取四份固液混合物,每份10 g。取的固液混合物加到容量为250 mL三角瓶中,其中含有80 mL灭菌的纯水。震荡沉淀后取其上清液接种至NH3选择培养基中恒温30 ℃培养。
在培养至5 d时,可以看到有变培养液变浑浊,因此可以判断出该选择培养基中含有可以分解NH3的菌。选取变浑浊的选择培养基,在超净工作台上,取其培养液,经过蒸馏水稀释后,在使用牛肉膏蛋白胨培养基使用平板划线法分离纯化,从分离纯化培养基中观察其菌落,发现有三种不同形态的菌落。分别命名为nf5、nb11和qx18(见表1)。
2.2.2 菌种鉴定
细菌的鉴别:nf5革兰氏染色为阳性,为革兰氏阳性细菌。挑选出nf5菌株,接种到培养基上培养24 h,待长出单菌落观察其菌落特征,在光学显微镜下观察其观察菌体形状、排列方式等个体特征。nf5其菌落直径约为1.5~2.5 mm,光滑,湿润,乳白色,在显微镜下其菌体形态为杆状,两端平,多成链出现。并进行生化试验,过氧化氢酶测定,运动性检查,明胶液化和,吲哚实验,根据菌种鉴定手册,确定nf5为乳酸杆菌科。
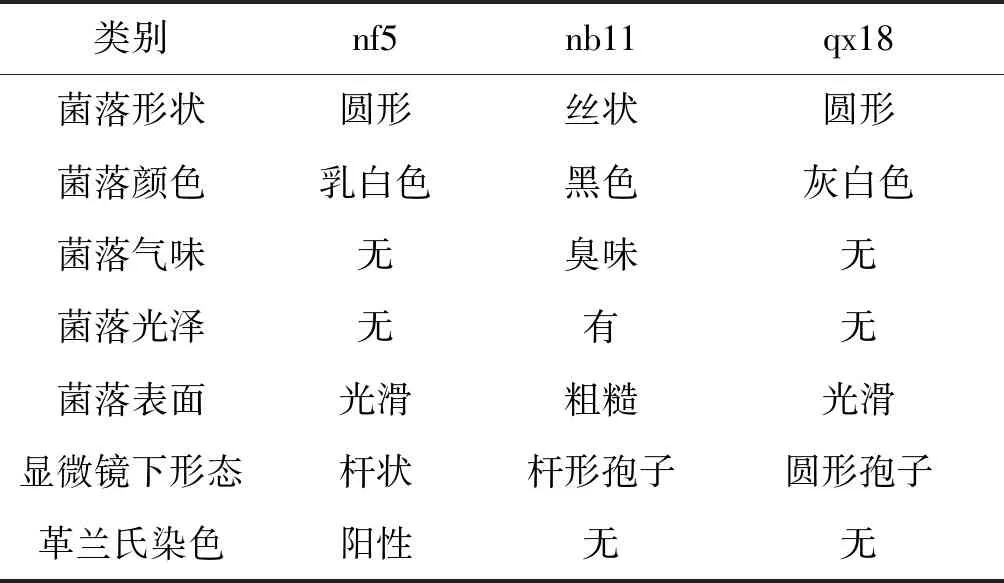
表1 菌落的个体形态及生理生化特征Table 1 Individual morphology and physiological and biochemical characteristics of strains
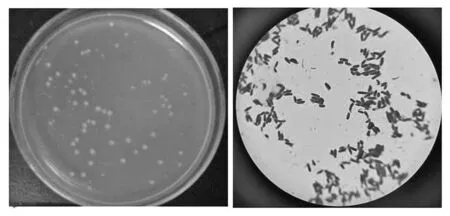
图2 乳酸杆菌Figure 2 lactobacillus
真菌的鉴别:根据革兰氏染色和菌落的形态,初步判定nb11和qx18为真菌。采用平板点植法,将接种环蘸取少许无菌水,在斜面培养基中挑取少量菌丝或孢子于改良马丁培养基上,倒置培养皿于30 ℃恒温培养箱中培养3~5 d,观察菌落生长形态,并用显微镜观察菌丝和孢子。
nb11培养基基质上有分生孢子梗向外伸出,菌落较厚且表面较为不平整,在分生孢子梗顶部有成串的黑褐色球状分生孢子。在培养过程中,菌落生长迅速并向四周蔓延,在刚开始呈现为白色,随着菌落的不断生长,颜色逐渐变成亮黄色最终转变为黑色。观察培养基背面发现中央带有轻微的黄褐色或者呈现无色。通过显微镜观察发现分生孢子头成黑褐色放射状。结合菌种鉴定手册,确定nb11为曲霉科。
qx18培养基基质上有分生孢子梗向外伸出,菌落灰白色,表面光滑,呈小米粒状。在培养过程中,菌落开始为酵母样薄膜生长,随后在中央出现细毛刺样菌丝,后乳白色菌丝覆盖,背面呈淡棕色。通过显微镜观察有较多的大小不等圆形和卵圆形孢子。结合菌种鉴定手册,可以确定qx18为酵母菌科。

图3 曲霉Figure 3 Aspergillum
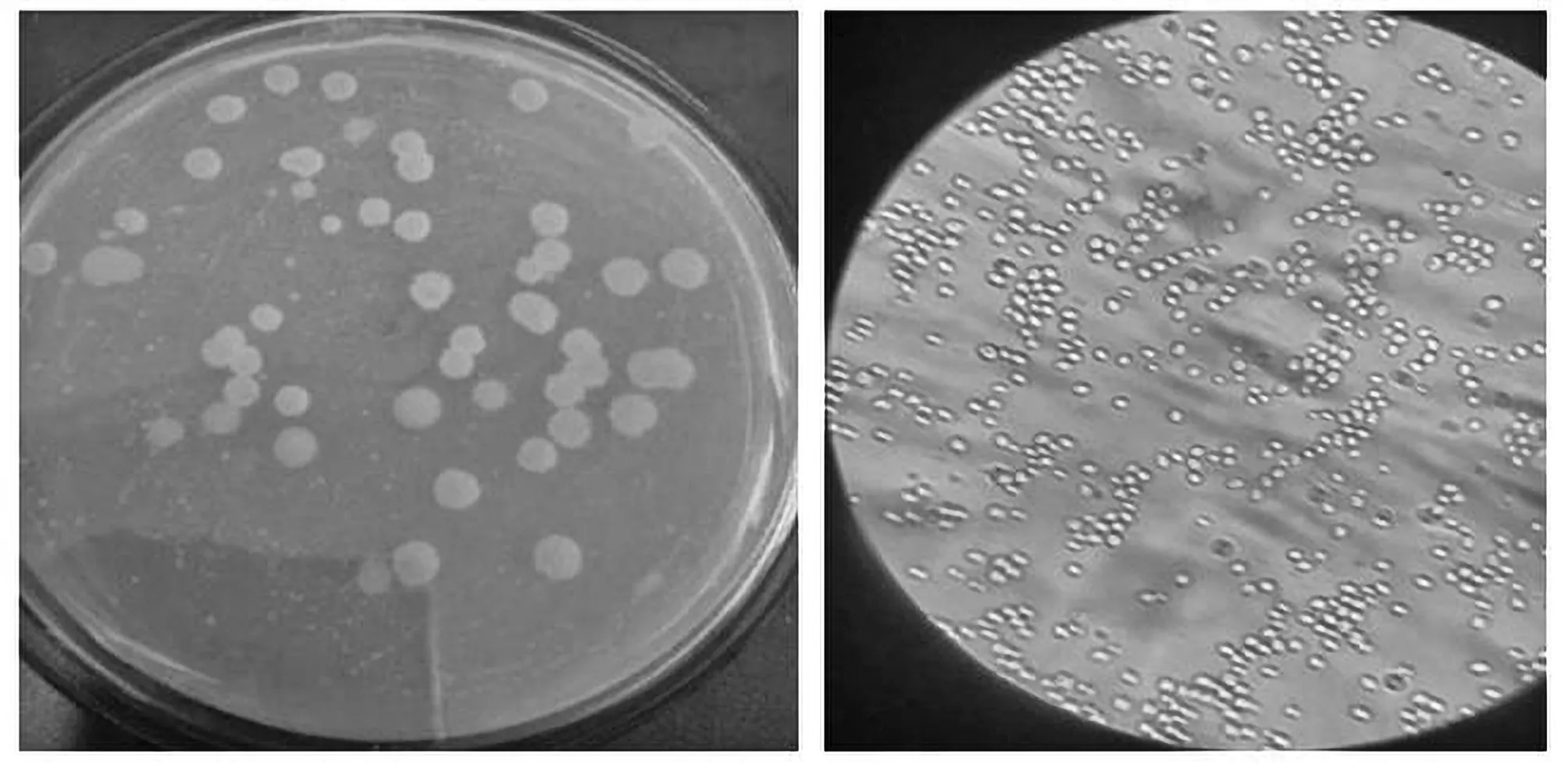
图4 酵母菌Figure 4 Yeast
2.3 除臭试验结果
2.3.1 臭气浓度变化
本次试验共分为四个组,分别是nf5单菌,nb11单菌,qx18单菌和空白试验组。通过气体检测仪检测结果如图5所示。
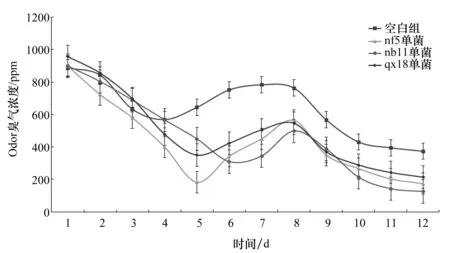
图5 臭气浓度变化Figure 5 Changes in Odor Concentration
由图5可见,在堆肥发酵过程中,各个试验组的开始发酵的臭气的浓度最高,约为900 ppm左右。臭气的产生量会随着发酵的进行,浓度开始下降,当下降到一定程度时,Odor臭气浓度会缓慢回升,最后又会下降。而空白组臭气浓度在各个时间都是最高值,在第4天达到第一个低点为,然后随着发酵的进行,臭气浓度继续上升,在第7天达到最高值,随后臭气浓度继续下降。
从发酵开始直至结束,试验组每天平均Odor为:空白组636.9 ppm,nf5单菌组427.9 ppm,nb11单菌组453 ppm,qx18单菌组494 ppm。表明单菌组对降低发酵产生臭气具有一定的抑制作用。
单株菌种就具有一定的降低臭气浓度的效果,在发酵的前5d中,接种nf5菌株的试验组臭气浓度最低。在发酵6~8 d时,接种了nb11的菌株臭气浓度最低。在发酵完成阶段,接种了qx18的菌株臭气浓度最低。出现这种情况的原因可能是由于该种菌株此时为优势菌种,对臭气降解起着重要的效果。
2.3.2 氨气浓度变化
在好氧堆肥过程中,氨气的产生量在达到一个峰值时,随后会缓慢下降,与发酵的阶段相对应可以表明在发热阶段,由于微生物的快速繁殖生长,使得氨气产生浓度逐渐上升,随着发酵的完全,氨气的产生浓度逐渐降低(如图6所示)。
在堆肥发酵开始的1~4 d,接种了除臭菌株的实验组和空白组的氨气释放浓度没有很大差别,都是随着发酵时间增长,此时接种了nf5菌种的试验组氨气浓度增长速度比空白组要高,在第4天接种nf5试验组氨气浓度达到最高值,空白组第5天才达到了最高值。
在堆肥发酵4 d后,三组试验组氨气浓度都有快速下降,接种了nf5菌株的试验组此时氨气浓度下降最快,在发酵完成时,它的氨气浓度含量最低。接种了nb11和qx18菌株的试验组,全过程氨气释放浓度都低于空白组,在1~8 d氨气浓度也低于接种了nf5菌株的试验组。
在发酵至结束时,各个试验组的平均氨气浓度为:空白组19.6 ppm,nf5单菌组15.1 ppm,nb11单菌组14.5 ppm,qx18单菌组13.4 ppm。从平均氨气浓度可以直观的得出接种了除臭菌株的试验组的氨气浓度要比空白组低,除臭菌株具有降低氨气浓度效果。
2.3.3 硫化氢浓度变化
硫化氢浓度变化也是随着发酵的进行,先升高后下降。空白组的硫化氢浓度在1~6 d都是最高,在第6天后空白组硫化氢浓度低于接种了nf5实验组。在发酵完成后,qx18试验组的硫化氢浓度最低(如图7所示)。
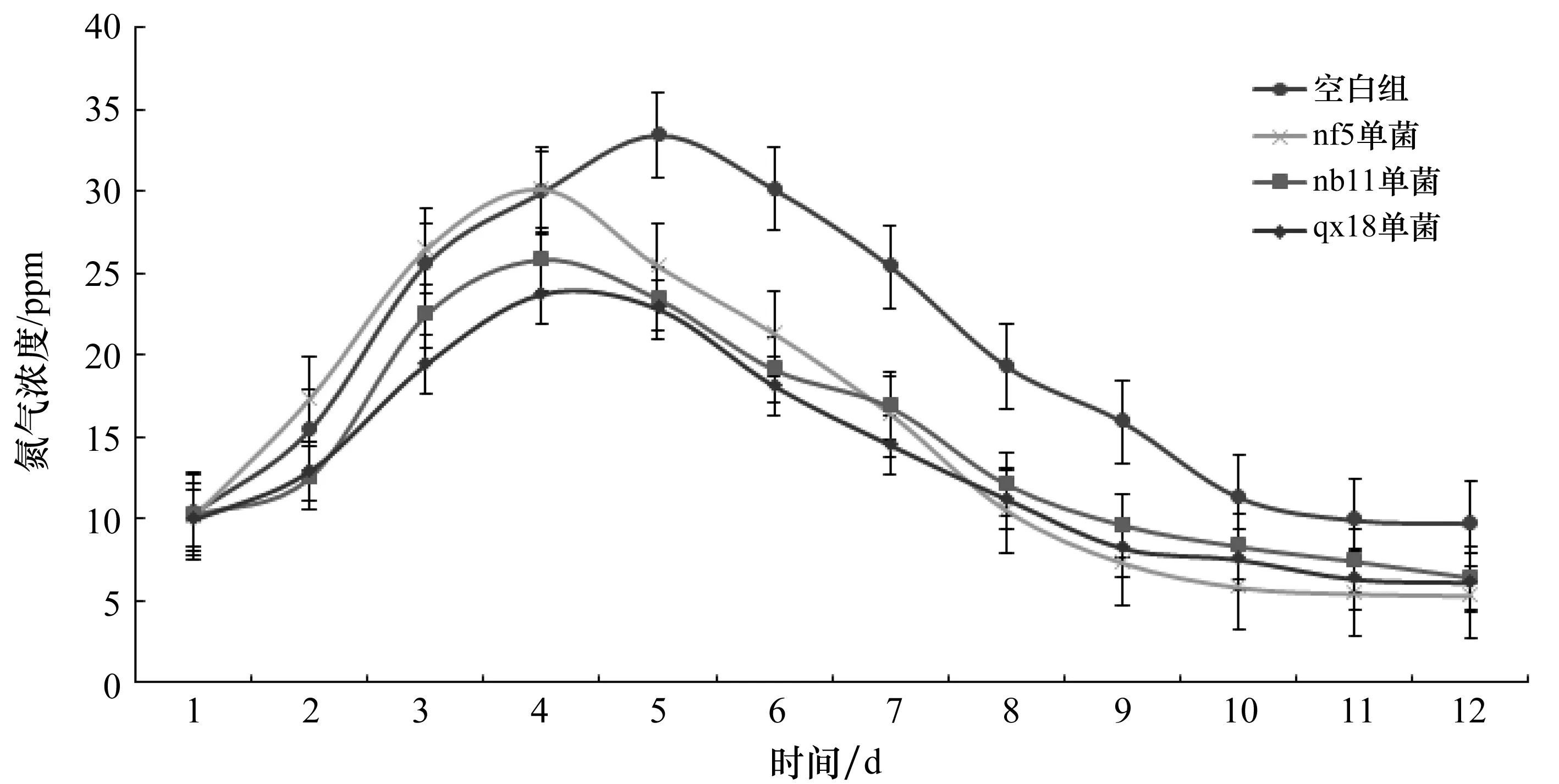
图6 氨气浓度变化Figure 6 Changes in ammonia concentration
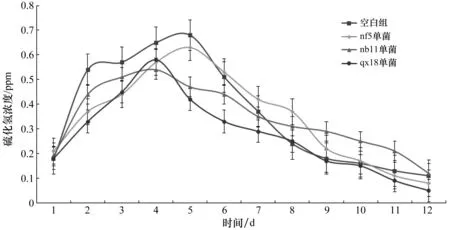
图7 硫化氢浓度变化Figure 7 Changes in hydrogen sulfide concentration
在发酵至结束时,各个试验组的平均硫化氢浓度为:空白组0.36 ppm,nf5单菌组0.34 ppm,nb11单菌组0.33 ppm,qx18单菌组0.27 ppm,可以得出接种菌种对硫化氢浓度也具有一定的抑制作用。
2.3.4 氨气、硫化氢和臭气浓度的去除率效果
以空白组作为参照组,计算接种了bf5单菌、nb11单菌和qx18单菌后的试验组的去除率。通过公式计算可以的得出,nf5试验组的氨气去除率为45.36%,硫化氢去除率为27.27%,臭气去除率为53.47%。nb11试验组的氨气去除率为34.02%,硫化氢去除率为-9.1%,臭气去除率为66.31%。qx18试验组的氨气去除率为37.11%,硫化氢去除率为42.78%(见图8)。
2.3.5 三种菌株自由复合的除臭数据数据
通过上述试验结果,可以得知三种菌株均有降低臭气浓度的效果,本试验将其中几种菌株自由组合,菌种等比例复配,检测其臭气去除效果如图9所示。
从图9中可以的得出,菌株复合臭气去除效果都比单菌株要好,其中nf5、nb11和qx18三种菌株复合后的除臭效果最好,臭气去除率达到了72.31%。
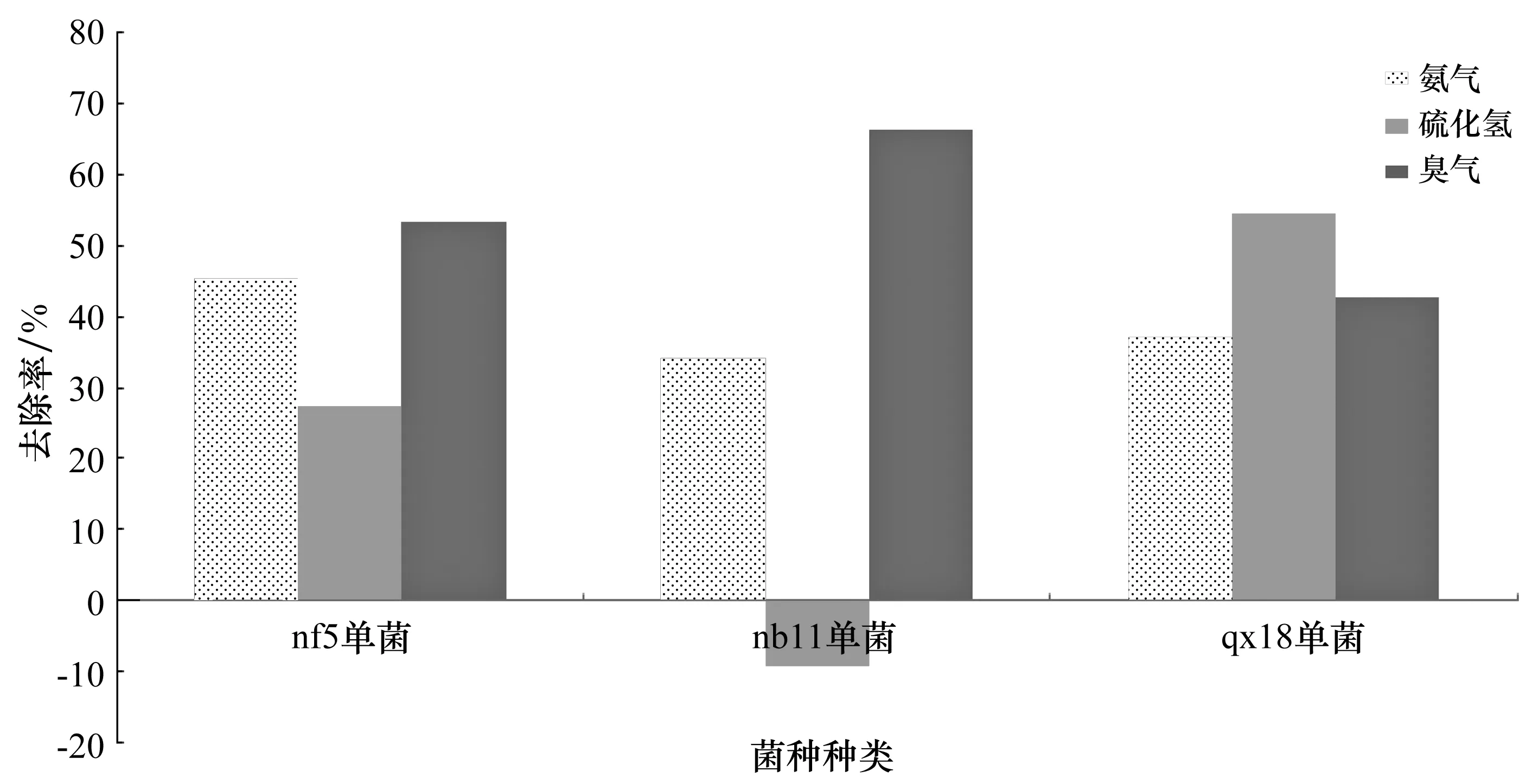
图8 不同菌株臭气、氨气、硫化氢去除率Figure 8 Removal rates of odor, ammonia and hydrogen sulfide by different strains
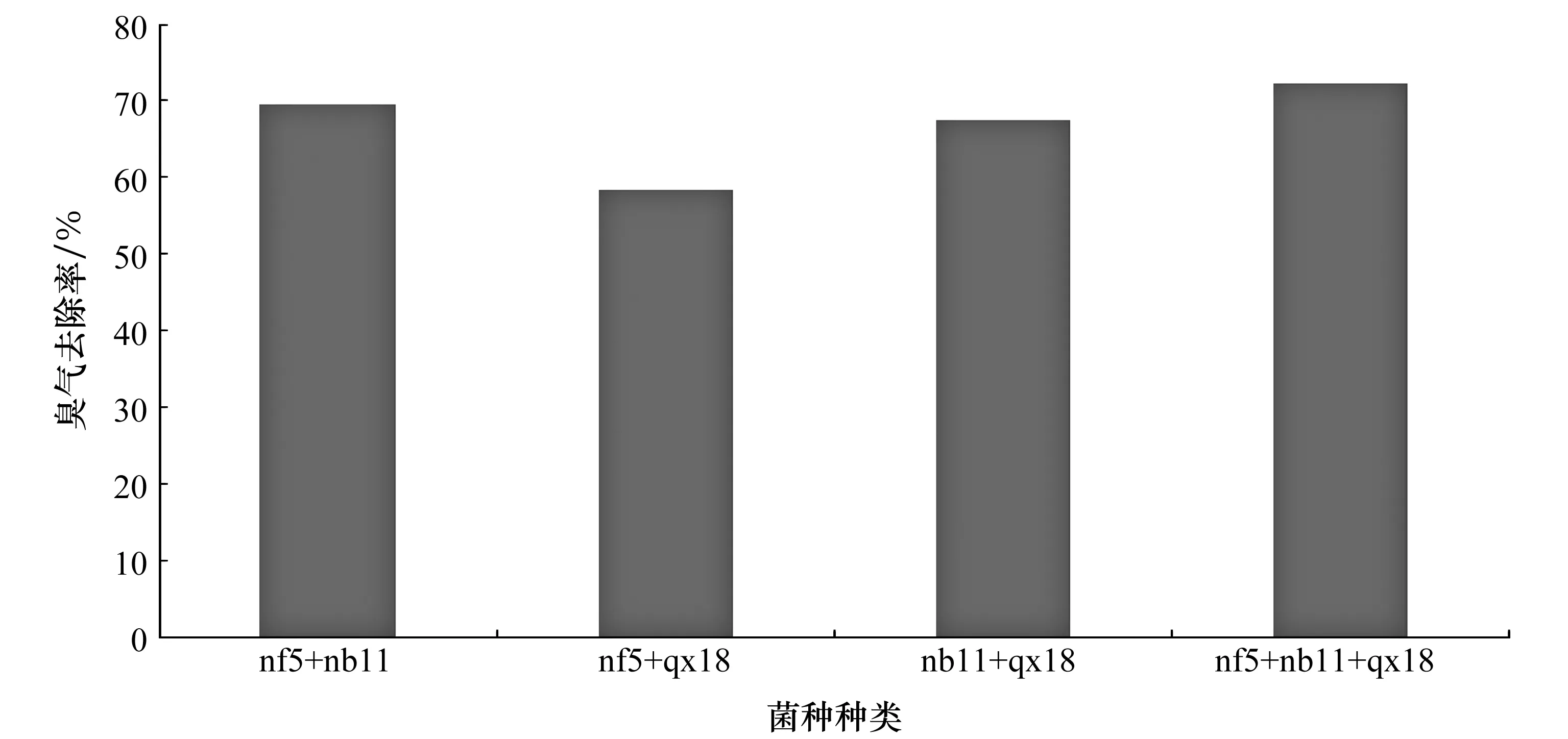
图9 不同菌株复合臭气去除率Figure 9 Compound odor removal rate of different strains
2.4 复合菌种发酵培养影响因素分析
2.4.1 原料含水率对发酵试验影响
通过水分检测仪测出新鲜猪粪含水率为60%,取2 kg猪粪作为实验通过公式计算可得出要调节猪粪含水率为30%、40%、50%、60%的猪粪,需要添加的木屑量为1.25、0.625、0.25和0 kg。70%含水率的猪粪需要加0.125 kg水。通过设置六个试验组,分别接种量为10%的nf5+nb11+qx18复合菌,设置发酵温度为30℃,使用单一变量法进行试验,试验结果如图10所示:
从试验结果中可以的得出,猪粪含水率从30%到50%这个过程中,其臭气去除率是在上升。猪粪含水率在50%时臭气去除效率是最高的,此时达到了71.29%,此后随着猪粪含水率的升高,其臭气去除率在降低。其试验结果原因可能是在含水率较低或者较高的情况下,水分影响的菌种的生长繁殖的活性,含水率低于适宜条件对除臭效果影响更大。从此次试验结果可以得出三种菌株复合的最佳猪粪含水率为50%。
2.4.2 菌种接种量对发酵的影响
将nf5、nb11和qx18复合菌剂,按照4%、8%、12%、16%和20%的接种量接种至含水率为50%的猪粪中,设置发酵温度为30 ℃,试验结果如图11所示:
由图11可知,接种量小于16%时,臭气去除率随着接种量增加而增加,当接种量大于16%时,臭气去除率基本不变,因此可以得出接种量为16%时的臭气去除率最高,但考虑经济效应,接种量为12%更实惠,接种量12%的除臭效果和16%接种量接近。
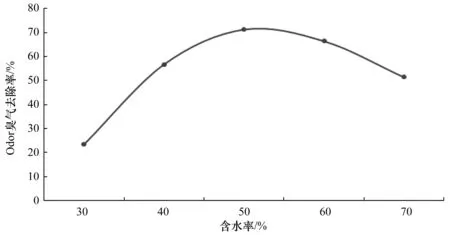
图10 猪粪含水率对除臭影响Figure 10 Effect of moisture content of pig manure on deodorization
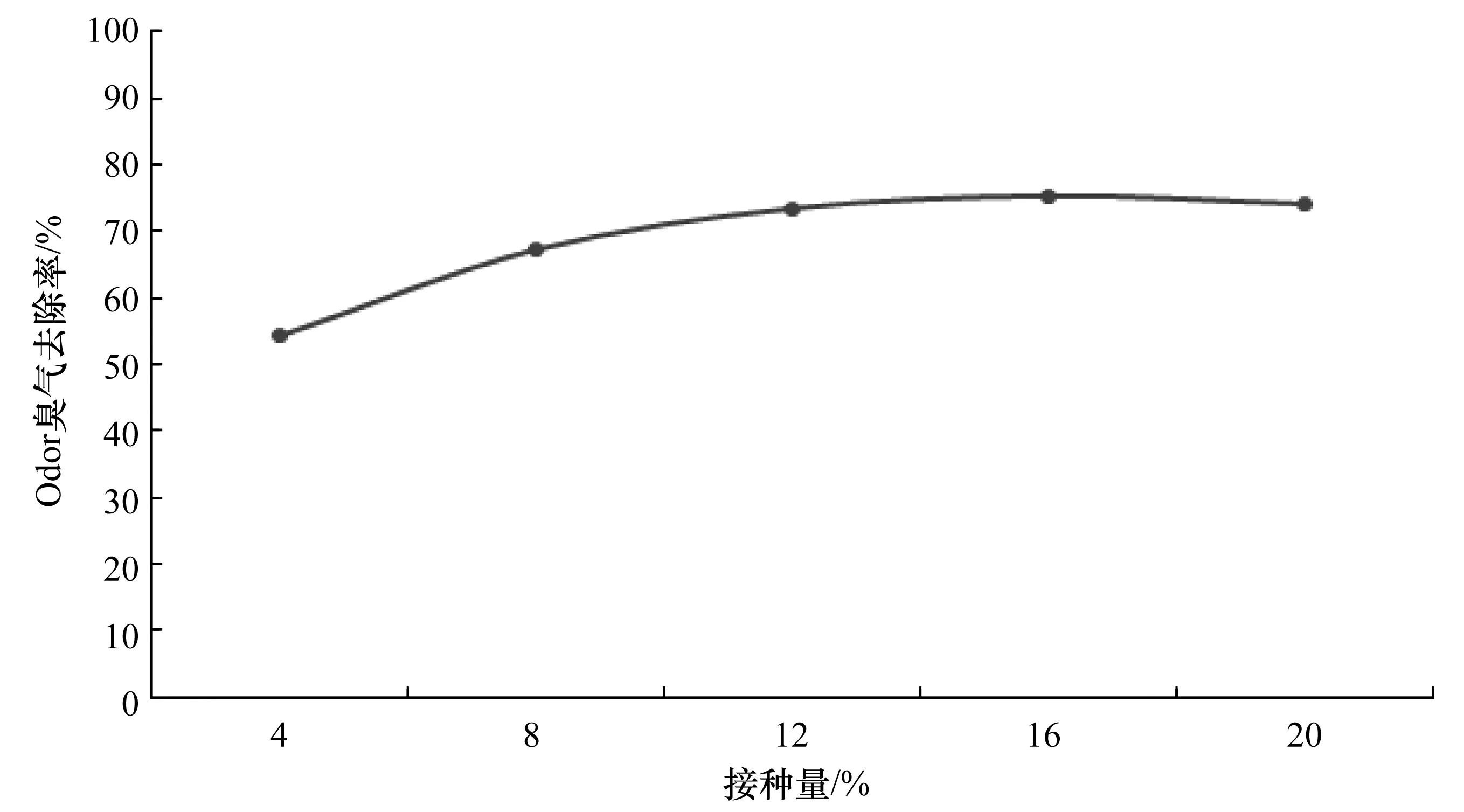
图11 接种量对除臭影响Figure 11 Effect of inoculation ratio on deodorization
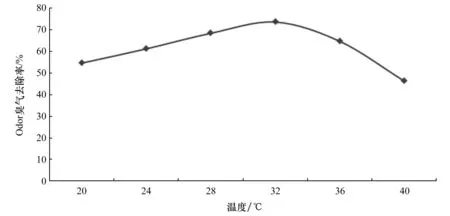
图12 温度对除臭影响Figure 12 The effect of temperature on deodorization
2.4.3 温度对发酵的影响
将复合菌株接种于含水率为50%的猪粪中,接种量为12%,设置恒温发酵罐温度为20、24、28、32、36、40 ℃的温度下,保持其他条件不变,测定臭气的浓度,计算臭气去除率,探究最佳发酵温度。试验结果如下图所示。
由图12可知,当温度低于32℃时,臭气的去除率随着发酵温度的升高而增加,当温度高于32 ℃时,臭气去除率开始下降。温度为32 ℃时的臭气去除率最高。
3 讨 论
本次试验在三种复合菌肥发酵剂发酵猪粪的堆肥实验中,筛选出3株能降解氨气的菌株。复合发酵剂中含有能够降解猪粪的菌群,给堆肥中的微生物发酵提供营养物质和改变猪粪中原有的微生物结构,更有利于筛菌。对于猪粪中能够筛出除臭菌株,其原因是在猪粪发酵中原本含有除臭菌株,通过添加了复合菌肥发酵剂使其成为优势菌种,通过选择培养基将其筛选出。加入复合发酵剂的堆肥过程升温明显,除了与恒温发酵罐设定起始温度有关,还与复合菌肥发酵剂中含有丰富菌群,可以促使堆肥快速分解发酵。
在筛菌的过程,本次试验选用的是NH3选择培养基,通过筛选出能够降解氨气的菌株来得到我们需要的除臭菌株。在猪粪堆肥中,臭气的主要成分是氨气和硫化氢,臭气的指标不能作为筛菌的依据,因此本次试验使用NH3选择培养基筛菌,筛出的菌种对臭气和氨气两大指标浓度都有较好的降低效果。
在除臭试验过程,接种了不同菌株的实验组,在不同阶段的臭气降解效果不同,也说明不同菌株在不同阶段发挥的作用不同。在除臭试验中,臭气浓度随着发酵过程,先出现下降,在达到高温期前会有一个短暂的上升,随后臭气浓度缓缓下降,不同实验组都出现这一特征,根据试验结果推断,其原因可能是在达到高温期前,此时的菌种大量繁殖,使之分解猪粪的速率上升,产生的臭气也出现回升。在自然界微生物之间的作用和关系是复杂的,通过将三株菌种两两之间1∶1复配,组合后的菌种的除臭效果明显,其具体生物之间的相互关系还待进一步研究。
发酵条件是制约发酵水平的重要因素,在堆肥过程中,猪粪的含水率,发酵温度,和接种量这三个因素影响着堆肥除臭的实际效果。含水率是影响微生物的生活环境,含水率过低或者过高都不利于微生物繁殖,硫化氢和氨气也是可以溶于水,含水率高对臭气浓度也是有影响。接种量是最直接影响发酵速率,当接种量不够,微生物需增加繁殖周期,才能达到基本的除臭效果。
4 结 论
本研究主要从三种发酵剂堆肥发酵猪粪中筛选出高效除臭菌种,并通过复合三株菌种来研究提高除臭效果。由于复合发酵剂中含有大量微生物,可以改变新鲜猪粪中原本含有的生物群落。因为没有特定的除臭选择培养基,通过查找资料了解到猪粪中臭气主要是由氨气和硫化氢气体,因此本试验选择使用氨气选择培养基来筛选出除臭菌株,试验结果也证实筛选出的菌株具有除臭效果,对氨气除臭效果明显好于硫化氢。
在复合试验中,三株菌种的复合的除臭效果要明显优于单株菌种的除臭效果,因此将单株菌株复合也是可以作为提高除臭效果的方法去研究。微生物除臭具有高效和环保等属性,但是其受外界环境因素影响较大,因此需要从猪粪含水率、接种量和堆肥温度来探究最佳的适宜条件,为微生物除臭应用提供基础。

