巴氏灭活嗜黏蛋白阿克曼氏菌对ox-LDL诱导的HAEC细胞损伤的保护作用及机制初探
高静竹,朱文秀,夏效东,
(1.大连工业大学食品学院,辽宁大连 116034;
2.国家海洋食品工程技术研究中心,辽宁大连 116034)
心血管疾病是全球范围导致死亡的主要原因之一[1]。《中国心血管健康与疾病报告2020》中指出,中国心血管病死亡占城乡居民总死亡原因的首位,给居民和社会带来的沉重的经济负担[2]。动脉粥样硬化是心血管系统最常见的疾病,其导致的冠心病、中风等心脑血管疾病严重危害人类的健康。内皮功能障碍是心血管疾病的重要危险因素,是动脉粥样硬化发病机制的起始步骤[3]。在内皮细胞损伤的诸多因素中,氧化低密度脂蛋白(ox-LDL)是重要的危险因子,参与细胞损伤以及动脉粥样硬化病变的发生发展[4]。因含过氧化产物及溶血卵磷酯,ox-LDL可破坏细胞膜结构,改变细胞通透性;可通过激活细胞特异性受体,诱导相关蛋白和基因的表达[5-8]。同时,ox-LDL又可诱导内皮细胞内活性氧(Reactive oxygen species, ROS)的生成[9]。外界刺激产生的过量活性氧将致使细胞发生氧化应激损伤,导致细胞内抗氧化和促氧化的平衡失调,进而加重动脉粥样硬化的发生发展[10]。清除体内过量的ROS或增强抗氧化能力可能是预防和治疗动脉粥样硬化的关键点之一[11]。肠道菌群是指在肠道中以共生关系生活的数以万亿计的细菌、病毒、真菌、古生菌和真核生物。肠道微生物对宿主具有多种有益的功能,在许多疾病的发生发展中的作用已被阐明,和心血管系统之间的关系也得到了证实[12]。嗜黏蛋白阿克曼氏菌(以下简称阿克曼氏菌)是一种革兰氏阴性厌氧菌,属于疣微菌门,是一种广泛分布于人体肠道粘液层的共生菌,占人体肠道微生物的1%~5%[13]。阿克曼氏菌作为下一代益生菌的代表菌株,其潜在功能引起了研究人员的广泛关注[14]。
目前已有动物研究表明阿克曼氏菌具有改善代谢紊乱、抗炎、调节肠道屏障功能和抗衰老的功能[15-17]。此外,阿克曼氏菌对代谢调节相关的疾病如肥胖和糖尿病的缓解作用已得到临床试验验证[18]。阿克曼氏菌对动脉粥样硬化也具有一定的改善效果[19-20]。近年来,有研究发现对阿克曼氏菌进行巴氏灭活处理后,其对相关疾病的缓解作用非但没有消失,反而在某些指标改善方面比活菌表现出更好的效果[21]。临床试验表明口服巴氏灭活的阿克曼氏菌可使受试者胰岛素敏感性提高30%,降低胰岛素血症和高总胆固醇血症。巴氏灭活的阿克曼氏菌也同时降低了受试者的体重和脂肪量[18]。这些研究结果表明巴氏灭活的阿克曼氏菌中的某些细菌成分或代谢产物可通过循环系统到达体内发挥其健康功能。相比活的阿克曼氏菌,巴氏灭活的阿克曼氏菌具有更好的安全性以及便于保存运输等特性,这些均表明巴氏灭活的阿克曼氏菌可作为原料来开发具有相应健康改善功能的后生元(对宿主起有益作用的灭活菌和/或菌成分)相关产品。虽然有研究表明阿克曼氏菌能改善糖尿病以及动脉粥样硬化,但目前的机制主要集中在改善糖脂代谢以及改善肠道屏障减轻肠漏造成的系统炎症,关于灭活阿克曼氏菌是否能缓解ox-LDL造成的内皮细胞损伤以及相应的机制尚未有报道。
基于此,本实验旨在探究巴氏灭活的阿克曼氏菌对ox-LDL诱导的内皮损伤的保护作用并初步探讨其可能的机制。本文采用ox-LDL诱导HAEC细胞损伤模型,运用MTT法、JC-1荧光染色、实时荧光定量PCR、免疫印迹法等技术研究巴氏灭活的阿克曼氏菌对ox-LDL损伤的人主动脉内皮细胞活性和功能的影响及潜在的机制。研究结果可为将来基于灭活阿克曼氏菌开发具有改善心血管健康的后生元相关健康食品奠定理论基础。
1 材料与方法
1.1 材料与仪器
嗜黏蛋白阿克曼氏菌(ATCC BAA-835) 美国模式菌株保藏中心;人主动脉内皮细胞(HAEC) 中国科学院上海生命科学研究院细胞资源中心;高糖DMEM(Dulbecco's modified eagle medium)培养基、胎牛血清、青霉素-链霉素 赛默飞世尔科技(中国)有限公司;BHI脑心浸液肉汤 北京陆桥技术有限责任公司;氧化型低密度脂蛋白 广州奕源生物科技有限公司;BCA(Bicinchoninic acid assay)蛋白浓度测定试剂盒 北京索莱宝科技有限公司;活性氧检测试剂盒、超氧化物歧化酶(Superoxide dismutase,SOD)检测试剂盒、过氧化氢酶(Catalase,CAT)检测试剂盒、总抗氧化能力(Total antioxidant capacity,TAOC)检测试剂盒 南京建成生物工程研究所;Nrf2、HO-1、NQO1、β-actin抗体 武汉爱博泰克生物科技有限公司;其他试剂 均为分析纯;相关引物由生工生物工程(上海)股份有限公司合成。
Revolve Generation 2正倒置一体荧光显微镜美国Echo公司;PowerPac基础电泳仪电源、Mini-PROTEAN Tetra垂直电泳槽 美国Bio-Rad公司;MF-ChemiBIS 2.0凝胶成像仪 以色列DNR公司;Infinite F200 PRO荧光酶标仪 瑞士Tecan Infinite公司;MyCycler实时荧光定量PCR仪 德国耶拿公司;LDZX-30KBS高压灭菌锅 上海申安医疗器械厂;TS-2000A脱色摇床 上海书培实验设备有限公司;T100 Thermal Cycler PCR仪 德国Biometra公司;NanoDrop-One微量核酸定量仪 赛默飞世尔科技(中国)有限公司。
1.2 实验方法
1.2.1 巴氏灭活的嗜黏蛋白阿克曼氏菌的制备 将-80 ℃超低温冰箱中冻存的嗜黏蛋白阿克曼氏菌接种在含黏蛋白的BHI 培养基中,在厌氧条件下培养至对数生长期。8000 r/min,10 min条件下离心弃上清,使用PBS洗菌体2次并重悬,调整悬液到OD600nm=0.8(浓度为108CFU/mL左右)。在70 ℃水浴锅中加热30 min,-20 ℃保存。
1.2.2 HAEC细胞培养 在37 ℃、5% CO2、饱和湿度条件下,HAEC细胞培养于含有10% FBS、1%双抗的DMEM培养基中,取对数生长期细胞进行后续实验。
1.2.3 细胞活性实验 将 100 μL 1×105个/mL HAEC细胞悬液接种于96孔细胞培养板中。培养24 h后,加入不同菌数的巴氏灭活的阿克曼氏菌(105、106、107、108CFU/mL)于 37 ℃ 5% CO2条件下培养24 h。向每孔中加入20 μL 5 mg/mL的MTT溶液,继续孵育细胞4 h。形成的甲瓒晶体溶解于150 μL DMSO中,使用酶标仪检测OD490nm的吸光度。
1.2.4 细胞分组 在后续实验中,细胞均分为以下几组,并进行相应处理。空白组:使用无血清培养基孵育24 h;模型组:用含50 μg/mL ox-LDL的无血清培养基孵育24 h;样品组:用含不同菌数巴氏灭活的阿克曼氏菌(105、106CFU/mL)以及 50 μg/mL ox-LDL的无血清培养基孵育24 h。
1.2.5 乳酸脱氢酶释放检测 将HAEC细胞悬液接种于96孔细胞培养板中培养24 h。待细胞贴壁后分为三组,按照1.2.4方法处理。孵育结束后,用PBS缓冲液轻轻洗涤细胞2次,按照乳酸脱氢酶(Lactic dehydrogenase, LDH)检测试剂盒的说明书要求,吸取细胞上清液进行LDH活性检测。
1.2.6 活性氧水平检测 利用二氯荧光乙酰乙酸盐(DCFH-DA)荧光探针测定HAEC细胞内产生的ROS含量。将1 mL 1×106个/mL HAEC细胞接种到12孔细胞培养板中,按照1.2.4节的方法处理细胞24 h后,按照ROS检测试剂盒说明书操作步骤测定各孔的荧光强度。
1.2.7 抗氧化酶SOD、CAT活力及总抗氧化能力检测 将HAEC细胞接种到12孔细胞培养板中,按照1.2.4节的方法处理细胞24 h后,胰酶消化细胞,收集至1.5 mL EP管中。使用PBS洗两次后,超声破碎细胞,在4 ℃ 1000 r/min条件下离心10 min,收集上清液。根据SOD、CAT、T-AOC试剂盒说明书,检测上清液中的SOD、CAT活力和总抗氧化能力。
1.2.8 RT-PCR检测细胞相关抗氧化基因的表达将1×106个/mL细胞接种于6孔板并放入CO2培养箱中保持37 ℃过夜培养,按照1.2.4节的方法处理细胞24 h后,用PBS将细胞润洗3次,严格依据RNA提取试剂盒说明书操作,提取细胞RNA。微量核酸定量仪测定RNA浓度,使用Evo M-MLV RT Kit with gDNA Clean for qPCR II试剂盒将RNA反转录为cDNA后放在-20 ℃冰箱保存待用。利用SYBR Green Permix Pro Taq HS qPCR试剂盒做荧光定量PCR检测,10 μL反应体系(上下游引物各0.2 μL,SYBR Green Permix Pro Taq HS 5.0 μL,无RNA 酶水 3.6 μL,cDNA 模板 1.0 μL)。以β-actin基因作为内参基因,采用2-ΔΔCt法分析基因的相对表达量。相关引物序列见表1。

表1 荧光定量PCR实验中的引物序列Table 1 Primer sequences used for qPCR
1.2.9 Western blot检测相关蛋白的表达 采用Western blot实验测定细胞内Nrf2及其下游抗氧化酶HO-1蛋白的表达量。将细胞按照1.2.4节的方法处理后加入 100 μL细胞裂解液(含 1 mmol/L PMSF),然后用刮刀刮取细胞放置在EP管内,剧烈震荡 20 s,冰浴 10~15 min。10000 r/min 4 ℃ 条件下离心15 min,收集上清。使用BCA试剂盒测定蛋白浓度并将蛋白浓度调到一致。以V(蛋白样品):V(上样缓冲液)=1:4的比例加入 5×loading buffer。将样品混匀后于100 ℃变性10 min,-20 ℃保存备用。
配制质量分数12%的分离胶和5%的浓缩胶,上样,分离目的蛋白。采用湿转的方法,将目的蛋白电转至NC膜上,5%脱脂牛奶室温封闭2 h,使用TBST洗膜3次,每次10 min。将NC膜放入抗体Nrf2、HO-1、NQO1稀释液中 4 ℃孵育过夜,二抗室温孵育1 h,将配好的化学发光液滴于膜上,通过凝胶成像仪成像,并通过Image J软件定量分析。
1.3 数据处理
每个实验结果均做三次平行实验。采用SPSS Statistics 19软件统计分析数据,进行单因素方差分析与Duncan氏多重比较。实验结果表示为平均值±标准偏差。P<0.05表示差异显著。使用Origin 2021软件进行绘图。
2 结果与分析
2.1 巴氏灭活的阿克曼氏菌对HAEC细胞活力的影响
采用MTT法分析巴氏灭活的阿克曼氏菌对HAEC细胞活力的影响,结果如图1所示。当巴氏灭活的阿克曼氏菌菌数低于106CFU/mL时,细胞活力均大于90%,表明该剂量的细菌对细胞基本无不良影响。当巴氏灭活的阿克曼氏菌菌数超过107CFU/mL时,与对照组相比,细胞的活力有一定的降低。因此本研究将选取105、106CFU/mL作为巴氏灭活的阿克曼氏菌的干预剂量进行后续实验。
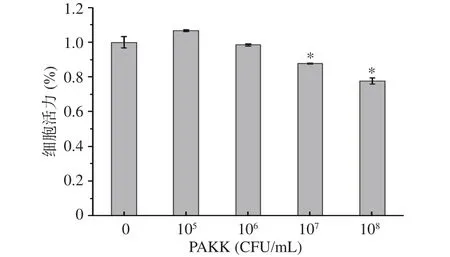
图1 巴氏灭活的阿克曼氏菌PAKK对HAEC细胞活力的影响Fig.1 Effects of PAKK on the viabilities of HAEC
2.2 巴氏灭活的阿克曼氏菌对HAEC损伤细胞的LDH释放的影响
乳酸脱氢酶是一种氧化还原酶,内皮细胞功能障碍、凋亡或坏死等造成细胞膜结构被破坏,会导致细胞浆内的乳酸脱氢酶释放到培养液中,因此LDH释放被视为检测细胞完整性的重要指标。巴氏灭活的阿克曼氏菌对ox-LDL诱导HAEC细胞的LDH释放的影响,结果如图2所示,与对照组相比,ox-LDL处理24 h后,HAEC细胞的LDH释放增强(P<0.05)。而巴氏灭活的阿克曼氏菌(105、106CFU/mL)可显著逆转氧化低密度脂蛋白诱导的细胞内LDH释放的增加(P<0.05)。结果表明巴氏灭活的阿克曼氏菌具有保护细胞膜结构的作用,能够抑制胞内物质的流出。Liu等[22]使用GPR120受体激活剂GW9508干预ox-LDL诱导的内皮细胞后,LDH释放量明显下降,与本研究结果一致。

图2 PAKK对HAEC损伤细胞LDH释放的影响Fig.2 Effect of PAKK on LDH release from injured HAEC
2.3 巴氏灭活的阿克曼氏菌对HAEC损伤细胞内ROS水平的影响
ROS是细胞氧化损伤的一个重要标志[23]。据报道,ROS的释放与多种心血管疾病有关[24]。在氧化剂诱导的细胞毒性中,ROS的释放是一个早期和关键的事件[25]。如图3所示,与对照组细胞相比,经ox-LDL损伤刺激后,HAEC细胞内ROS水平显著增加(P<0.05),约为对照组的162%。而经过巴氏灭活的阿克曼氏菌处理后,细胞的ROS含量显著降低(P<0.05),且呈现剂量依赖性。实验结果表明,巴氏灭活的阿克曼氏菌能够显著降低HAEC细胞内ROS的产生,从而缓解细胞的氧化损伤。与本文的报道类似,Zhou等[26]研究表明具有心血管改善功能的苦参碱也能够以浓度依赖的方式显著降低ox-LDL诱导巨噬细胞的ROS水平。Wang等[27]研究发现芽孢杆菌SC06处理能够降低H2O2诱导的肠上皮细胞内ROS水平。

图3 PAKK对HAEC损伤细胞内ROS产生的影响Fig.3 Effects of PAKK on the production of ROS in injured HAEC
2.4 巴氏灭活的阿克曼氏菌对HAEC损伤细胞抗氧化酶及总抗氧化能力的影响
巴氏灭活的阿克曼氏菌对ox-LDL诱导HAEC细胞内SOD活力、CAT活力和总抗氧化能力影响的结果如图4所示。经ox-LDL处理的细胞与对照组细胞相比,HAEC细胞内的SOD活力,CAT活力及总抗氧化能力均显著降低(P<0.05)。与ox-LDL处理组相比,巴氏灭活的阿克曼氏菌干预组中HAEC细胞内的SOD活力、CAT活力和总抗氧化能力均有显著升高(P<0.05)。超氧化物歧化酶、过氧化氢酶作为是抗氧化酶系统的最主要成员,也是生物抗氧化系统的重要防线[28]。SOD可以把有害的超氧自由基转化为过氧化氢。尽管过氧化氢仍是对机体有害的活性氧,但体内的CAT会立即将其分解为完全无害的水,在延缓机体衰老、抵御疾病等方面发挥着重要的作用[29]。总抗氧化能力是用于衡量机体抗氧化系统功能状况的综合性指标,单独测定某一种或某些抗氧化成分的含量往往不能全面的反映组织的抗氧化能力,因而可通过T-AOC来评价机体总体上的抗氧化能力,即测定对象中各种抗氧化物质和抗氧化酶等构成总抗氧化水平[30]。以上实验结果表明,巴氏灭活的阿克曼氏菌能显著提高ox-LDL诱导氧化损伤的HAEC细胞内SOD和CAT酶活力,提高细胞的总抗氧化能力,有效清除氧化损伤细胞内的ROS,从而保护HAEC细胞免受ox-LDL诱导的氧化损伤。
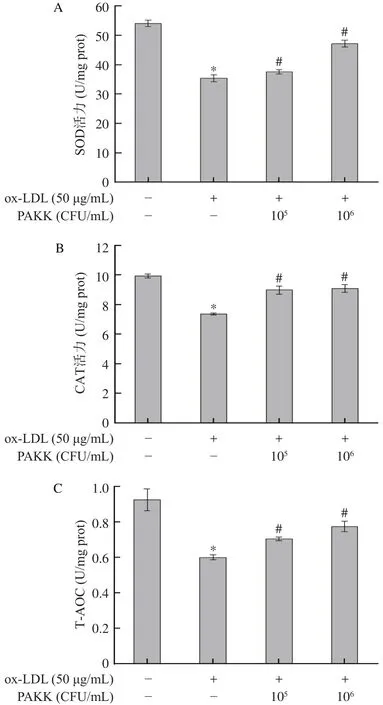
图4 PAKK对HAEC损伤细胞内抗氧化酶活力及抗氧化能力的影响Fig.4 Effects of PAKK on antioxidative enzyme activity and antioxidant capacity in injured HAEC
Wang等[31]探究了重组植物乳杆菌对H2O2诱导的HUVEC细胞氧化应激的保护作用。研究发现,重组植物乳杆菌能够显著下调H2O2诱导HUVEC细胞内的ROS水平和SOD酶活力(P<0.05)。崔志文等[32]研究发现,氧化损伤的Caco-2细胞内,SOD、CAT酶活力以及T-AOC水平显著降低(P<0.05);而经过鼠李糖乳酸杆菌处理,上调了细胞SOD、CAT酶活力以及T-AOC水平(P<0.05),与本研究结果一致。
2.5 巴氏灭活的阿克曼氏菌对 HAEC损伤细胞Nrf2、HO-1基因及蛋白表达的影响
巴氏灭活的阿克曼氏菌对ox-LDL诱导HAEC细胞中Nrf2/HO-1信号通路中相关基因mRNA表达量的影响如图5所示。对Nrf2基因以及下游的3个基因HO-1、NQO1、GST的表达情况分别进行了测定。与空白组细胞相比,ox-LDL处理后,细胞中Nrf2、HO-1、NQO1和GST基因受到明显的抑制。经过巴氏灭活的阿克曼氏菌处理后,mRNA表达显著升高(P<0.05)。Western blot结果如图6所示,ox-LDL处理组的Nrf2、HO-1和NQO1蛋白相对表达量显著降低(P<0.05);与模型组相比,105、106CFU/mL巴氏灭活的阿克曼氏菌处理组中Nrf2、HO-1和NQO1蛋白表达量均显著升高(P<0.05)。Nrf2/HO-1途径被认为是细胞抗氧化防御的关键机制。Nrf2是维持氧化还原稳态和细胞抗氧化的关键调节因子,能够通过抗氧化反应元件调节多种抗氧化系统及Ⅱ期解毒酶的表达[33]。其中Ⅱ期解毒酶包括HO-1、NQO1、GST[34]。HO-1 在动脉粥样硬化性疾病中起重要的保护作用。有大量研究发现,HO-1的表达上调有助于细胞抵御外界刺激,缓解氧化应激损伤[35-36]。以上结果表明,巴氏灭活的阿克曼氏菌可能通过激活HAEC细胞的Nrf2/HO-1信号通路,从而提高细胞抗氧化酶的活力和抗氧化基因的表达,发挥其对ox-LDL诱导HAEC损伤的保护作用。

图5 PAKK对HAEC损伤细胞内mRNA相对表达量的影响Fig.5 Effects of PAKK on the relative mRNA expression in injured HAEC

图6 PAKK对HAEC损伤细胞内蛋白相对表达量的影响Fig.6 Effects of PAKK on the relative protein expression in injured HAEC
之前有研究探究了格氏乳杆菌SBT2055对3T3细胞氧化应激的保护作用[37]。研究发现,格氏乳杆菌SBT2055处理能够显著上调3T3细胞内Nrf2和HO-1的蛋白质水平(P<0.05)。Mu等[38]研究发现,植物乳杆菌Y44能够通过激活Nrf2信号通路,显著上调Caco-2细胞内Nrf2和HO-1蛋白的表达(P<0.05),保护细胞免受ABAP诱导的氧化损伤。
3 结论
本实验结果表明,巴氏灭活的嗜黏蛋白阿克曼氏菌对ox-LDL氧化损伤的HAEC细胞具有一定的保护作用。巴氏灭活的阿克曼氏菌能够降低ox-LDL诱导的HAEC细胞内LDH的释放,保护细胞完整性;降低细胞内活性氧的生成,提高抗氧化酶活力,上调抗氧化基因的表达,缓解细胞氧化损伤。巴氏灭活的阿克曼氏菌能够明显上调ox-LDL处理的HAEC细胞内Nrf2、HO-1基因及相关蛋白的表达量,表明巴氏灭活的阿克曼氏菌可能通过激活Nrf2/HO-1信号通路,发挥其对ox-LDL损伤的HAEC细胞的保护作用。本研究将为今后开发基于阿克曼氏菌的后生元相关制剂用于预防和减缓动脉粥样硬化发生发展奠定理论基础。

