外源2,4-表油菜素内酯诱导茶树低温抗性的生理机制研究
李 鑫,李梦菡,余红伟,武雅娴,3,张 兰,韩文炎
1. 中国农业科学院 茶叶研究所,浙江 杭州 310008;2. 建德市农业农村局,浙江 建德 230036;3. 河北农业大学 园艺学院,河北 保定 071000
茶树[Camellia sinensis(L.) O. Ktze.]是多年生常绿乔木,具有喜温畏寒的生长特性[1]。近年来,随着全球气候变化的不断加剧,茶树等园艺作物越来越容易遭受低温冻害和高温干旱等极端环境的影响。我国北方茶区冬季气温偏低,茶园易受冻害而出现越冬困难;南方茶区尤其是江南茶区,在春季常遭受“倒春寒”影响,给当地名优茶的生产带来较大影响[2]。近年有关茶树遭受倒春寒危害的报道也在不断增加。随着早芽良种的培育、肥培管理水平的提高以及先进科学技术的推广应用,茶叶发芽时间日趋提早,倒春寒对名优茶生产的影响也日益严重[3]。茶树是我国重要的经济作物,低温胁迫会严重影响茶叶的产量和品质。可见,探究茶树低温抗性调控的生理机制以及研发茶树低温抗性栽培技术是科研和生产中亟待解决的重要问题。
油菜素甾醇类化合物(Brassinosteroids,BRs)是从油菜的花粉中分离鉴定的一类新型植物激素[4],在植物的生长发育调控中发挥着重要作用,对植物适应或抵抗逆境胁迫也具有重要作用[5]。目前,具有较高生物活性的油菜素内酯类似物表油菜素内酯(2,4-epibrassinolide,EBR)在农业生产上已广泛应用[6]。近年来,已有较多研究对于EBR在改善植物逆境胁迫方面进行了探究。张爱敏等[7]用不同质量浓度EBR处理低温胁迫下黄瓜种子,发现适当浓度EBR处理可提高黄瓜种子的发芽势、发芽率及侧根数等,减轻种子萌发和幼苗受到的低温伤害。石玲等[8]发现EBR能调控杏果实采后的活性氧代谢,增强杏果实采后抗病性。Shu等[9]在研究低温和弱光条件下外源EBR对番茄叶片的影响时发现,EBR可减轻低温胁迫引起的对光合作用和氮代谢的有害影响,从而改善植物生长。李淑叶等[10]也发现,外源EBR可通过降低棉花幼苗的相对电导率、提高叶片光能捕获能力及光合电子传递能力等缓解低温对棉花光合作用的抑制。
综上,外源喷施油菜素内酯为缓解茶树的低温胁迫状况提供了新思路,我们前期的研究也探明了外源EBR对茶树光合特性及耐热性影响的生理机制[11-12]。然而,目前有关BRs诱导茶树低温抗性的生理机制尚不明确,有必要开展进一步研究。本研究以茶树品种‘龙井43’为材料,通过外源EBR处理茶树叶片,探究低温胁迫下茶树叶片过氧化氢(H2O2)、超氧阴离子(O2-·)、茶多酚、丙二醛(MDA)含量以及超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)、抗坏血酸过氧化物酶(APX)等抗氧化酶活性的变化,并结合茶多酚生物合成中部分关键基因(PAL、CHI、C4H、CHS)的表达量分析,以解析外源表油菜素内酯诱导茶树对低温胁迫抗性的生理机制,为茶树逆境栽培技术研发提供理论依据。
1 材料与方法
1.1 材料与处理
供试茶树品种选用‘龙井43’,系中国农业科学院茶叶研究所培育并推广种植的茶树优质品种。选择生长状态一致、无病虫害侵袭的三年生茶树幼苗为实验材料。用浓度为0.1 μmol/L的EBR(含0.3‰有机硅)喷施叶面,直至叶片滴水为止,以含相同浓度有机硅的清水进行喷施作为对照。
叶面喷施12 h后,将茶树幼苗分别置于人工气候培养箱内进行常温处理(25℃)和低温处理(-4℃)。两个培养箱的其他环境因子设置相同,平均光强为600 μmol/m2·s,平均相对湿度控制为80%。
最终试验分为4个处理:(1)对照(Control),即清水喷施处理后置于25℃常温;(2)常温下表油菜素内酯预处理(EBR),即在茶树叶面均匀喷施EBR后置于25℃常温;(3)单一低温处理(Cold),即清水预处理后置于-4℃低温;(4)表油菜素内酯和低温的复合处理(EBR + Cold),即将叶面喷施EBR后的幼苗置于-4℃低温。经人工气候培养箱进行不同温度处理30 min后,取从顶芽向下第三张叶片进行DAB(3,3'-二氨基联苯胺)和NBT(氮蓝四唑)染色;取一芽及半展叶用于基因表达分析;取一芽二叶称重后置于液氮中用于其他生理指标的测定。每次测量设置3个生物学重复。
1.2 测定项目与方法
1.2.1 H2O2和O2-·的定性检测
H2O2的存在采用DAB染色法检测,O2-·的存在采用NBT染色法检测[13],两种染色液均现配现用。染色:将叶片用蒸馏水洗净,取各组叶圆片分别置于染液中抽真空5 ~ 10 min,在25℃室温下染色约5 h至叶片出现明显斑点。脱色:将离心管中的染液倒掉,加入无水乙醇后沸水浴10 min。重复三次左右,直至叶圆片完全脱绿,用显微镜观察拍照(Leica DM4000B &DFC425,莱卡公司,德国)。
1.2.2 茶多酚含量测定
采用酒石酸亚铁比色法(GB/T 8313—2002)[14]。将茶样磨成粉末后称取0.1 g于10 mL离心管中,加入5 mL纯水后置于100℃沸水浴中浸提5 min,中途振荡一次使茶样和水充分混匀。结束后立即置于冰水浴中快速冷却,在4℃条件下12000 g离心10 min,取上清液用于茶多酚含量测定。吸取1 mL上清液于25 mL的容量瓶中,加入4 mL超纯水和5 mL酒石酸亚铁溶液,混匀后再加入pH 7.5的磷酸缓冲液至刻度,摇匀后测定D540吸光值,并根据标准曲线计算茶多酚含量。
1.2.3 MDA含量分析
参照Cakmak等[15]的方法进行测定。取0.3 g样品加入提取液(50 mmol/L磷酸缓冲液,0.2 mmol/L EDTA和2% PVP)研磨后,离心20 min,取上清液待测。在1 mL上清液中加入3 mL TBA反应液,95℃水浴条件下保温30 min,立即置于冰水浴中冷却。然后在4℃环境下1500 g离心10 min,测定D532和D600的吸光值。
1.2.4 抗氧化酶活性测定
提取方法与上述MDA提取方法[15]相同。
超氧化物歧化酶(SOD)活性的测定方法参照 Gi-annopolitis等[16]。酶液 50 μL 中加入3 mL 50 mmol/L 磷酸缓冲液(pH 7.8, 15 mmol/L甲 硫 氨 酸,2.0 μmol/L核 黄 素,65 μmol/L NBT和0.1 mmol/L EDTA),由缓冲液替代酶液作为空白管。在室温和光强100 μmol/m·s条件下照光10 min,置于暗下终止反应,测定D560吸光值。
愈创木酚过氧化物酶(G-POD)参照Cakmak等[15]的方法测定。酶液100 μL中加入1700 μL 25 mmol/L磷酸缓冲液(pH 7.0, 0.1 mmol/L EDTA)、100 μL 20 mmol/L 过氧化氢和100 μL 1%愈创木酚,在25℃条件下反应,分析D470的动力学变化。
过氧化氢酶(CAT)活性的测定参照Cakmak等[15]的方法并略作改进。酶液100 μL中加入1700 μL 25 mmol/L 磷酸缓冲液(pH7.0, 0.1 mmol/L EDTA)和200 μL 10 mmol/L过氧化氢。在25℃条件下反应,分析D470的动力学变化。
抗坏血酸过氧化物酶(APX)活力的测定参照Nakano等[17]的方法并略作改进。吸取酶液 100 μL,加入 1700 μL 25mmol/L PBS(pH 7.0,含 0.1 mmol/L EDTA)、100 μL 20 mmol/L H2O2及100 μL 5 mmol/L ASA(抗坏血酸),充分混合后测定40 s内D290的动力学变化(消光系数为2.8 mmol/L·cm)。
1.2.5 qRT-PCR(实时荧光定量PCR)分析
茶树叶片总RNA提取采用Invitrogen TRIzol™试剂盒按说明书方法提取,RNA浓度采用NanoDrop®ND-1000分光光度计进行测定,利用变性琼脂糖凝胶电泳进行RNA质量的检测,总RNA经反转录为cDNA后,qRT-PCR使用SYBR®Premix EX Taq™ II(Tli RNaseH Plus)荧光定量试剂盒,并利用StepOnePlus™ Real-Time PCR System进行定量检测。反应程序设置如下:在94℃预变性2 min;98℃条件下变性10 s,56℃退火30 s后在68℃延伸2 min,总共35个循环;在72℃条件下延伸10 min。CsPTB作为内参基因,引物设计见表1。PCR循环完成后的熔解曲线证实PCR产物均为单一性物质,并根据Livak等[18]的方法计算基因表达量。

表1 qRT-PCR引物设计Table 1 Primers used for real time RT-PCR
1.3 数据分析与处理
采用Microsoft Excel 2019及SAS 9.0对试验数据进行统计分析,用LSD法进行差异显著性检验,用Origin Pro 8.0进行作图。
2 结果与分析
2.1 低温胁迫下外源EBR预处理对茶树叶片中活性氧自由基的影响
低温胁迫下,植物体内会产生多种活性氧自由基。本试验采用DAB及NBT染色法,定性检测了外源EBR处理后茶树叶片内H2O2和O2-·含量的变化。由图1可见,与对照相比,外源EBR常温处理(EBR)后DAB及NBT染色情况无明显变化,而低温处理(Cold)后,DAB被氧化生成的暗棕色颗粒显著增多,NBT被氧化出现较大蓝色斑点,表明受到低温胁迫后叶片中H2O2和O2-·会大量积累。而与单一低温处理(Cold)相比,经外源EBR预处理后低温胁迫诱导的茶树叶片内DAB染色生成的暗棕色面积显著减小,NBT染色生成的蓝色斑点面积也明显缩小。上述现象说明,低温胁迫会使茶树叶片中的H2O2及O2-·含量大量增加,而外源EBR预处理则能显著降低活性氧自由基的积累,缓解茶树低温胁迫下的氧化损伤情况。

图1 低温胁迫下外源EBR预处理对茶树叶片DAB及NBT染色的影响Figure 1 The effect of EBR treatment on DAB and NBT staining in tea leaves under cold stress
2.2 外源EBR对低温胁迫下茶树叶片茶多酚含量的影响
茶多酚不仅是茶叶中重要的滋味物质,还具有很强的抗氧化性。张建忠等[19]发现,茶多酚的抗衰老、抗辐射、抗菌等功能与其清除自由基的抗氧化效果密切相关。由图2可知,与对照相比,外源EBR处理(EBR)及单一低温处理(Cold)后,茶树叶片中的茶多酚含量均无显著差异。然而,经外源EBR预处理后进行低温处理(Cold + EBR),茶树叶片内茶多酚含量显著提高(P<0.05),较单一低温处理相比提高13.37%(图2)。由此可见,外源EBR处理能显著增加低温胁迫下茶树叶片中的茶多酚含量,提高茶树的抗氧化能力。
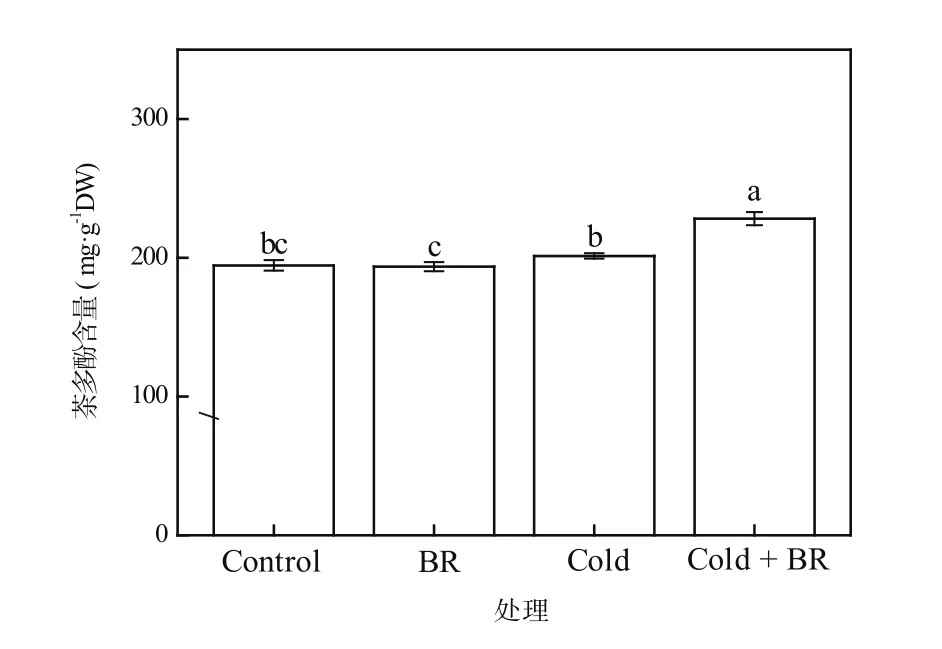
图2 EBR对低温胁迫下茶树叶片茶多酚含量的影响Figure 2 The effect of EBR treatment on the tea polyphenols content in tea leaves under cold stress
2.3 低温胁迫下外源EBR预处理对茶树叶片中MDA含量的影响
由于低温胁迫下植物细胞膜上不饱和脂肪酸发生了膜脂过氧化过程,从而使细胞膜通透性加大,膜相分离产生大量丙二醛(MDA)。在对植物低温抗性的生理研究中,细胞内的MDA含量常作为衡量植物低温抗性强弱的指标之一,MDA含量越高,说明细胞膜受到的损伤越严重[20]。由图3可见,与对照相比,外源EBR常温处理(EBR)后的茶树叶片内MDA含量显著降低了15.65%(P<0.05),但在单一低温处理(Cold)后MDA含量又比对照明显提高了19.49%(P<0.05)。然而,与单一低温处理(Cold)相比,经外源EBR和低温前后复合处理(Cold + EBR)的茶树叶片内的MDA含量显著减少(P<0.05),降幅达21.79%(图3)。因此,外源EBR预处理能够减少低温胁迫导致的MDA含量过度积累,从而有效缓解膜脂过氧化过程对细胞膜的损伤。
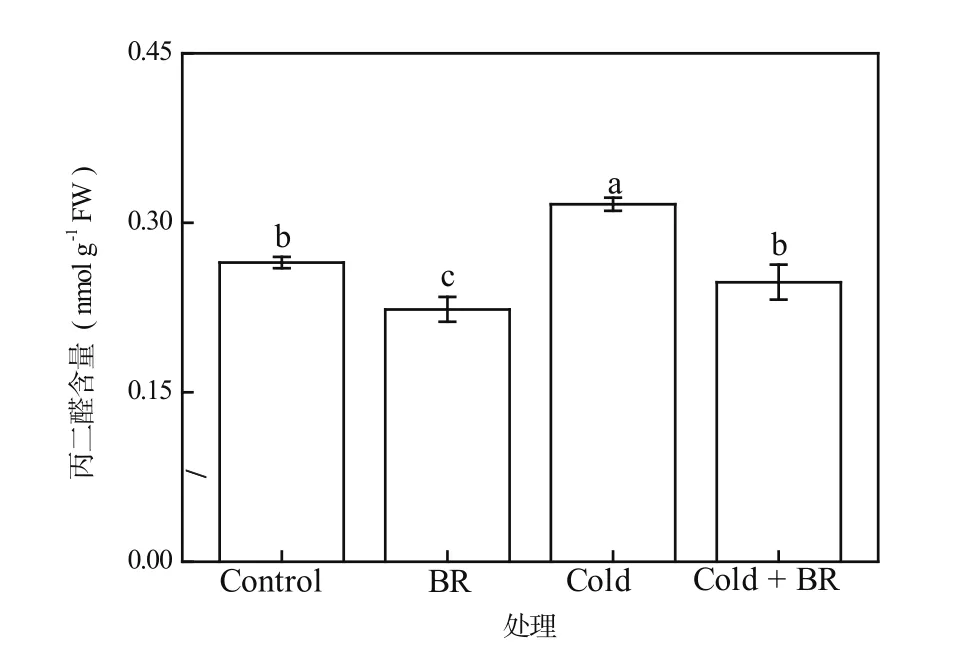
图3 EBR对低温胁迫下茶树叶片中MDA含量的影响Figure 3 The effect of EBR treatment on the MDA content in tea leaves under cold stress
2.4 低温胁迫下外源EBR预处理对茶树叶片中抗氧化酶活性的影响
本研究对抗氧化酶系统中的4种关键酶的活性进行了研究,即超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)及抗坏血酸过氧化物酶(APX)。由图4B和图4D可知,外源EBR常温处理(EBR)可显著提高细胞内POD和APX活性(P<0.05),与对照相比分别提高了15.00%和14.08%,而常温处理(EBR)对SOD和CAT活性的提高则不显著。经低温胁迫(Cold)后,与对照相比,茶树叶片内SOD的活性显著降低了13.16%(P<0.05),而POD、CAT、APX活性稍有下降但响应不显著。但与单一低温处理相比,经外源EBR和低温胁迫复合处理(Cold + EBR)后茶树叶片中SOD活性提高了8.41%,但未达显著水平;而APX、POD、CAT活性则显著提高(P<0.05),分别提高了27.85%、35.32%和124.94%,其中对CAT活性的提高最为显著。可见,在茶树受到低温胁迫后外源EBR预处理能够在不同程度提高茶树叶片中抗氧化酶活性,从而增强抗氧化酶系统对活性氧自由基的清除能力。

图4 低温胁迫下外源EBR预处理对茶树叶片中抗氧化酶活性的影响Figure 4 The effect of EBR treatment on antioxidant enzymes activity in tea leaves under cold stress
2.5 低温胁迫下外源EBR预处理对茶树叶片茶多酚合成基因表达量的影响
茶多酚中的主要成员类黄酮是大多数氧自由基的清除剂,能减少MDA的产生[21]。在类黄酮合成途径中,苯丙氨酸解氨酶(PAL)、肉桂酸羧化酶(C4H)、查尔酮异构酶(CHI)、查尔酮合成酶(CHS)是研究较多的关键酶[22]。在本试验中,茶树经外源EBR常温处理(EBR)后,C4H和CHS的基因表达量显著上调(P<0.05),与对照相比分别上调了24.32%和166.75%,而PAL和CHI的表达量略有上调但不显著(图5)。在受到低温胁迫(Cold)后,茶树叶片中C4H、CHS、CHI的表达量无显著变化,而PAL的表达量显著上调(P<0.05),比对照上调了78.24%。与低温胁迫单独处理(Cold)相比,经外源EBR和低温胁迫复合处理(Cold + EBR)后PAL、CHI、CHS的表达量显著上调(P<0.05),分别上调了56.10%、98.27%和448.45%,仅有C4H表达量的上调未达显著水平。可见,外源EBR能调控茶多酚合成关键基因的表达,不同程度地上调了PAL、CHI、CHS和C4H的表达量,从而提高茶树叶片中茶多酚含量。
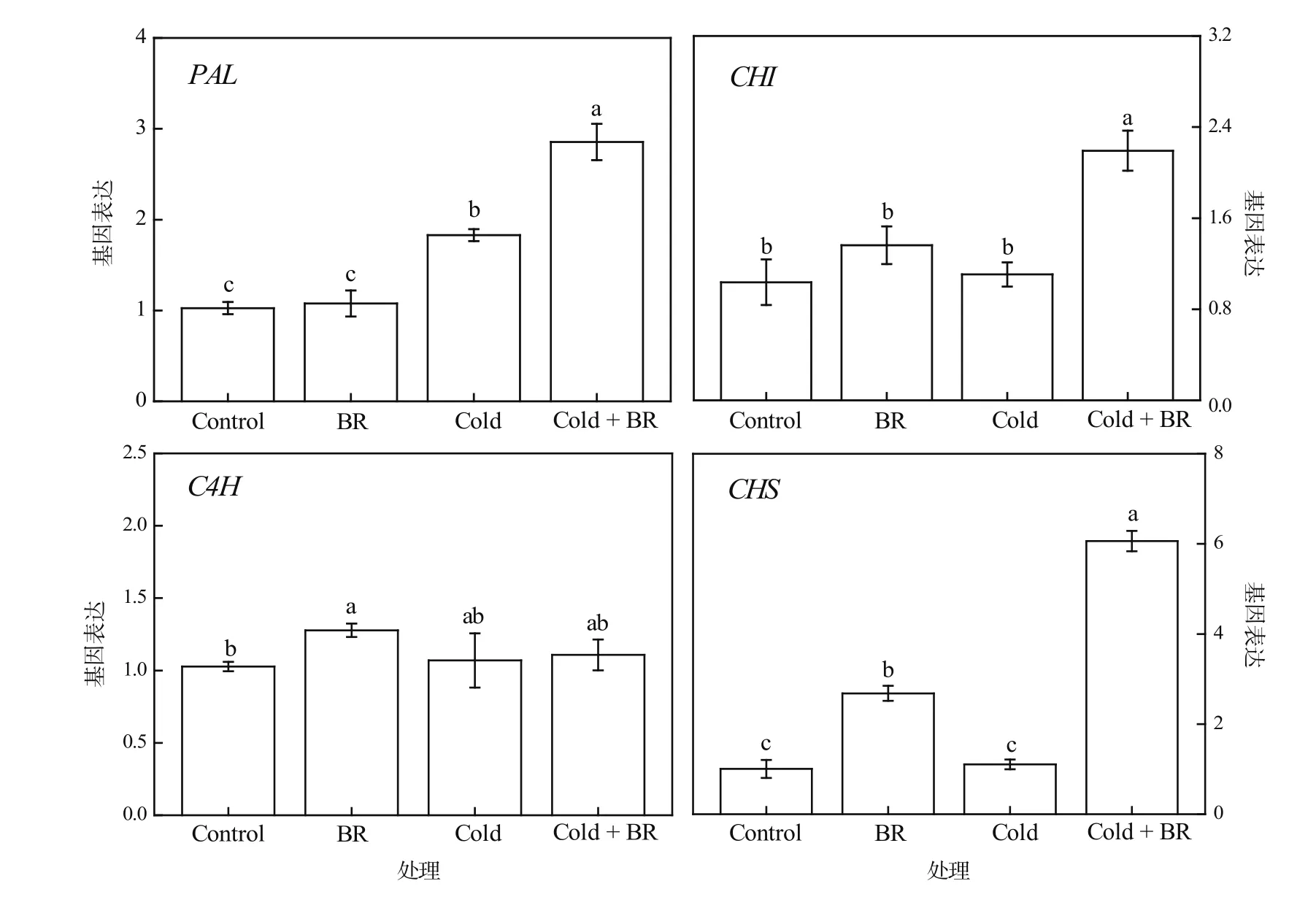
图5 低温胁迫下外源EBR预处理对茶树叶片中茶多酚合成基因表达量的影响Figure 5 The effects of EBR treatment on the gene expression of tea polyphenols synthesis in tea leaves under cold stress
3 讨论
茶树生长的适宜温度为20℃ ~ 25℃,当温度低于15℃时其新梢生长减缓;而当温度低于-6℃时,茶树将会严重受害[23]。低温胁迫可通过诱导膜脂过氧化等过程影响植物的逆境响应。在非逆境条件下植物体内自由基的产生与清除处于动态平衡,而在逆境条件下这种平衡会被打破,大量自由基的产生会使植物受到损伤[20]。油菜素内酯(BR)被认为可以提高植物对低温胁迫的耐受性。在对辣椒[24]、棉花[25]、黄瓜[7]等园艺作物的研究中已发现,BRs能够显著增加植物抗氧化物酶活性及抗氧化物质的含量,从而提高作物的抗逆性。本研究的结果表明,低温处理后,茶树叶片细胞内H2O2和O2-·含量明显提高;而在外源EBR预处理后,低温胁迫下茶树叶片细胞内H2O2和O2-·含量显著减少(图1)。这说明外源EBR预处理能有效清除低温胁迫下茶树细胞内活性氧自由基的累积,减轻活性氧(ROS)带来的氧化胁迫。同时,低温下ROS积累对生物膜造成的损伤还会启动脂质过氧化反应,使膜内脂双分子层中含有的不饱和脂肪酸链降解,从而破坏了细胞膜的完整性,使过氧化产物MDA积累,电解质外渗,严重时可造成细胞死亡[26]。王英姿等[27]的研究也发现H2O2和O2-·的积累可能激发了MDA的大量产生。在本研究中,外源EBR处理能显著降低低温胁迫后茶树叶片细胞内过度积累的MDA含量(图3)。这表明,在EBR预处理的条件下低温胁迫导致的茶树叶片细胞膜受到的ROS损伤得到缓解,从而抑制茶树叶片的膜脂过氧化过程。该结果与辣椒[24]和葡萄[27]等方面的相关研究结论一致,即低温胁迫下EBR预处理能够保护作物细胞膜结构的完整性。
低温胁迫下植物体内活性氧自由基的积累受多方面因素调控,主要包括抗氧化酶和非酶类抗氧化物质,其中抗氧化物酶在保护作物免受ROS积累导致的氧化胁迫中发挥着重要作用[26]。在本研究中,茶树遭受低温胁迫后抗氧化物酶活性受到不同程度的抑制(图4),且SOD活性更易受到低温抑制,对超氧阴离子的清除能力明显降低,导致茶树叶片内ROS大量积累。而低温下外源EBR预处理后茶树叶片中抗氧化物酶活性均得到提升,POD、CAT、APX的活性显著增强,且CAT活性的增幅高达124.94%,说明叶片细胞对H2O2的清除能力大幅度提高。这与高山离子芥[28]和甘薯[29]等作物中的研究结论基本一致。这说明外源EBR能够通过增强茶树的抗氧化酶活性来清除低温胁迫下细胞内过度积累的ROS,有效地缓解低温胁迫对茶树造成的氧化胁迫。
在茶树叶片中,类黄酮等多酚类物质也发挥着重要的抗氧化作用,其抗氧化能力是人工合成抗氧化剂的4 ~ 10倍,且在茶叶中的含量远超其他植物。张建忠等研究发现,茶多酚具有清除自由基的抗氧化效果[19]。本研究结果表明,低温胁迫下外源EBR预处理能显著提高茶树叶片中茶多酚的含量(图2)。基因表达数据显示,低温胁迫下外源EBR预处理能诱导PAL、CHI、CHS的表达量显著上调,且CHS的表达量增幅高达448.45%。在类黄酮合成代谢的早期阶段,PAL、C4H、4CL等关键酶催化苯丙氨酸反应生成香豆酰-CoA,CHS则将香豆酰-CoA和丙二酰-CoA共同催化转变为查尔酮,之后查尔酮被CHI催化生成的柚皮素是所有类黄酮物质合成的直接前体[22]。因此,低温胁迫下外源EBR预处理能显著上调类黄酮合成代谢关键基因的表达量,促进了类黄酮含量的提高,从而进一步提升了茶树在低温下的抗氧化能力。
此外,研究还发现,在正常温度下喷施EBR对茶树的抗氧化物酶活性、茶多酚含量的增幅均明显低于在低温胁迫下喷施EBR的效果。这说明EBR可能在维持ROS的形成与消除的动态平衡中担任着重要角色,这与杨萍等[24]的研究结果一致。然而,在低温胁迫下外源EBR调控茶树抗氧化酶活性和类黄酮合成相关基因表达的分子机制及其信号途径,还有待进一步研究。
综上,本研究表明外源EBR能够有效缓解低温胁迫对茶树造成的氧化胁迫。这主要是由于外源EBR预处理能够显著增强茶树叶片中抗氧化酶系统(SOD、POD、CAT、APX)的活性,从而提高茶树对活性氧自由基的清除能力,降低MDA的含量,保护细胞膜的完整性,在一定程度上缓解了低温胁迫下活性氧对茶树细胞膜的损伤。此外,本研究还发现,外源EBR预处理还能通过诱导类黄酮合成途径中关键基因(PAL、CHI、CHS、C4H)表达量的上调,促进叶片中茶多酚等抗氧化物质的积累,从而增强了低温下茶树的抗氧化能力。因此,外源EBR预处理能够通过平衡茶树叶片中活性氧自由基的产生与清除,最终有效缓解低温胁迫对茶树的伤害,增强茶树对低温胁迫的耐受性。

