基于化学动力学疗法的联合治疗在肿瘤中的研究进展
康瑞芳,田启威,2,杨仕平*
(1.上海师范大学化学与材料科学学院,上海 200234;2.上海健康医学院上海市分子影像学重点实验室,上海 201318)
0 引言
目前,癌症是全球第二大死因,严重威胁了人类的生命和健康[1].由于肿瘤独特的病理生理学特征和可预测的耐药性,常规的癌症疗法,如化学疗法(CT)、放射疗法和免疫疗法在彻底根除肿瘤细胞方面并不成功[2].因此,需要开发不同的策略,以改进这些传统的治疗方法,提高治疗的效率,还可以减少治疗的副作用[3].
化学动力学疗法(CDT)是一种新兴的治疗方法,通过肿瘤微环境(TME)激活的芬顿或类芬顿反应,将内源性过氧化氢(H2O2)转化为羟基自由基(·OH),以杀死癌细胞.它不仅突破了光触发疗法的穿透深度不够深的缺点,而且还提供了将化学方法与癌症治疗联系起来的更多可能性[4].由于体内温和的酸性pH值、低H2O2含量,以及TME中过表达的还原物质严重抑制了CDT效率,近几年基于CDT的联合治疗策略得到了广泛的发展.以CDT为基础的联合治疗是指CDT协同其他癌症治疗方法,例如光热疗法(PTT)、CT、声动力疗法(SDT)、饥饿疗法和光动力疗法(PDT),产生抗癌作用.这种联合疗法可以降低个体药物相关毒性,显著提高治疗效率[5].本文作者首先介绍了TME,然后提出CDT所面临的问题,接着再介绍基于CDT的联合治疗策略.
1 TME
肿瘤的发生是一个复杂而动态的过程,涉及不同的细胞和非细胞元素组成的TME[6].TME由癌细胞和非癌细胞、细胞外基质、可溶性因子和血管形成.细胞、基质、可溶性因子和血管之间的相互作用产生了这种复杂的异质微环境.TME在代谢上对肿瘤生长可能有益或无益,对肿瘤细胞产生的有效免疫反应也可能有利或不利,甚至可能有利于劫持免疫系统以促进肿瘤生长的条件[7].
TME组成复杂、性质独特,与肿瘤细胞的生长、侵袭和转移密切相关.TME具有特殊的生理特征,例如缺氧,谷胱甘肽(GSH)和H2O2的过度表达,以及温和的酸性.改变TME的氧化还原平衡和增加氧化应激可以相应地提高肿瘤治疗的功效[8].
2 CDT
ZHANG等[9]于2016年首次提出CDT是一种新的癌症治疗策略,定义为使用芬顿或类芬顿反应在肿瘤区域产生·OH的治疗.如图1所示,合成了一种非晶态铁纳米粒子(AFeNPs),利用TME中温和的酸性和过量产生的H2O2,AFeNPs可通过在肿瘤中诱导芬顿反应来用于癌症治疗.AFeNPs的电离使肿瘤按需释放亚铁离子,随后H2O2歧化导致高效的·OH生成.在AFeNPs存在的情况下,内源性反应刺激了·OH的产生,使高度特异性的癌症治疗成为可能,而不需要外部能量的输入.CDT由TME中的内源性化学能触发,与其他治疗方式相比,CDT具有肿瘤特异性、选择性高、全身副作用少、无需外部刺激等显著优势.然而,温和的酸性pH值、低H2O2含量,以及TME中过表达的还原物质严重抑制CDT效率[10],这些局限性使单纯的CDT难以完全消除恶性肿瘤.

图1 AFeNPs的作用机理图
3 基于CDT的联合治疗
虽然已经提出了各种策略来改善CDT的性能,比如降低TME的pH值,减少GSH的水平,增加H2O2的水平[11-13],但其局限性仍然很难达到令人满意的治疗效果,因此CDT目前仍是一种辅助治疗.CDT与其他治疗方法联合使用可产生明显的协同作用,增强CDT的杀伤作用,减少CDT药物的副作用.目前,CDT/PTT、CDT/PDT、CDT/CT、CDT/饥饿疗法和CDT/SDT等多种肿瘤联合治疗方法被广泛报道,取得了满意的治疗效果[5].
3.1 CDT/PTT
PTT是一种有效的肿瘤消融治疗方法,是在近红外(NIR)激光照射下,利用光热剂产生热疗,热疗不仅能对癌细胞造成损伤,还能通过加速类芬顿反应促进活性氧(ROS)的产生,从而实现CDT/PTT协同作用[14].因此,开发具有光热效应的CDT试剂具有十分重要的意义.LIU等[15]提出了一种容易合成的碳化钼(Mo2C)衍生的多金属氧酸盐(POM)作为PTT/CDT双试剂,如图2所示.获得的POM簇在温和的酸度下自组装,导致近红外二区(NIR-Ⅱ)吸收增强(1 060 nm),并通过增强的通透性和保留效应(EPR)在肿瘤中积累.与常用的近红外一区(NIR-Ⅰ)(808 nm)相比,NIR-Ⅱ为深部肿瘤治疗提供了更好的组织穿透性.值得注意的是,当五价钼(Mo5+)氧化为六价钼(Mo6+)Mo6+,导致大量有毒的单线态氧(1O2)的产生,这可能是Russell机制的作用.此外,CDT过程通过光热转换加强,并由GSH耗竭维持.在体内NIR-Ⅱ光声成像的引导下,PTT/CDT联合治疗在肿瘤切除和预防肿瘤复发方面具有良好的疗效.

图2 POM纳米粒子的制备和作用机理
基于此,CDT与PTT结合可以产生显著的协同作用,这可能是由于温度的升高提高了芬顿/类芬顿反应的催化效率,从而提高了对恶性肿瘤的治疗效果.
3.2 CDT/PDT
PDT利用光敏剂将光的能量传递给周围的分子氧(O2),产生有毒的ROS,特别是1O2,导致细胞膜通透性增加,进而干扰细胞的正常功能.但由于肿瘤组织缺氧和光穿透受限,PDT在一定程度上表现出治疗不足.因此,将PDT与CDT结合起来是非常有必要的[16-18].CDT可以将肿瘤内源性H2O2转化为毒性·OH,摧毁肿瘤细胞,从而在一定程度上弥补了PDT依赖O2的局限性.
LEI等[19]报告了一种结合PDT/CDT的卟啉-二茂铁(TNCF)治疗剂,如图3所示.根据芬顿反应,二茂铁(FC)与H2O2反应生成·OH,可以有效杀伤肿瘤细胞.然而,肿瘤细胞内的GSH会消耗·OH,从而抑制CDT.此外,5-(4-氨基苯基)-10,15,20-三苯基卟啉(TPP-NH2)的PDT产生的1O2会降低GSH的水平,显示出协同治疗的效果.获得的TNCF可被细胞很好地内化,并在体内消耗GSH,从而提高CDT的有效性.

图3 TNCF在癌症治疗中的(A)制备和(B)作用机理图
3.3 CDT/CT
CT是癌症治疗中最广泛使用的方法之一[20].然而,CT对人体的潜在毒副作用仍然不容忽视[21].CDT与CT联合使用具有显著的协同作用,不仅可以减少药物的副作用,而且可以缓解肿瘤缺氧环境,提高CDT效率[22].GAO等[23]设计了一种钴基金属-有机框架(ZIF-67)内负载阿霉素(DOX)和过氧化钙(CaO2)的纳米催化药物(CaO2@DOX@ZIF-67),其合成过程和在肿瘤细胞中增强联合CDT/CT的示意图如图4所示.首先用PEG-200作为溶剂和模板制备氧化钙纳米颗粒.然后通过DOX与Ca的配位作用将DOX包覆在CaO2表面形成CaO2@DOX.为了进一步隔离和保护CaO2@DOX免受外界水的影响,最后采用原位合成方法在CaO2@DOX表面构建了ZIF-67.这就产生了pH响应纳米催化药物CaO2@DOX@ZIF-67.最外层的ZIF-67层由于其对pH的敏感性,在肿瘤的酸性环境中会被分解,导致Co2+和DOX的快速释放。同时,未受保护的CaO2会与水反应生成O2和H2O2.生成的H2O2会被Co2+离子进一步催化,通过类芬顿反应产生剧毒的·OH,而生成的O2会通过缓解肿瘤缺氧条件来提高DOX的功效.因此,该纳米催化药物为提高CT/CDT联合治疗的有效性提供了一种新的策略.
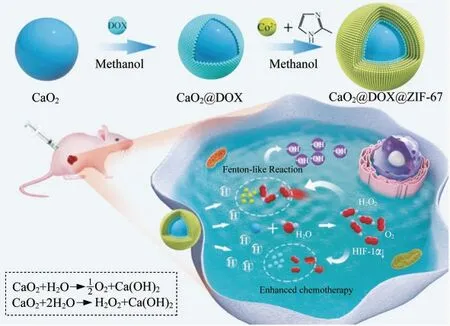
图4 CaO2@DOX@ZIF-67合成过程和在肿瘤细胞中增强联合CDT/CT的示意图
因此,CDT与CT联合使用具有显著的协同作用,可实现满意的治疗效果,具有广阔的应用前景.
3.4 CDT/SDT
SDT利用超声(US)激活声敏剂产生毒性ROS[24],作为一种无创治疗方式,在疾病治疗中显示了巨大的潜力[25].超声作为一种典型的无创辐射源,由于其组织衰减系数低,可以穿透到身体组织的深处,能量损失不明显[26].更重要的是,它仅能在其焦点处激活声敏剂,具有较高的空间精度,从而保证了SDT即使在治疗深部组织肿瘤时的生物安全性[27].因此,SDT与CDT联合应用可产生明显的协同作用,提高深部肿瘤的治疗效率.
LEI等[28]采用高温方法制备了一种新型的声敏剂——掺铁(Fe)的二硫化钒(VS2)纳米片,用于增强声动力治疗癌症,如图5所示.经聚乙二醇(PEG)修饰后,得到的Fe-VS2-PEG纳米片(Fe-VS2-PEG NSs),其具有良好的生物相容性.由于电子-空穴再结合时间的延长,Fe-VS2-PEG NSs的声动力效应大大增强.由于Fe的掺杂,这种Fe-VS2-PEG NSs同时具有良好的芬顿效应作用于CDT.此外,多价铁和钒元素可以通过SDT和CDT有效地消耗GSH来扩增ROS诱导的氧化应激.由于VS2具有高的近红外吸收和Fe掺杂诱导的磁共振(MR)对比,因此体内光声(PA)/MR多模态成像可以显示静脉注射后Fe-VS2-PEG NSs的肿瘤聚集.Fe-VS2-PEG NSs作为一种有效的声敏剂,具有良好的芬顿催化性能和较强的GSH消耗功能,可用于CDT/SDT联合治疗,在体外细胞实验和体内动物实验中均显示出良好的疗效。值得一提的是,大部分的Fe-VS2-PEG NSs可以逐渐降解并从体内清除,在体内没有明显的长期毒性.

图5 Fe-VS2-PEG NSs合成及在肿瘤联合治疗中的生物应用示意图
3.5 CDT/饥饿疗法
肿瘤组织的过度生长离不开葡萄糖、氧气等大量营养物质所提供的能量.因此,切断这种连接是限制癌细胞持续增殖的有效手段,这种治疗称为细胞饥饿治疗[29].D-葡萄糖是正常细胞和癌细胞最重要的能量来源之一,Warburg效应已经证明肿瘤细胞对其浓度的变化更为敏感.近年来的研究表明,通过葡萄糖氧化酶(Gox)消耗或切断D-葡萄糖的供应是一种较为有效的细胞饥饿治疗实现方法.Gox催化葡萄糖生成H2O2和葡萄糖酸,可用于加速芬顿反应进程[30].此外,肿瘤中葡萄糖水平的升高有助于增加H2O2的选择性生成,从而减少对正常组织的非特异性氧化损伤[31].值得注意的是,Gox和芬顿反应的完美结合成为一种很有前途的抗肿瘤策略,用于葡萄糖引发的饥饿治疗和CDT.
WANG等[32]通过共沉淀法将Gox封装在金属有机骨架材料ZIF-8中,ZIF-8为配位金属是Zn,配体是2-甲基咪唑的金属有机骨架材料,然后在其表面装饰二氧化锰(MnO2)纳米颗粒,如图6所示.为了进一步增强材料的生物性能,选择表面活性剂F127对材料表面进行改性,生成F127-MnO2-ZIF-8@Gox纳米复合材料.在肿瘤细胞中,MnO2纳米粒子首先与过表达的GSH反应生成二价锰离子(Mn2+),Mn2+引发类芬顿反应,催化H2O2生成·OH.同时,Gox能降解肿瘤细胞必需的营养物质D-葡萄糖,释放·OH的前体——H2O2和葡萄糖酸,导致癌细胞饥饿.体外实验测量进一步证明了MnO2修饰的ZIF-8@Gox具有显著的杀伤癌细胞的性能.将饥饿治疗与CDT结合,不仅切断了癌细胞的能量来源,而且在饥饿治疗过程中降低pH值,产生H2O2,有利于CDT,从而产生显著的协同效应.

图6 F127-MnO2-ZIF-8@Gox纳米复合材料的制备及该材料在细胞内实现增强CDT和细胞饥饿治疗过程的示意图
4 结论与展望
传统的癌症治疗技术(如化学治疗)有很大的副作用,容易导致耐药性的出现,使癌症治疗失败.因此,探索和开发更有效、更简单的癌症治疗方法具有非常重要的研究意义和临床价值.CDT作为一种基于芬顿/类芬顿反应的新型肿瘤特异性治疗技术,具有高特异性和敏感性的临床转化潜力,引起了研究者们的广泛关注.本文作者系统总结了CDT/PTT、CDT/PDT、CDT/CT、CDT/饥饿治疗和CDT/SDT等多种抗肿瘤协同治疗策略,从而减少相关副作用,显著提高疗效.CDT纳米材料在不同生物医学领域的应用研究表明,这些纳米材料具有广阔的应用前景,并能进一步推动基于CDT的生物医学的临床转化.

