极早产儿脐血IL-6、IL-8、TNF-α与胎儿炎症反应综合征的相关性分析*
徐 丽,招 倩,罗海莲,陈 蔺,唐文燕
江西省妇幼保健院新生儿科,江西南昌 330006
早产儿多与感染有关,孕妇在感染的刺激下可致组织中炎症因子的释放和前列腺素的产生,会引起胎儿炎症反应综合征(FIRS)[1]。FIRS是胎儿固有免疫系统被激活的一种亚临床状态,是全身炎症反应综合征(SIRS)在胎儿时期的一种特殊表现。有研究者在SIRS的基础上首先提出了FIRS,即胎儿脐血中白细胞介素(IL)-6≥11 pg/mL可诊断为FIRS,脐带炎和绒毛膜羊膜炎是FIRS的组织病理学诊断指标[2-3]。引起FIRS的因素主要有感染及缺氧等,而上述因素在致病过程中均有炎症细胞因子参与。在临床上,判断早产儿是否存在宫内感染的检测指标如白细胞计数及其分类、C反应蛋白、血培养、痰培养等灵敏度和特异度不足且易造成医源性失血,也易造成抗菌药物滥用。另外,胎盘、脐带等组织的病理学检查,虽然能直接诊断宫内炎性反应情况,但是不方便留取标本,操作复杂,且耗时长,不能及时指导临床用药,所以不能作为临床早期判断的客观指标。脐带血可避免标本采集困难、早产儿出生后采血困难、出生后治疗影响炎症细胞因子检测结果等弊端[4]。目前,虽然有研究对早产儿的IL-6、IL-8、肿瘤坏死因子-α(TNF-α)水平展开分析,并探索这3项指标和FIRS之间的关系,但在极早产儿领域内,这一研究还相对少见。鉴于此,本研究旨在分析极早产儿脐血IL-6、IL-8、TNF-α是否能很好地反映极早产儿在宫内临产前的感染情况,以及FIRS与极早产儿结局的相关性,从而帮助极早产儿科临床医生对极早产儿出生后的诊断及治疗做出准确的判断,现报道如下。
1 资料与方法
1.1一般资料 回顾性选取2019年12月至2021年12月在江西省妇幼保健院分娩的120例胎龄<32周的极早产儿为研究对象,本次研究的样本量根据横断面调查计算所得。研究对象根据有无发生FIRS分为发生FIRS组32例和未发生FIRS组88例。本研究获得医院伦理委员会批准。纳入标准:(1)在江西省妇幼保健院出生且出生后即入住极早产儿重症监护病房(NICU)救治;(2)胎龄<32周极早产儿且均为活胎;(3)极早产儿产妇资料完整;(4)研究前已告知研究对象家属本次研究内容、方法等,且极早产儿产妇自愿将其临床资料用于本次研究,积极参与配合。排除标准:(1)产妇及极早产儿临床资料不完整;(2)产妇及极早产儿存在血液疾病。
1.2资料收集 (1) 极早产儿围生期基本信息:性别、胎龄、出生体重、出生方式、1 min 和 5 min阿普加量表评分、是否有创机械通气、产妇产前糖皮质激素使用情况和产妇妊娠高血压、妊娠糖尿病、分娩时胎膜早破情况和其时间、羊水、产妇发热情况及B族链球菌筛查结果(GBS)和其分泌物培养情况;(2)收集极早产儿并发症等相关信息:早期并发症如肺炎、呼吸窘迫综合征、呼吸衰竭、早发型败血症;远期并发症如肺炎、支气管肺发育不良、坏死性小肠结肠炎、脑室内出血/脑室周围脑白质软化(IVH/PVL)、早产婴儿视网膜病变。
1.3诊断标准 产科疾病是依据文献[5]进行的疾病诊断。极早产儿疾病的诊断标准均参照文献[6]。FIRS诊断标准:母体发热,体温≥38 ℃,兼有下列1种或以上情况:母体心动过速(>100次/分);胎心心动过速(>160次/分),子宫紧张有压痛、羊水有臭味、末梢血白细胞计数>15.0×109/L、脐带组织病理学检查高倍镜下中性粒细胞浸润≥5~10个。
1.4方法
1.4.1实验室指标检测方法 (1)脐血细胞因子检测方法:在极早产儿出生后为其断脐,取脐带血3 mL,靠近胎盘端,将采集标本置于干净试管内,于室温下静置约30 min,待其凝固,以3 000 r/min进行离心处理,时长15 min,分离上清液,将其置入低温冰箱内保存待检,选择试剂盒,采用酶联免疫吸附法检测IL-6、IL-8及TNF-α水平。(2)脐带组织病理学检查方法:观察脐带一般情况(长度、直径、颜色、脐带与胎盘位置等)、脐带组织切片取材(在距离脐带胎盘段5 cm处切断,取2~4 cm,将其置于4%中性甲醛中固定过夜,待检)。(3)所有研究对象在出生后24 h内均完善血清非特异性炎性指标检测,包括白细胞计数、C反应蛋白及降钙素原(PCT)水平。
1.4.2治疗方法 两组极早产儿送至NICU后实施经鼻持续气道正压通气治疗,通气压力是6~8 mm Hg。出生5 h内,实施心脏彩超检查及胸透,密切观察两组极早产儿心跳、呼吸、体温、血氧饱和度,结合其情况决定无创呼吸支持使用时间,停用之后改为低流量吸氧,结合观察指标将氧疗逐渐停止。
1.5观察指标 (1)统计极早产儿FIRS发生率并比较两组脐血IL-6、IL-8、TNF-α水平。(2)两组极早产儿出生后24 h非特异炎性指标增高率比较,增高标准:白细胞计数在24 h后持续性20×109/L,CRP>8 mg/dL,PCT在分娩后3 d超过5 ng/mL。(3)对比两组极早产儿的性别、胎儿宫内窘迫情况,对比产妇年龄、发热、妊娠期高血压分娩情况,比较分娩时胎膜早破、羊水异常、GBS感染、胎盘早剥发生情况,并以组间有差异性因素作为自变量,对FIRS发生多因素进行分析。(4)对两组近期并发症和远期并发症情况进行分析。
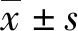
2 结 果
2.1极早产儿FIRS发生率及两组脐血IL-6、IL-8、TNF-α水平情况 120例极早产儿中32例发生FIRS,发生率为26.67%。未发生FIRS组脐血IL-6、IL-8、TNF-α明显低于发生FIRS组,差异有统计学意义(P<0.05)。见表1。

表1 两组脐血IL-6、IL-8、TNF-α水平比较
2.2两组出生后24 h内非特异炎性指标增高率比较 发生FIRS组出生后24 h内WBC、CRP及PCT水平增高率明显高于未发生FIRS组,差异有统计学意义(P<0.05)。见表2。

表2 两组出生后24 h非特异炎性指标增高率比较[n(%)]
2.3FIRS发生单因素分析 发生FIRS组产妇分娩时胎膜早破、羊水异常、胎盘早剥、发热、妊娠高血压发生率及极早产儿胎儿宫内窘迫发生率均明显高于未发生FIRS组,差异有统计学意义(P<0.05)。见表3。
2.4FIRS发生多因素分析 以FIRS是否发生作为因变量,对下述自变量进行赋值:IL-6高赋值为1,低赋值为0;IL-8高赋值为1,低赋值为0;TNF-α高赋值为1,低赋值为0;胎膜早破“有”赋值为1,“无”赋值为0;产妇发热“有”赋值为1,“无”赋值为0;羊水异常“有”赋值为1,“无”赋值为0;妊娠高血压“有”赋值为1,“无”赋值为0;胎儿宫内窘迫“有”赋值为1,“无”赋值为0;胎盘早剥“有”赋值为1,“无”赋值为0。多因素分析可见:IL-6、IL-8及TNF-α水平及胎膜早破、胎儿宫内窘迫、胎盘早剥、产妇发热、羊水异常、妊娠高血压均是极早产儿发生FIRS的独立危险因素(P<0.05)。见表4。

表3 FIRS发生单因素分析
2.5FIRS与极早产儿近期并发症的关系 发生FIRS组极早产儿出生后肺炎、呼吸衰竭、早发型败血症发生率高于未发生FIRS组,差异有统计学意义(P<0.05)。见表5。
2.6FIRS与极早产儿远期并发症的关系 发生FIRS组极早产儿远期并发症总发生率明显高于未发生FIRS组,差异有统计学意义(P<0.05)。见表6。

表4 FIRS发生多因素分析

表5 FIRS与极早产儿近期并发症的关系[n(%)]

表6 FIRS与极早产儿远期并发症的关系
3 讨 论
尽管在过去的几十年,NICU取得了持续的发展,但早产儿的存活率依然是极早产儿科医生和早产儿家庭极其关注的问题,其中特别是极早产儿的存活率得到了较大的提升[7-9]。极早产儿是指妊娠达到28周但不足32周分娩者,出生孕周越小,极早产儿体重越轻,预后越差,同时会增加胎儿死亡风险[10-11]。而研究发现很多早产的原因是孕妇受到感染,使机体产生宿主反应,导致胎儿发生炎性反应,进而引起早产[12]。本次研究回顾性选取2019年12月至2021年12月在江西省妇幼保健院分娩的120例胎龄<32周的极早产儿作为研究对象。经对比发现,IL-6、IL-8及TNF-α均与FIRS有关,且这些指标的异常升高,是FIRS发生的独立危险因素。提示脐血细胞因子与FIRS具有紧密联系。分析原因,这可能与各细胞因子的作用机制等因素有关。
钟树林等[13]报道IL-6、IL-8、TNF-α与早产儿FIRS及预后密切相关,本研究结果和此结果一致。值得注意的是,钟树林等[13]研究选取的是早产儿,本研究选取的是极早产儿,极早产儿的危险程度更高,死亡风险更高,预后更差,对此类患儿的预后相关情况及炎症指标展开研究,可以填补极早产儿相关领域的研究空白,而且之所以能够取得这一结果,主要是由于以下原因:IL-6 是由单核型巨噬细胞和内皮细胞及T淋巴细胞等产生,也可导致机体发热,并且其对T、B两种类型的淋巴细胞的自身增殖、分化活动起到促进作用。因此,IL-6可产生抗体,并且有利于急性期蛋白的大量生成。IL-8又被称之为中性粒细胞激活蛋白,具有较强的趋化作用,能够诱导中心粒细胞改变形态,促使其释放胞内颗粒,能够促进中性粒细胞及T淋巴细胞快速达到感染部位,促使FIRS生成。此炎症细胞因子水平的升高,可证实FIRS的存在;而且IL-8水平越高,宫内感染的早产儿发生FIRS程度越严重[14]。TNF-α是由活化状态的单核巨噬细胞生成,对血管通透性具有促进作用,同时对补体等物质进入感染部位有促进作用,利于淋巴液引流[15]。当发生胎膜早破或者早产等情况时,羊水内TNF-α水平会明显上升,因此上述炎症细胞因子均可起到促进FIRS的功能,当发生炎症时,上述炎症细胞因子水平会进一步升高[16-17]。研究可见,脐血IL-6、IL-8及TNF-α水平变化,可反映出极早产儿在子宫内有无FIRS,上述相关炎症因子水平的高低可反映炎症感染程度,当母体血清中炎症细胞因子水平升高时,往往预示着胎儿在宫内发生母体炎性反应的风险增加[18]。
本研究发现,发生FIRS组极早产儿出生后肺炎、呼吸衰竭、早发型败血症发生率高于未发生FIRS组,发生FIRS组极早产儿远期并发症总发生率明显高于未发生FIRS组,差异有统计学意义(P<0.05)。当极早产儿发生FIRS时,机体中的炎症细胞因子水平明显升高,能够促进极早产儿细菌感染及败血症的发生,免疫功能降低,从而更易引起极早产儿近期、远期并发症[19-20]。当极早产儿在宫内遭受炎症细胞因子的刺激后,可从多方面对机体造成损害,包括直接损伤神经元、产生氧自由基、破坏血脑屏障、影响灌注、干扰凝血等,是极早产儿生后早期患病和死亡的重要影响因素,同时也对远期预后产生影响。
本研究还存在一定不足,主要体现在研究中选取的样本量较小。另外,本研究未根据研究对象的孕周细致化分组,在后续的研究中,可以进一步对其展开细致分组,并对IL-6、IL-8、TNF-α在FIRS中的作用机制展开深入分析,从而为极早产儿出生后因炎症引发相关疾病的治疗提供参考。
综上所述,极早产儿脐血IL-6、IL-8、TNF-α与FIRS发生密切相关,且极早产儿一旦出现FIRS,很可能会出现一些近期或远期并发症,进而对其生命安全造成威胁。因此,对极早产儿应尽早检测IL-6、IL-8、TNF-α等指标,以便及时发现FIRS,及时展开针对性的治疗,从而为其预后的改善提供支持。

