HBeAg和HBeAb共同阳性CHB患者血清HBV RNA表达水平及检测意义
刘潘婷,向 瑜,周红菊,陈 瀑
重庆医科大学附属第一医院检验科,重庆 400016
乙型肝炎病毒(HBV)血清学标志物的检测是乙型肝炎临床诊断和治疗的重要依据,其血清学模式仍是评价疾病状态的重要指标。随着实验室检测方法灵敏度的提高及抗病毒药物的广泛使用,HBV e抗原(HBeAg)和HBV e抗体(HBeAb)共存的特殊模式不断被检测出来[1-2],这种HBV特殊血清学模式给临床诊疗带来一定的困惑,对其研究有助于了解HBV感染状态,提高对慢性乙型肝炎(CHB)的诊疗水平。近年来研究发现,HBV感染者血清或血浆中存在HBV前基因组RNA(HBV RNA),HBV RNA是由感染肝细胞核内的共价闭合环状DNA(cccDNA)转录形成的部分前基因组RNA(pgRNA)不经过逆转录而直接获取病毒包膜蛋白分泌出肝细胞外产生,因此,血清HBV RNA水平能够反映cccDNA表达水平及其转录活性状态,HBV RNA作为一种具有潜在临床检测价值的新指标成为研究热点。有研究显示血清HBV RNA与HBV感染状态、HBeAg血清学转换、治疗和预后等方面关系密切[3]。HBV RNA作为一种新的病毒学指标,目前少见其在HBV感染血清学特殊模式中的水平及其与传统血清学标志物相关性的研究。本文通过研究HBeAg和HBeAb共同阳性模式中血清HBV RNA表达水平及其在不同基因型中表达情况,同时分析HBV RNA与HBV DNA、HBV表面抗原(HBsAg)、HBeAg、丙氨酸氨基转移酶(ALT)和天门冬氨酸氨基转移酶(AST)的相关性,探讨其检测意义。
1 资料与方法
1.1一般资料 选取2018年5月至2020年12月在重庆医科大学附属第一医院门诊及住院进行治疗的且HBV血清学标志物检测中HBsAg、HBeAg、HBeAb、HBV核心抗体(HBcAb)均为阳性的CHB患者108例(A组)作为研究对象,其中男74例、女34例,年龄17~75岁、平均(40.90±13.69)岁。另选取同期在在重庆医科大学附属第一医院门诊及住院进行治疗的HBV血清学标志物检测中HBeAg阳性、HBeAb阴性的CHB患者45例(B组)和HBeAg阴性、HBeAb阳性的CHB患者33例(C组)作为对照。A组和B、C组患者均符合文献[4]的CHB诊断标准。排除标准:(1)合并其他肝炎病毒及艾滋病毒感染;(2)其他肝脏疾病(如自身免疫性肝炎、酒精性肝炎等);(3)近期使用免疫抑制剂治疗。研究方案经重庆医科大学伦理委员会批准。
1.2仪器与试剂 ARCHITECT系统i4000全自动化学发光免疫分析仪及血清HBsAg、HBV表面抗体(HBsAb)、HBeAg、HBeAb和HBcAb配套检测试剂购自美国雅培公司;Cobas c701全自动生化分析仪及血清ALT、AST配套检测试剂购自Roche公司;Cobas Z480荧光定量PCR仪购自Roche公司,HBV基因分型检测试剂盒购自宝瑞源生物技术有限公司;HBV核酸定量测定试剂盒(PCR-荧光探针法)购自湖南圣湘生物科技有限公司;HBV pgRNA(HBV RNA)测定试剂盒(PCR-荧光探针法)购自北京热景生物技术股份有限公司。
1.3方法
1.3.1HBV血清学标志物和肝功能相关指标检测 采集A组及B、C组患者外周血4 mL于促凝管,4 000 r/min离心6 min,收集血清,储存于-80 ℃冰箱,避免反复冻融。然后按试剂盒说明书,采用ARCHITECT系统i4000全自动化学发光免疫分析仪及配套试剂检测A组及B、C组患者血清HBsAg、HBsAb、HBeAg、HBeAb和HBcAb;采用Cobas c701全自动生化分析仪及配套试剂检测A组及B、C组患者血清ALT、AST水平。HBsAg的值为相应检测值以10为底所取对数。
1.3.2HBV基因分型检测 采用实时荧光PCR方法,在Cobas Z480荧光定量PCR仪检测A组及B、C组患者血清中感染HBV B、C、D 3种基因型。
1.3.3HBV DNA、HBV RNA载量检测 使用分离胶管上层血清,采用实时荧光定量PCR方法,按照HBV核酸定量测定试剂盒(PCR-荧光探针法)说明书在Cobas Z480荧光定量PCR仪上检测HBV DNA载量,单位为IU/mL;运用HBV pgRNA(HBV RNA)测定试剂盒(PCR-荧光探针法)在cobas Z480荧光定量PCR仪上检测HBV RNA载量,单位为copy/mL。HBV DNA、HBV RNA的值均为相应检测值以10为底所取对数。
1.4统计学处理 采用SPSS26.0统计软件进行数据分析。Shapiro-wilk检验及正态分布图判断数据是否符合正态性分布,非正态分布的连续变量以M(P25,P75)表示,两组间比较采用Mann-WhitneyU检验,相关性分析采用Spearman秩相关分析。多组间样本比较采用Kruskal-Wallis 非参数检验,检验水准α=0.05,组间两两比较检验水准经Bonferroni校正法调整为α=0.017。
2 结 果
2.1A组血清学指标和HBV基因分型比较 A组中血清HBV RNA为2.98(1.78,4.20)copy/mL,HBV DNA为5.38(4.20,6.46)IU/mL,HBsAg为3.42(3.04,3.79)IU/mL,HBeAg为3.46(1.69,8.36)S/CO,ALT为53.50(31.25,233.00)U/L,AST为55.00(29.00,201.25)U/L;HBV基因分型中,B基因型占69.44%(75/108),C基因型占18.52%(20/108),D基因型占3.70%(4/108),未分型占8.33%(9/108)。
2.2A组B、C基因型血清HBV RNA及HBV DNA水平比较 A组B基因型75例、C基因型20例、D基因型4例,B、C基因型血清HBV RNA及HBV DNA水平比较差异无统计学意义(P>0.05)。见表1。
2.3A组血清HBV RNA与其他血清学指标相关性分析 A组血清HBV RNA与HBV DNA、HBsAg、ALT、AST呈正相关(r=0.723,P<0.001;r=0.270,P=0.005;r=0.479,P<0.001;r=0.395,P<0.001),与HBeAg无相关(r=0.111,P=0.253)。

表1 A组B、C基因型血清HBV RNA与HBV DNA水平比较[M(P25,P75)]
2.43组患者血清HBV RNA与其他指标的相关性分析 3组中HBV RNA与HBV DNA呈正相关(P<0.05),在A、B组中HBV RNA与HBsAg呈正相关(P<0.05),在B组中HBV RNA与HBeAg呈正相关(P<0.05),在A和C组中HBV RNA与ALT、AST 呈正相关(P<0.05),见表2。
2.53组间血清学指标比较及组间两两比较 3组血清HBV RNA、HBV DNA、HBsAg、HBeAg、ALT、AST水平比较差异有统计学意义(P<0.05)。A组血清HBV RNA、HBV DNA、HBsAg、HBeAg、ALT、AST水平均明显高于C组,差异有统计学意义(P<0.017);A组血清HBsAg、AST水平均高于B组,A组血清HBeAg水平低于B组,差异有统计学意义(P<0.017);B组HBV RNA、HBV DNA、HBeAg水平均高于C组,差异有统计学意义(P<0.017)。见表3。
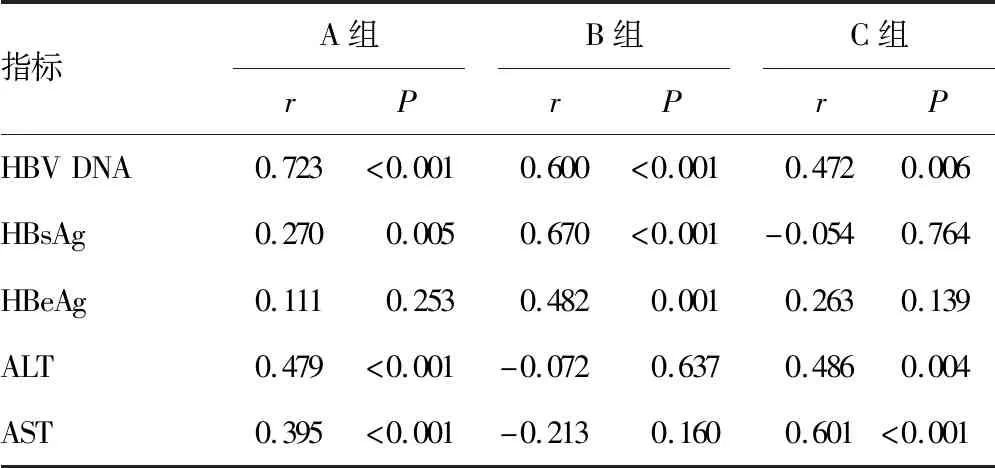
表2 3组患者血清HBV RNA与其他指标的相关性分析
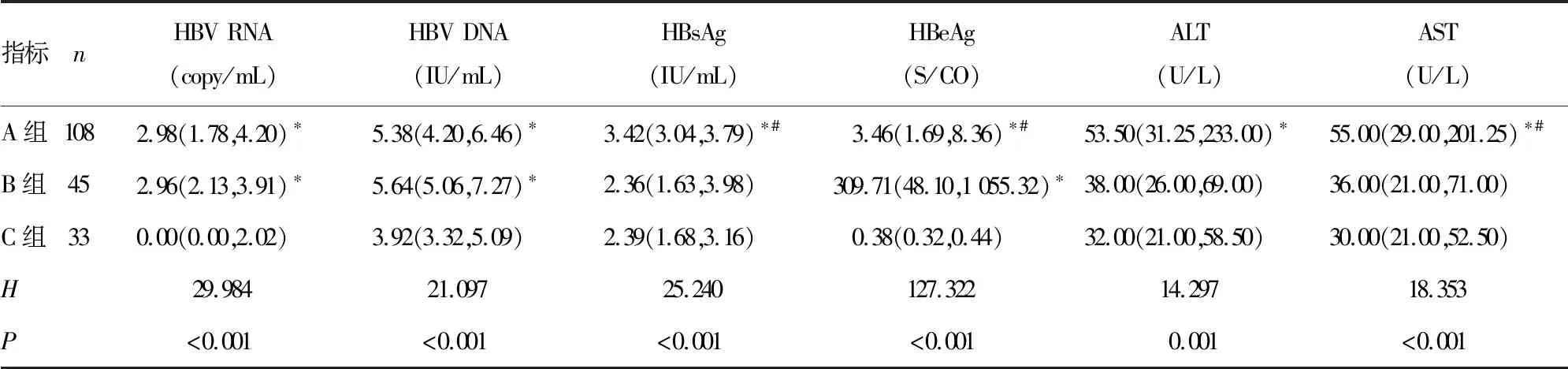
表3 3组间血清学指标比较[M(P25,P75)]
3 讨 论
HBV血清学标志物的检测仍是乙型肝炎临床诊断和治疗的重要依据,HBV抗原和抗体同时阳性的血清学特殊模式在临床及流行病学研究中不断被发现,HBeAg和HBeAb同时阳性是常见的特殊血清学模式之一,目前有研究报道HBeAg和HBeAb共存现象可能与血清学转换期、前核心区(PC)和(或)双基底核心启动子(BCP)突变导致HBeAg在转录或翻译阶段表达减少、病毒再活动期等因素有关[1-2],针对特殊血清学模式的研究有助于提高临床相应诊疗水平。
cccDNA是HBV复制的初始模板,HBV的持续复制依赖于可转录生成RNA的cccDNA,cccDNA是反映HBV感染和复制的直接证据,其在肝细胞核中长期存在是导致乙型肝炎慢性化和停药后复发的重要原因[5],清除cccDNA才表明乙型肝炎达到治愈,但cccDNA的检测由于需要肝组织穿刺活检,临床难以普遍开展。既往研究表明,血清HBV DNA和HBsAg与肝组织内cccDNA的活性呈正相关,因此被常规用于划分HBV感染的进程、确定治疗时间、观察药物疗效和停药时机等临床诊疗中,但随着对HBV的深入研究,特别是核苷及核苷酸类似物(NAs)等抗病毒药物广泛运用于临床以来,这些传统血清学指标已被证实有其局限性:血清HBV DNA的消失仅能代表病毒的逆转录过程被有效抑制,并不能真实反映肝细胞内cccDNA的转录活性状态[6];HBsAg由于来源的多样性,既可来源于cccDNA,也可来源于整合的HBV DNA片段[7-8],在反映肝细胞内cccDNA水平上也存在局限性。有研究证实HBV RNA是由感染肝细胞核内cccDNA转录形成的部分pgRNA不经过逆转录而直接获取病毒包膜蛋白分泌出肝细胞外产生,能够反映cccDNA转录活性状态,被认为是一种新型的潜在血清学标志物,可作为cccDNA的替代标志物来评估HBV复制及感染状态[9-10]。
有研究表明,HBV感染的不同时期血清HBV RNA水平和HBV DNA、HBsAg水平相关性不同,在HBeAg阳性的CHB患者中表现出相关性,而在HBeAg阴性患者中相关性弱或不相关[11-12]。本研究结果显示,A组血清HBV RNA与HBV DNA、HBsAg、ALT、AST呈正相关(r=0.723,P<0.001;r=0.270,P=0.005;r=0.479,P<0.001;r=0.395,P<0.001);在A、B组中HBV RNA与HBsAg呈正相关,在A和C组中HBV RNA与ALT、AST呈正相关,由此可见A组血清HBV RNA与其他病毒血清标志物和肝功能指标的相关性总体上要优于B、C组,且与HUANG等[11]研究结果一致。在B组中HBV RNA与HBeAg呈正相关(P<0.05),在A和C组中HBV RNA与ALT、AST 呈正相关(P<0.05),这种相关性的差异可能与病毒感染状态、病毒变异、疾病进展和治疗等因素有关,需进一步分析研究。
本研究结果显示,A组血清HBV RNA水平均高于C组,差异有统计学意义(P<0.017);A组血清HBsAg、AST水平均高于B、C组,差异有统计学意义(P<0.017),提示A组患者病毒复制活跃,肝功能损伤程度较为严重。本研究还发现,A组血清HBeAg水平低于B组,且HBeAg大多处于低水平。HBeAg低水平通常被认为可能是患者正处于免疫清除期,HBeAb中和部分HBeAg,HBeAg正趋于阴转的血清学转换期。理论上,这个时期RNA和DNA水平也应随之下降,多项研究也表明HBV RNA水平下降能较强地预测HBeAg血清学转换[13]。由本研究结果推断出,A组患者可能与PC和(或)BCP突变或者HBV处于再活动期等因素关系更大,VAN CAMPENHOUT 等[12]研究发现,HBV RNA水平与PC和(或)BCP突变有关,这之间的关系还需要更多的研究来证实。本研究结果也显示,A组血清HBV RNA水平与HBV DNA有良好的相关性,HBV RNA可协同HBV DNA检测,帮助临床医生及时了解此类特殊血清学模式CHB患者病情变化,调整诊疗策略,提升治疗效果。
本研究结果显示,A组检测到了B、C、D基因型,其中以B基因型多见(75/69.44%),其次为C基因型(20/18.52%),D基因型占比最少(4/3.70%),这与文献[4]的报道结果一致,表明A组HBV感染者基因型无特殊表现,进一步比较A组B、C基因型间血清HBV RNA和HBV DNA水平,差异均无统计学意义(P>0.05)。有研究显示,D基因型HBV RNA水平要高于B、C基因型[12],本研究因D基因型例数太少(4例)未做统计学分析。一般而言,CHB患者血清HBV RNA水平均低于HBV DNA水平[14-15]。本研究结果也显示,A组血清HBV RNA水平总体随着HBV DNA水平降低而降低。
综上所述,HBeAg和HBeAb共同阳性CHB患者血清HBV RNA与HBV DNA具有良好的相关性,血清HBV RNA检测具有潜在的临床意义,但其检测优势需进一步研究分析。本研究的不足之处在于没有针对A组及B、C组行HBV RNA动态观察。血清HBV RNA是一项新的检测项目,随着检测技术的进步,灵敏度更高、特异度更好的HBV RNA检测方法开始运用于临床,后期将对其进一步深入研究。

