动态增强MRI 联合能谱成像对致密型乳腺病变的诊断价值分析
韩旭 邹丹丹 胡菲 李彦国
乳腺癌是威胁女性群体生命安全的首要疾病[1]。致密型乳腺病变是乳腺癌的危险因素,并且具有较高的误诊、漏诊风险,因此探寻一种提升诊断率的检测方式对致密型乳腺病变诊断具有重要意义[2]。动态增强磁共振显像(dynamic contrast-enhanced magnetic resonance imaging,DCEMRI)是无辐射的检查技术,DCE-MRI 的时间-信号强度曲线(time-signal intensity curve,TIC)有助于正确判断病变类型。对于乳腺腺体密度,尤其是致密型乳腺临床诊断率相对较高,但患者的微血管密度对TIC 具有一定影响[3]。在全视野数字化乳腺摄影(full-field digital mammography,FFDM)基础上优化研发而来的乳腺能谱成像(contrast-enhanced spectralmammography,CESM)是一项全新检查技术,该技术能对乳腺钙化的良恶性进行鉴别[4]。本文评估DCE-MRI 联合CESM 诊断对致密型乳腺内病变检出率的影响,旨在为致密型乳腺的病变筛查提供参考。
资料与方法
1.一般资料
本研究选取本院在2020 年6 月~2021 年6 月135 例致密型乳腺内病变患者作为研究对象,年龄28~68 岁,平均(43.49±5.41)岁,均经穿刺或手术明确病理结果。纳入标准:(1)与《中国抗癌协会乳腺癌诊治指南与规范》[5]中的致密型乳腺内病变诊断标准相符;(2)病理诊断明确;(3)参与研究前3 个月内未进行相关乳腺检查;(4)参与研究前3 个月内未接受相关辅助化疗等治疗;(5)签署知情同意书。排除标准:(1)临床信息不全并且无法补齐;(2)妊娠、哺乳状态;(3)存在精神障碍、沟通障碍;(4)研究期间病情突然恶化退出研究。本研究已获得医学伦理委员会审批(TJIRB20191112)。
2.方法
所有患者行DCE-MRI 扫描检查(GE 3.0 超导型MR 扫描仪),患者俯卧位,乳腺自然下垂,辅助患者将两侧乳头移动到线圈中心位置后开始扫描。对比剂采用剂量为0.2 mmol/kg 的钆喷酸葡胺注射液,注射流率为2.55 ml/s。扫描序列包括STIR 扫描:TR/TE 8100/35.05 ms,层厚5 mm,层距1 mm,矩阵320×220,视野300 mm×300 mm,激励次数2;横断面T1WI 扫描:TR/TE 520/430 ms,层厚5 mm,层距1 mm,矩阵320×250,视野300 mm×300 mm,激励次数1;横断面乳腺动态容积成像序列扫描:TR/TE 260/2.1 ms,FA 为14°,激励次数0.7,其他参数同上。在注射对比剂前行平扫,再连续7 个时相扫描,单次平扫时间小于60 s。
设备为GE Senographe Essential 全数字乳腺机,检查前按照3 ml/s 流率上臂静脉注射1.5 ml/kg碘海醇,注射2 min 后进行CESM 检查。先检查患者的健侧乳腺,行高低能量曝光检查,检查位置取内外斜位和头尾位。检查完毕后再检查患侧乳腺,步骤同上。检查过程中持续1.5 s 的单次压迫分别可获得高能曝光和低能曝光各1 次。在工作站上各摄片体位均可获得低能、减影两张图像,减影图像经过特定算法后获得。
获得的DCE-MRI 及CESM 检查图像通过高分辨率显示器读片。再使用EWS 工作站观察DCE-MRI 图像,标记兴趣区(region of interest,ROI),生成TIC。由两位有5 年工作经验的影像科医生阅片,分别观察所有患者的DCE-MRI 及CESM 影像学检查结果,当出现不同意见时,通过协商的方式确定结论。
3.观察指标
以病理检查结果为金标准,比较DCE-MRI、CESM 以及DCE-MRI 联合CESM 检查在左/右侧致密型乳腺内病变位置、致密类型(不均匀致密型和高度致密型)以及病变良恶性中的检出率差异,绘制受试者工作特征(receiver operating characteristic,ROC)曲线分析特异度、敏感度、曲线下面积(area under curve,AUC)。
4.诊断标准
DCE-MRI、CESM 诊断结果依据BI-RADS 分类评估标准[6]评估良恶性具体如下:0 级:未出现不良反应且经其他检查确诊为阴性;1级:确诊为阴性且伴有轻微不良反应;2 级:经检查为阳性,但为良性病变,恶性病变率为0;3 级:病变征象明显,虽为良性病变,但有2%的概率进展为恶性;4 级:表现出明显异常,恶性病变率2%~95%;5级:检查异常且95%概率为恶性病变。以4A 级为分界线,以下为良性,反之为恶性。
5.统计学处理
应用SPSS 24.0 处理收集的各项研究数据,计数资料使用n(%)表示,χ2检验,以ROC 曲线分析DCE-MRI 联合CESM 对致密型乳腺内病变的诊断价值,P<0.05 为差异有统计学意义。
结 果
1.DCE-MRI、CESM 及两者联合对致密型乳腺内病变定位诊断的差异
病理检查结果显示良性病变75 例:不均匀致密型53 例,左侧33 例,右侧20 例;高度致密型22 例,左侧14 例,右侧8 例。恶性病变60 例:不均匀致密型35 例,左侧23 例,右侧12 例;高度致密型25 例,左侧20 例,右侧5 例。
致密型乳腺内病变患者应用DCE-MRI 联合CESM 检查的病变部位检出率均明显高于DCEMRI、CESM 单独应用的检出率,存在统计学差异(P<0.05),CESM 检出病变部位的比例更高,但与DCE-MRI 数据比较无统计学差异(P>0.05)(表1)。

表1 DCE-MRI、CESM 以及DCE-MRI 联合CESM 检查在左/右侧致密型乳腺内病变位置的差异[例,(%)]
2.DCE-MRI、CESM 及两者联合对不均匀致密型与高度致密型病变检出的差异
DCE-MRI 联合CESM 对致密型乳腺内病变的检出率均明显高于DCE-MRI、CESM 单独检查,数据存在统计学差异(P<0.05);CESM 检出病变致密类型的比例更高,但与DCE-MRI 数据比较无统计学差异(P>0.05)(表2)。
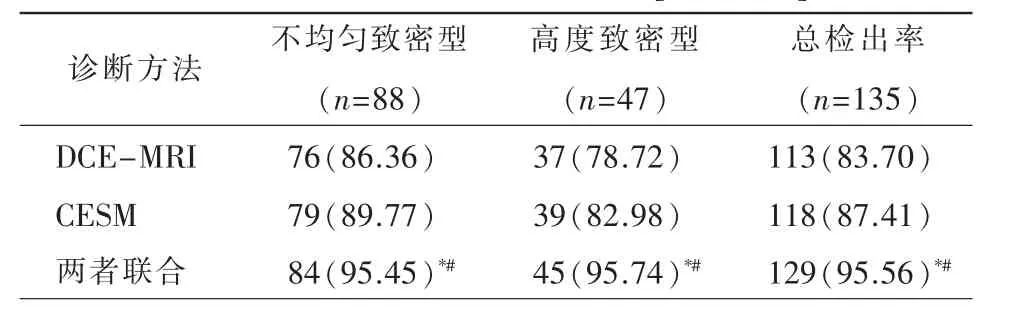
表2 DCE-MRI、CESM 及两者联合在不均匀致密型与高度致密型病变检出的差异[例,(%)]
3.DCE-MRI、CESM 及两者联合对致密型乳腺内病变良恶性的判断差异
致密型乳腺内病变良恶性判断应用CESM、MRI 单独检查的检出率均明显低于DCE-MRI 联合CESM 检查,有统计学差异(P<0.05);CESM 检出病变致密类型的比例更高,但与DCE-MRI 数据比较无统计学差异(P>0.05)(表3、图1~4)。

图1 恶性致密型乳腺内病变,女,48 岁。a)MRI 动态增强示左乳肿块样强化(箭),形态规则,边缘不规则,可见浅分叶,动脉期强化显著,延迟期不扩散;b)TIC 呈廓清型(Ⅲ型);c)CESM 图;d)病理图(HE 染色×400)图2 恶性致密型乳腺内病变,女,63 岁。a)MRI 动态增强示左侧乳腺12 点方向肿块样强化(箭),形态不规则,边缘见毛刺,内部不均匀强化,动脉期中等度,延迟期进一步片状不均匀强化;b)TIC 呈平台型(Ⅱ型);c)CESM 图;d)病理图(HE 染色×400)

表3 DCE-MRI、CESM 及两者联合在致密型乳腺内病变良恶性的检出率差异[n,(%)]
4.DCE-MRI、CESM 及两者联合对致密型乳腺内病变位置的诊断效能
DCE-MRI 联合CESM 对致密型乳腺内病变位置、致密类型及定性的AUC、特异度、敏感度均高于DCE-MRI、CESM 单独检查,差异均具有统计学意义(Z病变位置=2.434,Z致密类型=2.332,Z良恶性=2.465;P 均<0.05)(表4~6)。
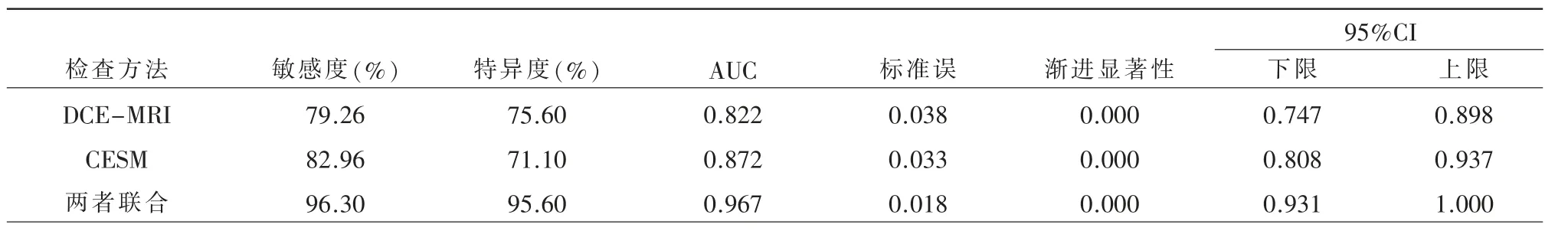
表4 DCE-MRI、CESM 及两者联合诊断致密型乳腺内病变位置的效能
讨 论
女性乳腺病变早期诊断和治疗极为重要。乳腺炎症、结构异常都会堵塞乳腺小叶导管,使患者的腺叶乳汁无法顺畅排出并在乳腺内大量积存,造成导管扩张形成乳腺囊肿病变;另外乳汁积存也会形成硬结并引发慢性乳腺炎,体内雌激素过高是造成乳腺纤维瘤的主要病因[8,9]。纤维腺体组织重叠是诱发致密型乳腺癌的主要危险因素,该疾病在临床诊断中漏诊率和误诊率显著高于其他类型乳腺疾病。致密型乳腺病变过程中依赖周围组织营养,促使乳腺组织增生新小血管,导致其渗透性高于正常的微血管[10]。

图3 良性致密型乳腺内病变,女,49 岁。a)MR 增强图像示右乳外上象限10 点方向及右乳外下象限8~9 点方向两异常信号影(箭),10点方向病变呈轻度渐进性强化,8~9 点方向病变未见强化;b)TIC 呈Ⅰ型;c)CESM 图;d)病理图(HE 染色×400)图4 良性致密型乳腺内病变,女,51 岁。a)MR 增强示右侧乳腺外上象限导管样强化区(箭),边界不清;b)TIC 呈平台型;c)CESM 图;d)病理图(HE 染色×400)

表5 DCE-MRI、CESM 及两者联合诊断致密型乳腺内致密类型的效能

表6 DCE-MRI、CESM 及两者联合诊断致密型乳腺内病变良恶性的效能
DCE-MRI 是一种快速成像技术,可测量组织内的水分子活动情况,进而从细胞微环境角度观察病变情况,综合分析DCE-MRI 多个参数有助于准确诊断[11]。CESM 可显示乳腺腺体的解剖结构并对钙化敏感,因此在乳腺内病变诊断中具有较高的应用价值[12]。本研究结果显示DCE-MRI、CESM 单独检查致密型乳腺内病变的定位(部位)、致密类型、定性(良恶性)的检出率均在75%以上,与以往文献[13,14]相符,提示DCE-MRI、CESM 均可准确检出致密型乳腺内病变。结合其发病机制分析,致密型乳腺内病变患者的乳腺组织增生新小血管造成渗透性异常升高,DCE-MRI 检查时对比剂漏入病变区域内会显著增加信号并可提升对比度与影像锐利度,进而获取TIC 参数以及清晰图像,有效提高临床检出率[15]。CESM 是一项在FFDM技术上优化获得的影像技术,可清晰显示血流增强区域,另外恶性病变在CESM 上的强化方式与DCE-MRI 相同,该检查方式通过对比剂来提高对恶性肿瘤的检出率,可以准确检出乳腺的隐匿性病变,从而提高乳腺内恶性病变的检查率[16]。
DCE-MRI 检查时需采用俯卧位,给患者带来不适,另外DCE-MRI 的检查周期较长、价格贵,临床应用具有一定局限性[17]。本研究结果显示,DCE-MRI 联合CESM 诊断与DCE-MRI、CESM 单独检查致密型乳腺内病变相比,病变定位、致密类型及定性诊断的ROC 曲线AUC、特异度、敏感度均明显提高(P 均<0.05),与既往研究结果[18]相符。DCE-MRI、CESM 单独检查仍存在误诊、漏诊情况,两者联合应用可以有效弥补不足,提升诊断准确率。分析其原因可能是DCE-MRI 检查是通过对受检者注射对比剂后,收集不同阶段的检查图像,并根据图像计算对应的时间-信号强度,然后基于动态强化下,观察组织状态,同时结合病灶的形态,帮助定性判断。CESM 检查结果分为低能图像和高能图像,其中低能图像能直观显示出患处的钙化情况,但低血供病变难以发现;高能图像则扮演增强扫描的角色,两者在数字减影的基础上能更加清晰地将病灶展示出来,但该检查的图像为二维图片,受病灶状态及对比剂剂量不同影响,会出现漏诊、误诊等情况。因此DCE-MRI 作为弥补该弊端的检查方式,两者联用会大大提高诊断率[19]。本研究仍存在样本量相对较少的缺点,另外未针对致密型乳腺内病变患者预后与DCE-MRI、CESM 检查参数的关系进行深入研究。
DCE-MRI、CESM 均可有效诊断致密型乳腺内病变,但DCE-MRI 联合CESM 检查在诊断致密型乳腺内病变的敏感度、特异度及整体诊断效能明显高于两项技术单独应用。在临床中可准确对致密型乳腺内病变进行定位、判断致密类型及定性诊断。