SBP2基因突变小鼠模型的制备及甲状腺表型分析
赵 洋,丁 习,吕宏军,伍丽萍,邓雪阳,浮 姣*
(1西安交通大学第一附属医院内分泌代谢科,西安 710061;2中国药科大学中药药理与中医药学系;*通讯作者,E-mail:jiao_fu@xjtufh.edu.cn)
硒代半胱氨酸插入序列结合蛋白2(selenocysteine insertion sequence-binding protein 2, SECISBP2),又称SBP2,是硒蛋白合成过程中硒代半胱氨酸插入所必需的反式作用因子[1]。SBP2基因缺陷可阻止硒代半胱氨酸的插入,从而影响硒蛋白的合成,引起一类以甲状腺激素代谢缺陷为主要特征的临床综合征。患者表现为生长发育迟缓,并具有特殊的甲状腺功能表型,即血清T4升高、T3降低、rT3升高,而TSH可为正常或轻度增高;重症患者还可出现运动和智力发育障碍,部分患者还伴有进行性肌病、免疫缺陷、糖代谢异常、原发性不孕、皮肤光过敏以及雷诺氏病等多器官损害[2]。该病2005年首次报道[3],迄今已发现至少9个患病家系[3-8]。然而,目前尚缺乏用于研究该病致病机制的突变敲入小鼠模型。
本研究尝试利用同源重组技术建立Sbp2基因突变小鼠模型以模拟患者的临床表型。本研究选择人SBP2 R128X突变[4](即小鼠Sbp2 R129X突变)和人SBP2 R770X突变[5](即小鼠Sbp2 R775X突变)作为转基因位点,在此基础上进一步建立R129X/R775X复合杂合突变小鼠,以模拟携带R120X/R770X复合杂合突变患者的临床表型[5]。该小鼠模型的建立将不仅有助于研究SBP2基因缺陷复杂临床症候群的潜在机制,开发用于该病治疗的新药,同时对探索SBP2蛋白的潜在生物学功能具有深远意义。
1 材料与方法
1.1 动物、细胞系和主要试剂
野生型C57BL/6J小鼠(北京维通利华实验动物技术有限公司,SYXK-京20170033);Flpdeletor转基因小鼠B6.129S4-Gt(ROSA)26Sortm1(FLP1)Dym/RainJ strain(美国Jackson实验室,stock #009086);小鼠胚胎干细胞R1(源自C57BL/6×C57BL/6-CP杂交F1代胚胎,核型XY);DNA提取试剂盒(天根生化科技有限公司);RNA提取试剂盒、RT-PCR Mix、反转录试剂盒和SYBR Green(大连宝生物工程有限公司);Southern blot检测试剂盒(深圳莱伯克生物科技有限公司);限制性内切酶Hind Ⅲ、MfeⅠ、EcoR Ⅰ、XbaⅠ和SpeⅠ(上海玉博生物科技有限公司);血清TT4、TT3、TSH和rT3测定(天津市协和医药科技集团有限公司)。
1.2 打靶载体的构建
制备细菌人工染色体(bacterial artificial chromosomes, BAC)DNA,通过缺口修复法从BAC上亚克隆小鼠Sbp2基因组片段到pL253质粒,采用同源重组技术通过同源臂扩增引物引入Sbp2 R129X和Sbp2 R775X突变位点。线性化缺口修复载体,热休克诱导λRed重组蛋白,电转含有线性化缺口修复载体的菌株进行同源重组,筛选重组质粒用于显微注射。Sbp2 R129X和R775X突变敲入打靶载体的示意图见图1。
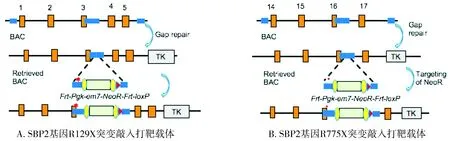
红色星号:突变位点;绿色长方体:NeoR;红色三角:LoxP位点;黄色椭圆:Frt位点;蓝色长方体:同源臂图1 Sbp2 R129X和R775X突变敲入小鼠打靶载体示意图Figure 1 Schematic diagrams of Sbp2 R129X and R775X mutant knock-in mouse targeting vectors
1.3 打靶载体电转胚胎干细胞
取小鼠胚胎干细胞R1单细胞悬液800 μl,加入50 μg线性化打靶载体DNA,混匀后移入40 mm宽的无菌电穿孔杯中,用BioRad Gene Ⅱ电穿孔系统在240 V 500 μF条件下单脉冲激发,室温静置5 min,将细胞分入2个胶原化培养皿中,使细胞在非选择型培养基中复苏24 h,加入含200 μg/ml G418和2 μmol/L Gancyclovir的选择性培养基,10 d后挑出药物抗性克隆,PCR筛选阳性克隆。
1.4 胚胎干细胞阳性克隆的Southern blot筛选
设计用于Southern blot的5′端和3′端探针并选择限制性内切酶位点(见图2)。Sbp2 R129X 5′端经Hind Ⅲ内切酶酶切,野生型等位基因将产生一11.2 kb的片段,而发生同源重组的等位基因将产生一8.9 kb片段;3′端采用MfeⅠ内切酶酶切,野生型等位基因将产生一6.5 kb的片段,而发生同源重组的等位基因产生一8.4 kb的片段。Sbp2 R775X 5′端经SpeⅠ内切酶酶切,野生型等位基因将产生一12.1 kb的片段,而发生同源重组的等位基因将产生一7.5 kb的片段;3′端仍利用SpeⅠ内切酶酶切,野生型等位基因将产生一12.1 kb的片段,而发生同源重组的等位基因将产生一6.4 kb的片段。
利用地高辛标记的dUTPs探针,提取胚胎干细胞克隆DNA,选用图2所示的限制性内切酶消化后,置于0.7%琼脂糖凝胶缓慢过夜电泳(30~40 V),毛细血管转移法过夜转膜,漂洗尼龙膜并用紫外交联照射,与变性后的双链DNA探针65 ℃过夜杂交,洗膜后曝光。
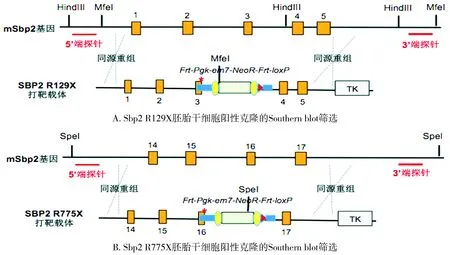
红色星号:突变位点;红色三角:LoxP位点;绿色长方体:NeoR;黄色椭圆:Frt位点;蓝色长方体:同源臂图2 Southern blot筛选胚胎干细胞阳性克隆的探针及内切酶位点示意图Figure 2 Schematic diagrams of probes and endonuclease sites for screening embryonic stem cell positive clones by Southern blot
1.5 显微注射及嵌合体小鼠的育种
经Southern blot筛选正确同源重组的中靶胚胎干细胞克隆,通过囊胚显微注射将中靶胚胎干细胞导入受体小鼠囊胚腔,使胚胎在代孕母体内发育成熟,幼鼠断乳后自尾部提取DNA,PCR鉴定携带外源基因的小鼠,称为嵌合体小鼠。将嵌合体雄鼠与野生型(+/+)C57BL/6J雌鼠交配,获得F1代杂合突变小鼠(m/+)。再将Flpdeletor工具雄鼠与F1代杂合突变雌鼠(m/+)交配,获得F2代杂合突变小鼠(m/+),再将F2代杂合突变雄鼠(m/+)与雌鼠(m/+)交配,获得不同基因型的F3代小鼠用于后续实验。
1.6 模型小鼠的低硒诱导
选取雄性和雌性F3代60日龄Sbp2 R129X和R775X杂合突变小鼠及野生型对照小鼠,低硒饲料(硒<0.01 mg/kg)喂养60 d,喂养30 d和60 d时每组随机选取6只小鼠,解剖并留取血清和小鼠甲状腺、肝脏、肌肉、脂肪、大脑等组织器官,迅速干冰冷却后冻存于-80 ℃冰箱备用。
1.7 血清甲状腺功能的测定
血清总甲状腺素(total thyroxine, TT4)、总三碘甲状腺原氨酸(total triiodothyronine, TT3)、促甲状腺激素(thyroid-stimulating hormone, TSH)和反三碘甲状腺原氨酸(reverse T3, rT3)水平利用放射性免疫法进行测定,试剂盒购自天津市协和医药科技集团有限公司(批号:TT4 RA10102、TT3 RA10101、TSH RA10109和rT3 RA10107)。
1.8 统计学分析
实验数据以均数±标准差表示,运用统计学软件SPSS16.0(Chicago, IL, USA)进行统计分析。两组之间的差异符合正态分布者采用独立样本t检验,不符合正态分布采用Mann-WhitneyU检验;多组之间的差异比较采用单因素方差分析。P<0.05表示差异有统计学意义。
2 结果
2.1 Sbp2基因突变敲入小鼠模型的成功建立
Sbp2 R129X和R775X突变敲入打靶载体电转入胚胎干细胞,经药物和PCR筛选分别获得12和23个在5′端和3′端同时发生正确同源重组的阳性克隆。利用Southern blot进一步筛选阳性克隆,Sbp2 R129X 5′端和3′端Southern blot杂交鉴定结果见图3A和3B,选取3珠阳性克隆(#76、#89和#146)放大培养后进行囊胚显微注射;Sbp2 R775X 5′端和3′端Southern blot杂交鉴定结果见图3C和3D,选取3珠阳性克隆(#26、#29和#103)放大培养后进行囊胚显微注射。
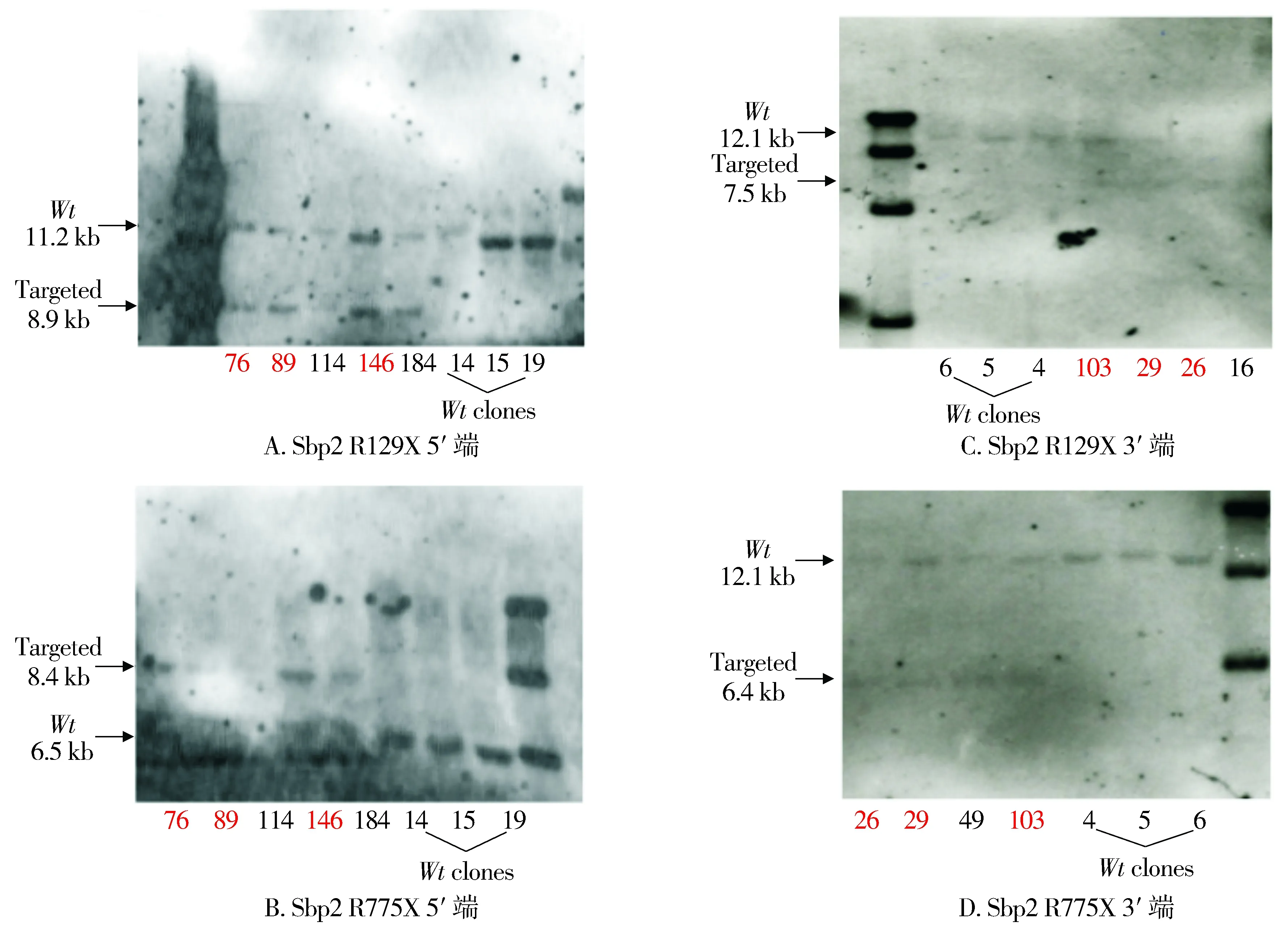
76,89,114,146和184为经药物和PCR筛选的阳性克隆;14,15,19为野生型克隆对照;103,29,26,16,49为经药物和PCR筛选的阳性克隆;4,5,6为野生型克隆对照图3 Southern Blot杂交鉴定筛选胚胎干细胞阳性克隆Figure 3 Southern Blot identification and screening of embryonic stem cell positive clones
经Southern Blot筛选后的阳性胚胎干细胞克隆注射假孕母鼠囊胚腔,获得36只Sbp2 R129X和27只Sbp2 R775X嵌合体雄鼠。按1.5的流程进行育种,所获得F3代小鼠各基因型的数量及比例见表1。F2代Sbp2 R129X杂合突变(R129X/+)雄鼠与雌鼠交配获得的F3代小鼠共88只,其中野生型33只(+/+,37.5%),杂合突变型55只(R129X/+,62.5%),纯合突变型0只(R129X/R129X,0.0%);F2代Sbp2 R775X杂合突变(R775X/+)雄鼠与雌鼠交配后获得的F3代小鼠共99只,其中野生型31只(+/+,31.3%),杂合突变型68只(R775X/+,68.7%),纯合突变型(R775X/ R775X)0只;F2代Sbp2 R129X和R775X杂合突变(R129X/+和R775X/+)的雄鼠和雌鼠交配后获得的F3代小鼠共71只,其中野生型25只(+/+,35%),R129X杂合突变型21只(R129X/+,30%),R775X杂合突变型25只(R775X/+,35%),R129X/R775X复合杂合突变型(R129X/R775X)0只。上述结果显示,所获得的F3代小鼠无一例呈纯合突变型或复合杂合突变型,提示其在胚胎期死亡。
2.2 低硒诱导Sbp2 R129X和R775X杂合突变小鼠的甲状腺表型
SBP2基因缺陷呈常染色体隐性遗传,然而与患者不同,Sbp2 R129X和R775X纯合突变或复合杂合突变的小鼠均在胚胎期死亡,于是本研究首先对F3代Sbp2 R129X和R775X杂合突变小鼠的甲状腺功能进行了检测,但是在充足硒喂养条件下其甲状腺功能与野生型小鼠相比无统计学差异。本研究进一步尝试限制Sbp2 R129X和R775X杂合突变小鼠的饮食硒摄入量,以评估硒缺乏是否可能加重杂合突变小鼠硒蛋白合成功能的缺陷而使其呈现患者的临床表型。结果显示,低硒诱导后Sbp2 R129X杂合突变雌鼠的血清T4、T4/T3和rT3均不同程度高于野生小鼠组,部分差异具有统计学意义(见图4)。然而,低硒诱导对Sbp2 R129X杂合突变雄鼠的甲状腺功能影响相对较小,仅低硒30 d时T4和rT3的增高具有统计学意义(见图5)。
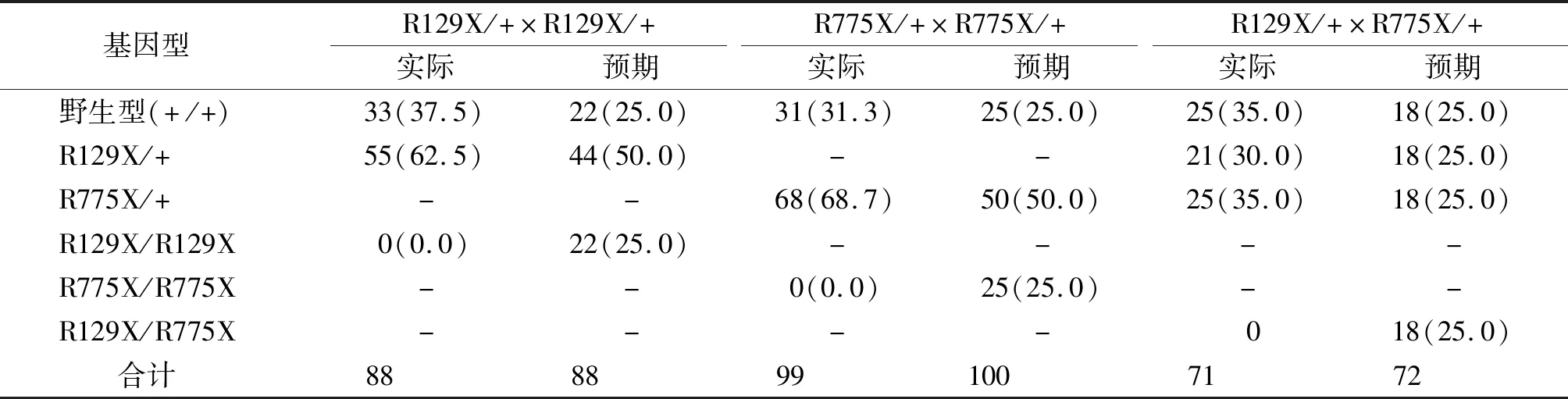
表1 F3代小鼠各基因型的数量及比例 只(%)Table 1 Proportion of F3 generation model mice with different genotypes cases(%)
结果显示,与野生雌鼠相比,低硒诱导Sbp2 R775X杂合突变雌鼠的血清T4、T4/T3和rT3均呈不同程度增高,其中T4和T4/T3的差异具有统计学意义(见图6),符合SBP2缺陷患者的甲状腺功能特点。同样,与野生雄鼠相比,低硒诱导Sbp2 R775X杂合突变雄鼠的甲状腺表型亦显示与雌鼠相同的趋势,其中低硒诱导30 d和60 d时T4/T3和rT3的差异均具有统计学意义(见图7)。因此,Sbp2 R775X杂合突变雌鼠和雄鼠均可通过低硒饮食诱导显示SBP2缺陷患者的甲状腺表型。与R129X杂合突变小鼠相比,R775X杂合突变小鼠在低硒诱导下,显示更为严重的甲状腺表型。
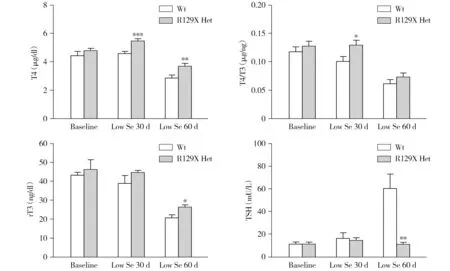
与野生型比较,*P<0.05,**P<0.01,***P<0.001图4 低硒诱导的Sbp2 R129X杂合突变雌鼠的甲状腺功能Figure 4 Thyroid function of Sbp2 R129X heterozygous mutant female mice with low selenium food
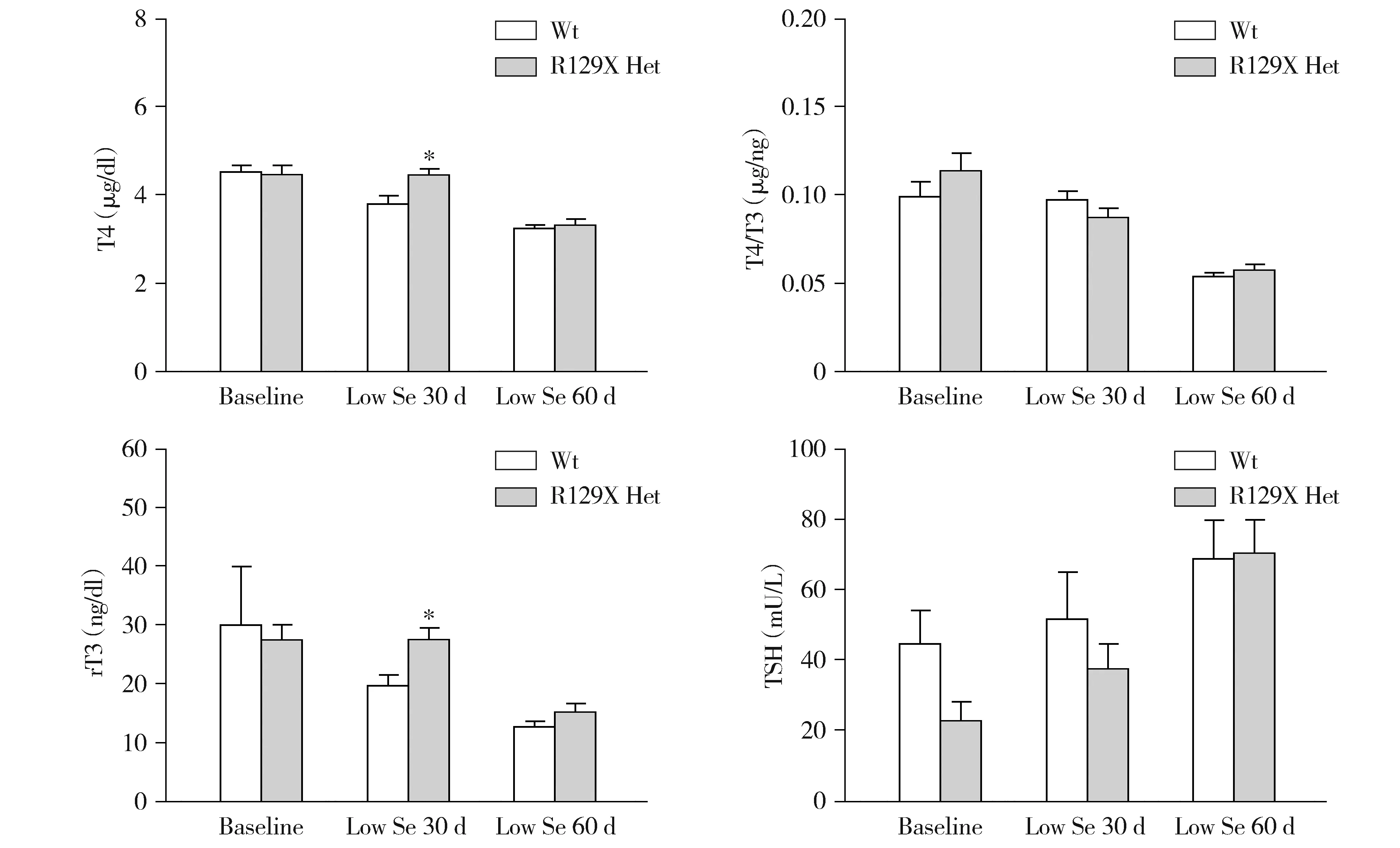
与野生型比较,*P<0.05,**P<0.01,***P<0.001图5 低硒诱导的Sbp2 R129X杂合突变雄鼠的甲状腺功能Figure 5 Thyroid function of Sbp2 R129X heterozygous mutant male mice with low selenium food
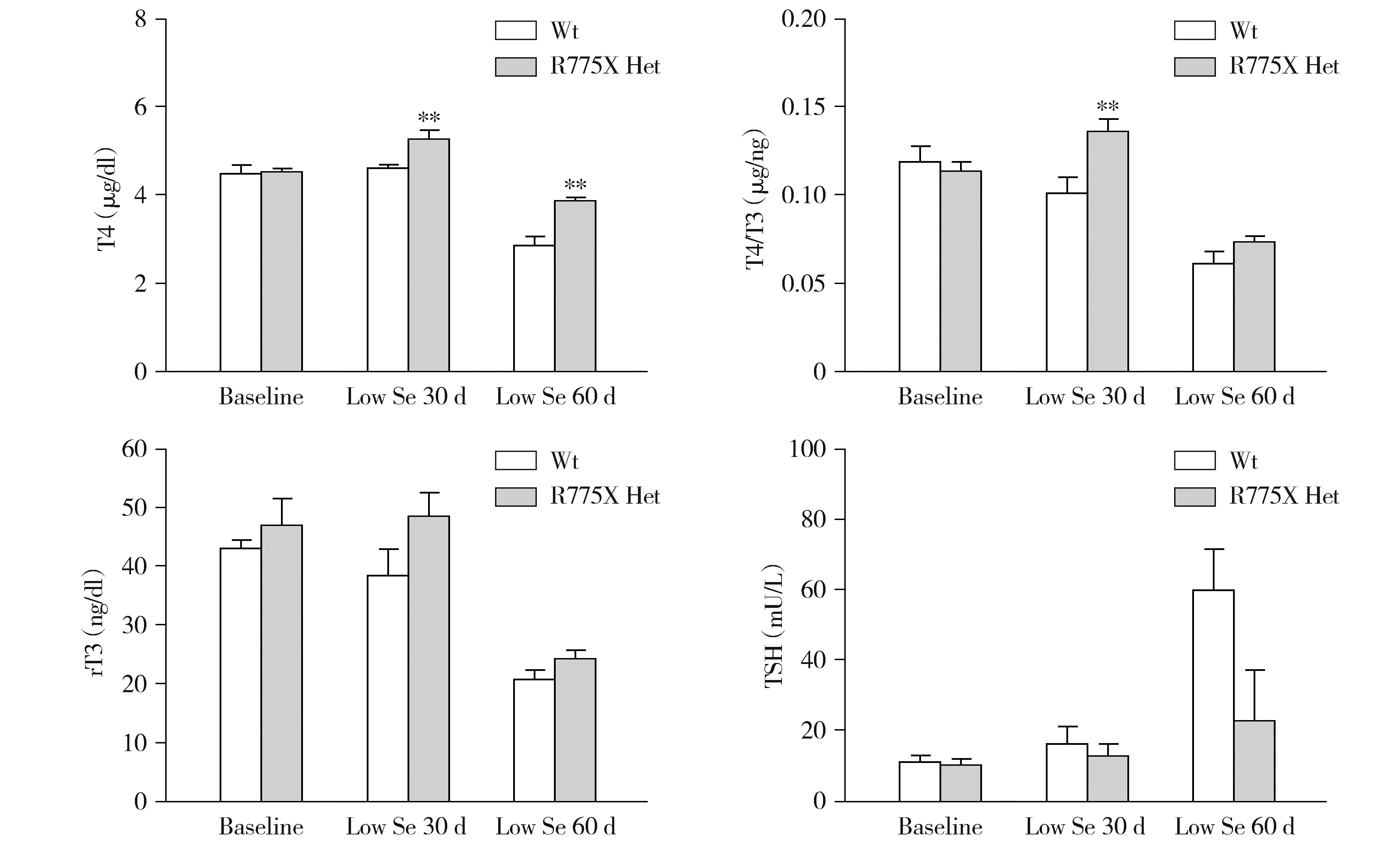
与野生型比较,*P<0.05,**P<0.01,***P<0.001图6 低硒诱导的Sbp2 R775X杂合突变雌鼠的甲状腺功能Figure 6 Thyroid function of Sbp2 R775X heterozygous mutant female mice with low selenium food
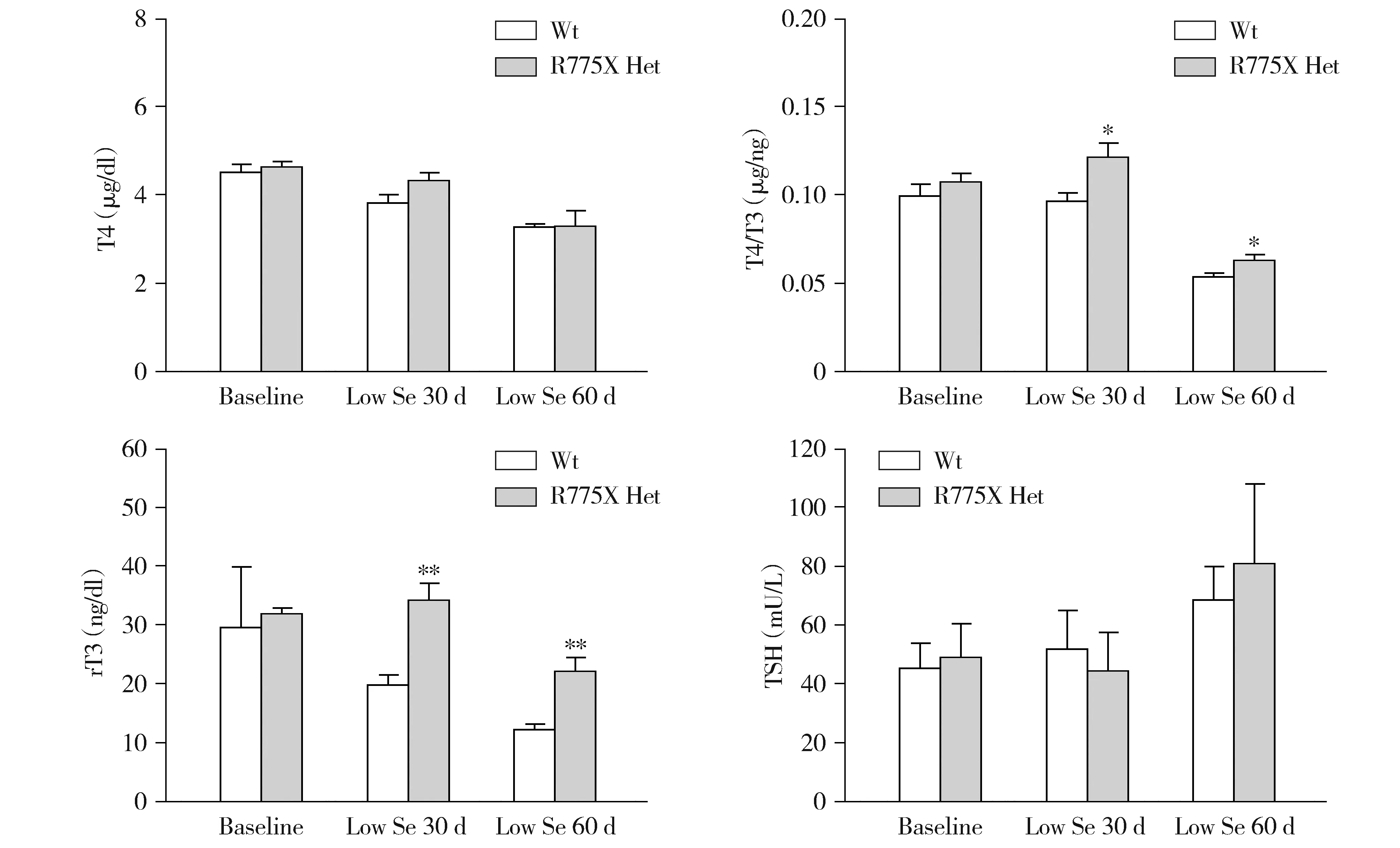
与野生型比较,*P<0.05,**P<0.01,***P<0.001图7 低硒诱导的Sbp2 R775X杂合突变雄鼠的甲状腺功能Figure 7 Thyroid function of Sbp2 R775X heterozygous mutant male mice with low selenium food
3 讨论
SBP2基因缺陷可引起一类以生长发育迟缓和甲状腺功能异常为特点的复杂临床症候群。SBP2是硒蛋白合成过程中硒代半胱氨酸插入的必需元素,由此推测患者的临床表型很可能与硒蛋白功能的异常有关[2]。然而,25种硒蛋白在机体内的合成存在特殊的“等级制度”,即当硒蛋白合成过程受阻时,机体将优先保证生物学功能重要的硒蛋白的合成[9,10]。因此,当SBP2功能异常时,一些生物功能重要的硒蛋白仍然能够正常合成。
为探究SBP2基因缺陷的潜在机制,本研究利用同源重组工程技术建立Sbp2基因突变敲入的小鼠模型。SBP2的羧基端是其主要的功能区域,包含硒代半胱氨酸插入序列(selenocysteine insertion sequence, SECIS)RNA结合和核糖体插入结构域,在人和小鼠间高度同源;氨基端的功能尚有待阐明[1]。本研究分别选取位于氨基酸的R129X和位于羧基端的R775X突变位点,成功获得了Sbp2 R129X和R775X杂合突变小鼠模型,然而R129X和R775X纯合突变小鼠和复合杂合突变小鼠均在胚胎期死亡。与本研究结果类似,德国一研究团队利用基因捕获技术成功建立了Sbp2基因敲除的小鼠模型,其纯合敲除小鼠亦在原肠胚形成前死亡[11]。由此推测,呈常染色体隐性遗传的SBP2基因缺陷患者体内很可能不同程度地保留了SBP2的部分生物学功能。体外研究表明,携带K438X和IVS8ds29 G>A复合杂合突变的患者可保留24%的SBP2转录功能[3]。SBP2 R128X和R120X突变可从其下游的3个甲硫氨酸合成小亚型,从而使SBP2羧基末端的功能结构域得到保留[4,5]。因此,SBP2基因缺陷患者所呈现的复杂临床症候群很可能是SBP2功能的部分保留,以及硒蛋白合成时的“等级制度”共同参与的结果。
为研究不同基因突变位点对SBP2功能的影响,本研究首先成功建立了Sbp2 R129X和R775X杂合突变小鼠模型,然而其在充足硒喂养条件下的甲状腺功能与野生型小鼠无差异。为更好地模拟SBP2基因缺陷患者的临床表型,本研究通过限制饮食硒的摄入量,进一步阻碍Sbp2 R129X和R775X杂合突变小鼠硒蛋白的合成。结果显示,与R129X杂合突变小鼠相比,R775X杂合突变小鼠在低硒诱导下,显示更为典型的甲状腺表型,即T4/T3、rT3和T4水平的增高。如前所述,位于SBP2基因氨基端的突变可从其下游的3个甲硫氨酸合成小亚型,从而使SBP2羧基末端的功能结构域得到保留[4,5],本研究中低硒诱导的R775X杂合突变小鼠较R129X杂合突变小鼠显示更为典型的甲状腺表型,此结果进一步证实Sbp2的主要功能区域位于其羧基端[1]。
本研究首次构建了Sbp2基因突变敲入的转基因小鼠模型,其中低硒诱导的Sbp2 R775X杂合突变小鼠可基本模拟SBP2基因缺陷患者的甲状腺表型。因此,该小鼠模型的构建有利于研究SBP2基因缺陷对甲状腺功能的影响及其作用机制,同时进一步探讨该基因突变对小鼠各器官系统功能的影响,以阐明该病复杂临床症候群的潜在机制,亦对探索SBP2的潜在生物学功能具有深远意义。

