超微血管成像联合穿刺活检对BI-RADS4类乳腺结节的诊断价值
陈树坤,祁明
(锦州医科大学附属第一医院,辽宁 锦州 121000)
乳腺病变已经成为女性患者最常见的疾病之一,其中乳腺癌严重困扰她们的身心健康。伴随着各种诊断技术水平的提高以及广大女性检查的自主性,早期乳腺病变以及较小病灶的乳腺癌筛查率越来越高[1],其中部分患者可以及时得到治疗,降低生活压力。各种超声技术的不断更新,为临床医生的诊断提供了更全面、精准的评估方式,患者也增加了更多治疗方式的选择,超声引导下肿物穿刺活检(US-CNB)是快速获取病理类型的重要方法之一,为区分乳腺病变良、恶性提供了很好的解决途径[2-3]。为了提高穿刺活检的应用效能,美国放射学会的乳腺成像报告和数据系统(BI-RADS)已经被广泛运用到指导穿刺活检方面,得到了临床的广泛认可,但对于BI-RADS 4类病变的评估,由于其涵盖范围较广[4],可能介入3%~94%,这使得病变评估的困难程度上升,临床过程中只能依靠超声医师的主观评估,缺少一定的客观依据,同时考虑到穿刺对患者有一定的创伤影响,故应在保证穿刺质量的同时,减免穿刺操作对患者的影响及降低并发症发生率,制定更加明确的乳腺肿物穿刺方案。由于常规超声对病灶微血管的血流信号评估缺乏一定的敏感性,特别是低速血流的显示以及微血管的分布,效果不甚满意,超微血管成像(super microvascular imaging,SMI)技术可以利用自身的技术优势对低速血流信号进行显示,在无创、无造影剂的使用下,消除检查过程中组织运动的噪音,对于极低的血流速度具有一定的敏感性,对于早期的乳腺恶性病变,SMI可以提供一定的微血管信息,提高对病灶的诊断能力[5]。本研究主要从二维超声图像、超微血管成像以及穿刺活检等方面探讨超微血管成像联合穿刺活检对BI-RADS4类乳腺结节的诊断效能。
1 资料与方法
1.1 一般资料
选取2021年1月至2021年9月入住我院的98例乳腺患者作为研究对象,二维超声进行BI-RADS分类,对符合BI-RADS 4类的110个结节进行分析,所有患者在手术切除结节之前,均进行SMI及US-CNB对病变结节进行评估,所有患者均择期进行手术切除病变,获得术后组织病理,以手术后组织病理学结果作为诊断的金标准。《手术知情同意书》均有接受治疗的患者或其家属签字,本试验经我院伦理委员会批准。
1.2 仪器与方法
仪器选用美国GE公司所有的LOGIE9超声诊断仪,探头所选择频率为2~6 MHz,对病变结节以及周边组织进行扫查,确定结节的数目、大小、形态等,使用最新的超微血管成像分析软件,对病灶进行Adler血流分级评价,穿刺选用美国巴德16 G活检针。
1.2.1 乳腺BI-RADS分类标准
美国放射学会(ACR)发布的第5版的乳腺影像报告和数据系统(BI-RADS),标准化了超声检测乳腺病变的诊断特征。根据此标准,BI-RADS 3类中恶性比例为O%~2%。而诊断为4类的乳腺结节病变,发生恶变的可能性为3%~94%,其中4a、4b、4c发生恶变的可能性随之递增,分别为3%~10%、11%~50%、51%~94%,由此可知,病患乳腺结节病变的评级与乳腺癌的检出率或者病变的良性病变率密切相关,患者在诊断期间可能会过多选择有创检查,提高病变的准确性,因此可能会导致大量不必要的活检。而第5类被定义为高度怀疑恶性肿瘤,恶性可能性超过95%[6]。
1.2.2 乳腺结节SMI血流分级及诊断标准
首先彩色多普勒血流超声显像(CDFI)模式显示病灶的血流,切换至SMI模式,对病灶进行进一步评估,由结节一端慢慢扫查到另一端,记录病灶内部及周边的血流信息,保存图像。血流信号分级采用Adler血流分级[7]。SMI筛查诊断乳腺病变标准:血流分级为Ⅱ级(中量血流信号,可见3~4个点状或1支重要血管,重要血管:血管长度接近或超过肿物半径)或者Ⅲ级(丰富血流信号,可见5个以上点状或2支以上重要血管)为阳性,诊断为恶性病变;血流分级为0级(缺乏血流信号)或者Ⅰ级(少许血流信号,可见1~2个点状或细短棒状信号,直径小于1.0 mm)为阴性,诊断为良性病变。
1.2.3 US-CNB
对患者进行SMI评估之后,进一步得到病变部位的其他参数,充分评估之后,确定病变的穿刺部位,确定穿刺方式。首先患者摆好体位,充分显示穿刺部位,进行消毒之后,5 mL利多卡因进行麻醉,在超声引导下进针获取病理组织。对获取的组织进行评估,取材3或4针,放入固定液中,对穿刺部位进行止血和常规护理,防止感染。
1.2.4 超微血管成像联合弹性成像检查诊断乳腺病灶的标准
本研究采用并联试验,符合SMI或US-CNB检查结果者则联合检查结果为阳性。即SMI联合US-CNB检查诊断乳腺病变的标准:当穿刺结果阳性或血流分级为Ⅱ级或Ⅲ级为阳性,诊断为恶性病变;穿刺结果阴性,且血流分级为0级或者Ⅰ级为阴性,诊断为良性病变。
1.3 统计学方法
采用SPSS 25.0统计软件对数据进行比较,选择Kappa一致性检验对每种方法的诊断结果与病理结果进行分析,病灶的SMI、穿刺及联合检查结果采用卡方检验进行分析,以P<0.05为差异有统计学意义。
2 结 果
2.1 病理结果
良性结节52例、恶性结节58例、良性结节的病理类型包括纤维腺瘤17例、腺病16例、腺瘤样增生3例、导管内乳头状瘤例10例、叶状肿瘤2例、乳腺炎病灶4例、恶性结节的病理类型包括浸润性导管癌33例、导管原位癌6例、导管内乳头状癌8例、浸润性小叶癌7例、混合型粘液癌4例。
2.2 SMI、US-CNB及两者联合检查对乳腺病灶的诊断结果的一致性和检出率
运用Kappa系数检验对检查结果进行一致性分析,SMI的Kappa值分别为0.684,吻合度高度一致;US-CNB的Kappa值为0.862,吻合度高度一致;联合检查的Kappa值为0.914,吻合度为最强一致。
2.3 SMI模式检测、US-CNB以及联合检查结果
SMI分级在两组间差异均有统计学意义,SMI检测乳腺良恶性病变的微血管差异具有统计学意义(χ2=34.236,P<0.001)。0和I级为良性病变的诊断标准;II级和III级为恶性病变的诊断标准。SMI诊断恶性乳腺结节的敏感性为82.8%,特异性为76.9%,准确性为80.0%,见表1。

表1 SMI检查结果与术后病理对比
SMI、US-CNB及两者联合检查对乳腺病灶诊断的检出率分别为80.00%(88/110)、91.81%(101/110)和96.36%(106/110),3种方法比较差异有统计学意义(P<0.05),联合检查的检出率高于SMI以及US-CNB,见表2~3。
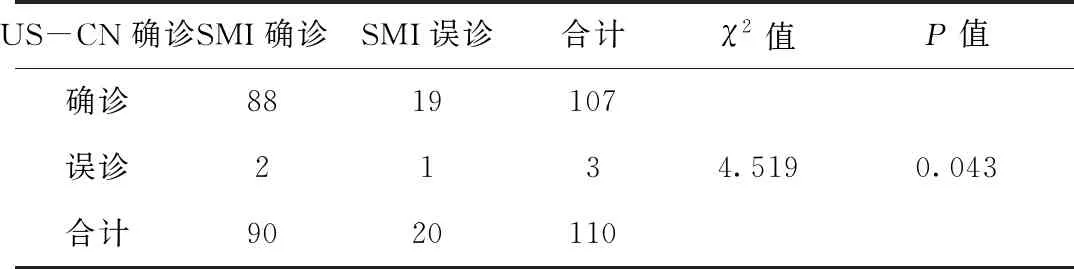
表2 SMI及US-CNB的乳腺病灶诊断结果比较(n)

表3 联合检查及SMI的乳腺病灶诊断结果比较(n)
2.4 SMI、US-CNB及联合检查3种方法检查结果的比较
SMI诊断乳腺病变的灵敏度82.75%(48/58)、特异度89.70%(40/52);US-CNB诊断乳腺病变的灵敏度89.65%(52/58)、特异度96.15%(50/52);联合检查诊断乳腺病变的灵敏度94.82%(55/58)、特异度98.07%(51/52),联合检查的诊断效能较高,见表4。

表4 3种方法的灵敏度、特异度及约登指数比较
3 讨 论
随着乳腺病变发病率的上升,对于超声诊断的要求越来越高,临床对于超声诊断结果的要求越来越精准,这促使超声诊断方式和方法的更新、变化速度越来越快[8]。与以往的二维超声诊断相比,新型超声技术可以依据自身技术特点对病变的不同结构进行分析与评估,为医生的诊断和治疗提供更多可靠的临床数据。如:超声造影、超声弹性成像、超微血管成像及超声引导下穿刺活检等新技术已经全面的运用到了日常检查工作中。复杂的良性乳腺病变与早期的恶性乳腺癌,不管是临床触诊或二维超声图像、乳腺钼靶表现等有很多相似之处,临床上很难鉴别[9]。临床治疗过程中,对于乳腺良性病变的治疗多以随访等保守治疗的方式居多,患者往往承受较大的心理压力,而对于恶性病变的治疗方式多更加谨慎,故不同的乳腺病变治疗方式不同。SMI与US-CNB作为临床辅助检查可以在术前获得乳腺病变的血流信号及病理结果,同时SMI技术又可以指导US-CN,更加个体化、精准化的为患者服务,进一步提高乳腺病变的诊断率。
根据有关文献了解到,肿瘤增殖的过程中主要显示为病变血管的变化,这可能与病变的恶性程度有关,因此对于血管显示的敏感性,超声技术显得尤为重要,而SMI技术的主要优势就是可以运用先进的杂波抑制技术,对病变内的微血管分布进行分析,使难以显现的低速血流显示出来,与彩色多普勒相比,SMI的血管分布指数将是一种先进的多普勒模式[10]。根据有关文献报道,在小儿胃肠道、乳腺结节以及小儿睾丸组织中SMI具有更高的诊断价值,在血流信号显示方面,SMI在描绘血流分支细节和展示微血管信号方面优于CDFI[11-12]。本研究中,通过对110个乳腺结节进行分析,SMI在恶性和良性结节之间产生了不同的血管体积,超过一半的恶性结节表现出丰富的血流信号,而30.12%的良性结节缺乏血供,由此可以了解到肿瘤病变的恶性程度可能与微血管的分布和构成有较好的相关性。
较早有文献报道,恶性病变的乳腺结节,常常会诱发一些血管内皮生长因子大量分泌,从而使一些血管发生扭曲变形,导致病变中的血管发生扩张、变细以及闭塞,病灶随着血流的变化,形成不规则的血管网[13]。因此,病变内部回声不均匀,出现不同类型的血流分布。本研究中,恶性病变中边缘型18个、走形迂曲34个、穿入型26个、杂乱分支22个,可能与上述原因相关。本研究中,经SMI确诊的恶性病变结节共48个,误诊10个,一些恶性病变,比如粘液癌和导管内癌,可能与病变的生长速度有关,生长较慢的病变,多呈膨胀性生长,边界较清,有的内部含有粘液,内部较软,血流信号不丰富,难以检测出血流信号,易被误诊为良性[14];有3例腺病合并炎症者与术后病理不符,可能为炎性因子诱导血管扩张,炎细胞的浸润导致病变部位和血管走行发生变化;国外有学者[15]认为良性的纤维瘤样变与具有高分化的恶性病变相比,微血管的分布与构成并无明显的差异,仅仅依靠血流信号的分析,难以判断病变的进一步变化,本研究得出部分纤维腺瘤伴有不典型增生可能与高分化乳腺癌的微血管走行较为相似,因此,SMI对于血流的显示与CDFI血流显像大致相同,往往不能做出鉴别。本研究中,有2例诊断为乳腺癌,术后病理结果显示为腺病合并纤维瘤,可能是由于大量纤维组织增生,造成部分血管的生长发生变化,在病灶的周边形成直径较宽的血管,而SMI显示过程中病灶边缘血流呈现出穿穿支样血流信号,病变形态发生不规则其周边也呈粗细不均的结构改变[16]。虽然SMI拥有一定的技术优势可以病变的良恶性做出初步诊断,但也有一定的局限性。对于不同类型的病变,SMI对病变的血流分布以及生长方式评估具有很好的优势,但是针对不同病变的分类缺乏一定的特异性,比如,在评估腺病的不同分期时以及合并纤维瘤样变,容易出现假阳性的结果。
由于超声引导下穿刺活检具有较好的操作性,相较于直接进行手术切除,患者较容易接受。依靠微创、出血较少、恢复快等特点,它已经成为乳腺肿物检查不可缺少的一部分。本组研究中有3名患者穿刺后结果为假阴性,病理结果为腺病,考虑2名患者有纤维瘤切除术后病史,可能是乳腺腺病发展到后期,形成硬化性腺病,病变组织发生变化,纤维组织以及瘢痕组织的影响,导致获取的有效组织较少[17-18];其余1例超微血管成像的评估与术后病理结果一致,说明超微血管成像在一定程度上提高了诊断率。在腺病合并炎症的类型中,US-CNB误诊2例,由于病变出现炎症,组织结构发生变化,炎性组织和纤维化增多,获取组织难度增加,往往只能取得碎末状组织,为准确诊断带来了一定的难度。SMI作为一种增强的扫查方式,为超声定位取材提供了一定的血流灌注信息,为穿刺活检提供有效的信息,穿刺过程中在不使用同轴针的情况下,穿刺方向有所偏差,获取的病变组织构成也发生不同变化,获取的目标病理可能较少,对于最后的组织病理可能造成假阴性的结果,而SMI可充分评估目标病灶的微血流信号以及可疑血管,有目标的进行穿刺活检可弥补穿刺活检的一部分不足。本研究主要SMI像对乳腺结节的血流分布进行分析,进一步通过超声引导下穿刺活检获得组织病理结果,结合患者的临床表现和体征,为病变的诊断提供更多的诊断思路,结果表明可以大大提高对病变的诊断。由于选取的研究对象较少,以后的研究过程中需要增加样本量,进一步完成多中心大样本研究。
综上所述,对于乳腺病变的评估过程中,超微血管成像进一步增强了对病变的血管构成信息的获取,可以充分了解病变内的微血流信息。而对于获取病变的病理结果的方式,患者更愿意选择微创、无痛苦、时间短的方式进行取材,超声引导下穿刺活检成为了临床诊疗过程中重要的取材方式,这两种不同的诊断方式的联合运用大大提高了对乳腺病变的评估效能,为临床的诊疗提供更多的诊疗价值。

