振动运动通过AMPK途径改善大鼠衰老心肌细胞线粒体功能的探讨
姜丁文,刘畅
(锦州医科大学附属第一医院内分泌科,辽宁 锦州 121000)
衰老是一种生物学过程,会导致细胞、组织或器官的生理结构和功能的逐渐恶化。研究发现心血管疾病在衰老人群发病率较高[1],衰老会导致心脏功能障碍、心肌收缩力下降、心肌组织纤维化、涉及炎症反应、氧化应激等诸多病理表现[2]。线粒体是细胞的动力,是在融合和分裂状态之间循环的动态细胞器。有研究认为线粒体功能障碍是衰老理论的核心,衰老与线粒体功能下降和线粒体ATP合成减少有关[3]。AMPK是真核细胞中的一种能量受体,可提高适应内外环境变化的能力,从而维持细胞和全身的稳定性[4]。衰老会影响心肌组织的AMPK的表达,而AMPK信号通路的激活可显著减轻老年心脏的心肌损伤[5]。运动能够激活AMPK的表达,延缓与年龄相关的线粒体生物功能的下降[6]。但是由于体能的下降,许多老年人无法进行主动的体育运动,而且不适当的体力活动,会增加易感人群心源性猝死和急性心肌梗死的风险[7]。全身振动运动是利用机械引起肌肉振动的新兴锻炼方法,可产生类似力量锻炼的效果,特别适合老年人使用[8]。振动运动能否改善衰老心肌组织的线粒体功能,目前尚未见报道。因此本研究选取H9C2心肌细胞系,通过D-半乳糖诱导衰老模型,探讨振动运动对衰老心肌细胞线粒体功能的影响及其作用机制。
1 材料和方法
1.1 材料
H9C2细胞购自欣润生物,D-半乳糖购自Sigma 公司,AMPK抗体和p-AMPK 抗体购自Cell Signaling Technology,CPT1B抗体和GAPDH 抗体购自Protentech,PGC1-α抗体购自Affinity公司,荧光二抗购自Abcam,Marker蛋白购自sigma公司,细胞油红O染色、β-半乳糖苷酶试剂盒和线粒体膜电位试剂盒购自碧云天生物技术公司,细胞振动仪为团队自行研发,已获国家专利(专利号:ZL.2016 1 0945337.9)
1.2 方法
1.2.1 细胞冻存
加入EDTA消化,放入37 ℃孵箱 2 min,加入同等体积的含胎牛血清的高糖DMEM培养基,终止EDTA消化,将液体移入15 mL的离心管;1000 r/min离心5 min,弃去上清液;加入冻存液(胎牛血清∶DMSO=9∶1)重悬细胞,分装入冻存管,冻存管口用酒精泡过的封口膜封口,并标记冻存细胞的名称和冻存的时间;缓慢梯度冻存:将要冻存的细胞在4 ℃冰箱放置30 min,在-20 ℃冰箱放置30 min,最后放置于-80 ℃冰箱中保存。
1.2.2 细胞传代
加入EDTA消化,放入37 ℃孵箱 2 min,加入同等体积的含胎牛血清的高糖DMEM培养基,终止EDTA消化,将液体移入15 mL的离心管;1000 r/min离心5 min,弃去上清液;加入增殖培养基(高糖DMEM+10%胎牛血清+1%双抗)重悬沉淀的细胞,置于培养皿或孔板中,摇匀后放于37 ℃孵箱。
1.2.3 细胞复苏
将冻存的H9C2细胞从-80 ℃冰箱拿出来,置于37 ℃水浴,溶化后立刻移出水浴;用移液枪将H9C2细胞移入培养皿,然后加入5 mL增殖培养基,“十”字摇匀,显微镜下观察细胞后,放于37 ℃孵箱;24 h后更换增殖培养基,显微镜下观察细胞的状态。
1.2.4 分组
将细胞以1×105个/毫升的密度接种于培养皿,分为4组,分别为对照组(CO)、衰老组(AG,加入20 g/L的D-半乳糖,处理48 h)、衰老+振动组(AV,加入20 g/L的D-半乳糖,处理48 h,振动频率8 Hz,振动时间20 min)、衰老+振动+AMPK抑制剂组(AV+C,Compound C 10 μM 预处理1 h)
1.2.5 β半乳糖苷酶染色
给予 20 g/L的D-半乳糖诱导48 h 后,然后加入β-半乳糖苷酶染色固定液15 min,配制并加入染色工作液,放 37 ℃恒温箱中过夜,最后在显微镜下观察拍照。
1.2.6 油红O染色
将处理好的细胞拿出细胞间,移液枪吸掉培养基,固定20 min,加入60%异丙醇5 min,避光环境下油红O染色液染色20 min,苏木素染核1 min,再加入油红O缓冲液1 min,吸掉缓冲液,加入三蒸水,显微镜下拍照。
1.2.7 免疫荧光染色
将处理结束后的H9C2细胞用4% PFA固定30 min,0.3% Triton,打孔破膜15 min,羊血清室温封闭2 h,加一抗CPT1B(1∶500),4 ℃过夜,加入荧光二抗(1∶1000),室温放置2 h,加入DAPI 15 min,荧光显微镜下拍照。
1.2.8 Western Blot
将培养皿置于冰上,吸掉培养液,加入1 mL PBS快速刮取培养皿底细胞,转移至1.5 mL的EP管中,以2000 r/min的速度在4 ℃离心3 min,弃掉上清液。加入60~80 μL裂解液(RIPA∶PMSF=99∶1)吹打细胞,冰上静置20 min,每隔10 min吹打细胞,离心(4 ℃,12 000 r/min)25 min,取上清,测定BCA,制成浓度为5 μg/μL的样品,制胶后进行电泳、转膜,5%的封闭液室温封闭2 h,按照maker标记,进行裁膜。将裁好的膜分别加入AMPK、p-AMPK、CPT1B、PGC1-α和GAPDH(1∶1000),4 ℃过夜;第二天把PVDF膜放入二抗(1∶10 000)中,室温放置2 h后用显影液显影,用Image J软件进行图像分析蛋白条带。
1.2.9 线粒体膜电位测定
按照说明书配制 JC-1 染色工作液,细胞培养液与JC-1染色工作液以1∶1的比例加入到细胞中,在细胞培养箱中孵育20 min,在此期间按照说明书配制JC-1染色缓冲液,孵育结束后,吸掉细胞培养液与染色工作液,用缓冲液洗涤细胞2次,然后加入细胞培养液,在荧光显微镜下观察并拍照。
1.3 统计学方法
2 结 果
2.1 β-半乳糖苷酶染色
β-半乳糖苷酶染色结果显示:加入D-半乳糖48 h后,显微镜下衰老细胞呈深蓝色,衰老细胞数明显增加,见图1。
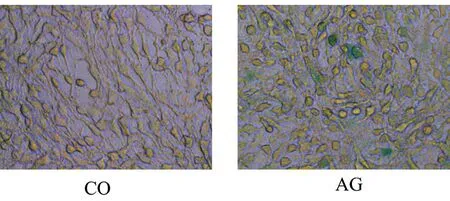
CO:对照组;AG:衰老组
2.2 振动运动减少衰老心肌细胞的脂质沉积
2.2.1 振动运动后各组心肌细胞油红O染色结果
细胞经油红O染色后,脂质沉积部位呈现橘红色,与CO组相比,AG组脂质沉积明显增加;与AG组相比,AV组脂质沉积明显减少,见图2。
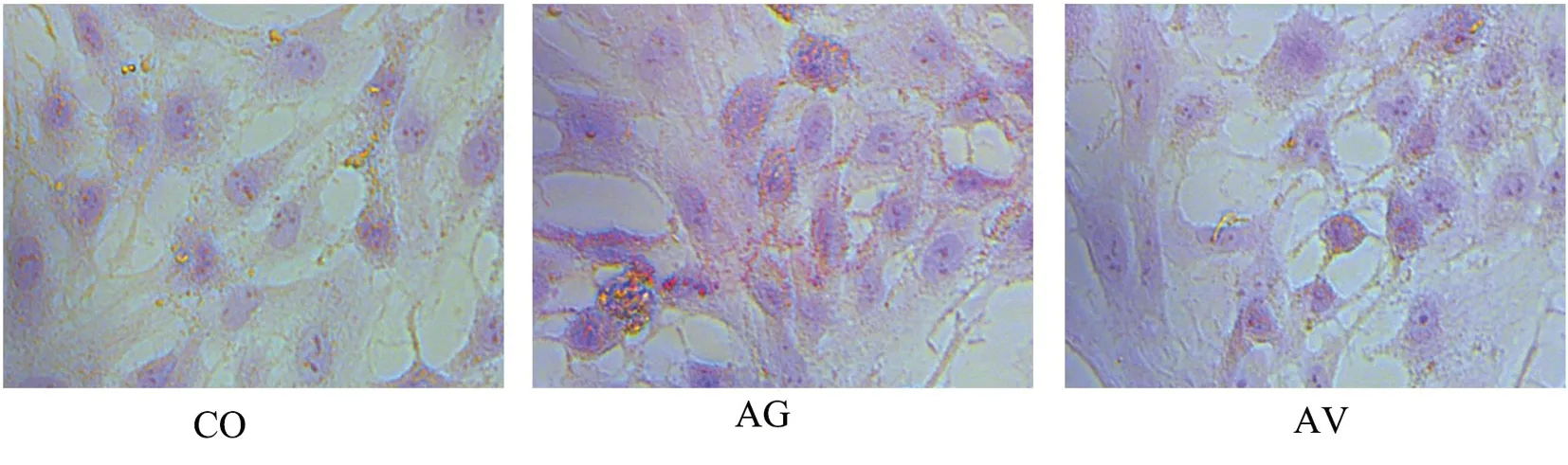
CO:对照组;AG:衰老组;AV:衰老+振动运动组
2.2.2 振动运动后各组心肌细胞CPT1B的Western Blot表达
Western Blot结果:与CO组相比,AG组H9C2细胞CPT1B表达降低(P<0.01);与AG组相比,AV组H9C2细胞CPT1B表达增加(P<0.01),见图3。

CO:对照组;AG:衰老组;AV:衰老+振动运动组,*P<0.05,**P<0.01
2.2.3 振动运动后各组心肌细胞CPT1B的免疫荧光表达
免疫荧光染色结果:AG组CPT1B表达减少,给予振动刺激后,AV组CPT1B表达增加。表明振动运动减少衰老H9C2细胞的脂质沉积,见图4。2.3 振动运动改善衰老H9C2细胞的线粒体膜电位

CO:对照组;AG:衰老组;AV:衰老+振动运动组
免疫荧光结果显示:与CO组相比,AG组红色荧光强度变弱,绿色荧光强度增强,表明线粒体膜电位降低;与AG组相比,AV组红色荧光强度增强,绿色荧光强度增加,表明线粒体膜电位增加,见图5。

CO:对照组;AG:衰老组;AV:衰老+振动运动组
2.4 振动运动改善衰老H9C2细胞线粒体功能
Western Blot结果显示:与CO组相比,AG组H9C2细胞PGC1-α表达降低(P<0.01);与AG组相比,AV组H9C2细胞PGC1-α的表达增加(P<0.01),见图3。
2.5 振动运动通过AMPK途径影响衰老H9C2细胞线粒体功能
2.5.1 振动运动后各组心肌细胞AMPK的Western Blot表达
Western Blot结果:与CO组相比,AG组H9C2细胞p-AMPK/AMPK降低(P<0.01);与AG组相比,AV组H9C2细胞p-AMPK/AMPK升高(P<0.01),见图6。
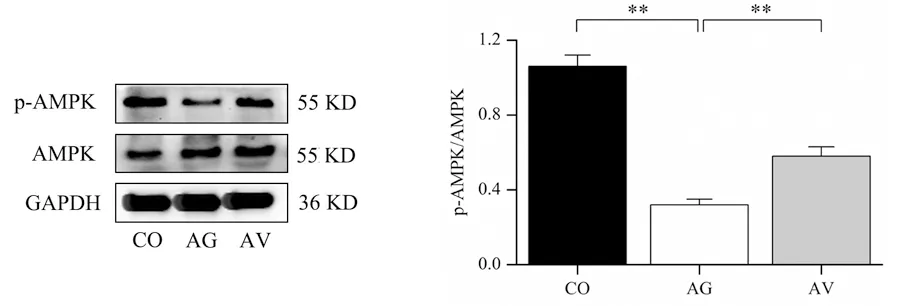
CO:对照组;AG:衰老组;AV:衰老+振动运动组,*P<0.05,**P<0.01
2.5.2 给予AMPK抑制剂后各组心肌细胞CPT1B和PGC1-α的Western Blot表达
Western Blot结果:给予AMPK抑制剂Compound C后,衰老H9C2细胞CPT1B表达降低(P<0.01)、PGC1-α表达降低(P<0.05),见图7。

AG:衰老组;AV:衰老+振动运动组;AV+C:衰老+振动+AMPK抑制剂组,*P<0.05,**P<0.01
3 讨 论
衰老被认为是导致心脏疾病发展的最重要的危险因素,随着年龄的增长,心肌收缩功能显著下降,老年人心脏疾病的发病率和死亡率逐渐增加[5]967-977。AMPK由3个亚基组成,包括催化α亚基、调节β亚基和γ亚基,AMPKα主要在心肌细胞中表达,运动触发α1和α2亚型的激活,α1在高强度的剧烈运动中被激活,而α2在低强度运动中被激活[9]。研究发现衰老会抑制心肌组织AMPK的表达,主动运动可以激活AMPK[9]1825-1841,改善老年大鼠心脏功能[10]。本课题的研究发现通过D-半乳糖诱导的衰老H9C2心肌细胞AMPK的表达减少,而给予振动刺激后AMPK的表达增加,表明振动运动能够激活心肌细胞AMPK的表达。
衰老心肌细胞脂质沉积增加,本研究的油红O染色结果显示振动运动显著减少脂质沉积。肉毒碱棕榈酰转移酶1(carnitine palmitoy transferase 1,CPT1)作为脂肪酸氧化的关键限速酶,位于线粒体的外膜,代表脂肪酸β-氧化的起始和调节步骤[11]。磷酸化的AMPK会导致乙酰辅酶A羧化酶失活,从而降低后者对CPT1的抑制,提高CPT1的活性,从而增加心肌细胞脂肪酸的氧化,减少脂质代谢产物的积累[12]。本实验的结果显示:衰老心肌细胞CPT1的表达减少,振动运动增加CPT1的表达,给予AMPK抑制剂后,CPT1表达减少。
线粒体膜中的多不饱和脂肪酸对维持线粒体膜的完整性以及线粒体的正常生物功能有着重要的作用。而当线粒体脂质被氧化时,线粒体功能会发生障碍[13]。线粒体功能的关键介质之一是PGC-1α,其表达和活性与多种年龄疾病有关。PGC-1α可以调节线粒体的合成和功能,调节脂肪组织的能量代谢[14]。文献报道AMPK可直接激活PGC-1α并调节PGC-1α启动子,PGC-1α通过协调负责线粒体脂肪氧化代谢的CPT1基因的活性,在调控线粒体生物发生中发挥重要作用[15]。我们发现振动运动后衰老心肌细胞PGC-1α表达增加,线粒体膜电位增加,给予AMPK抑制剂后PGC-1α表达减少,线粒体膜电位降低。
综上所述,本研究利用D-半乳糖诱导H9C2细胞制备心肌细胞衰老模型,采用自行研究已经获得国家专利的细胞振动仪实施振动运动,从细胞水平证实了振动运动通过AMPK途径改善衰老心肌细胞的线粒体功能,减少脂质沉积,本研究为振动运动改善衰老心肌细胞线粒体功能提供了实验依据。

