DNA 吸附消除黄曲霉毒素G1
马琼,李军生,黄国霞,阎柳娟,马纪
(广西科技大学生物与化学工程学院,广西柳州 545006)
黄曲霉毒素(Aflatoxin,AFT)是由黄曲霉和寄生曲霉产生的双呋喃环类毒素。衍生物约有20 多种,具有极强的致畸性、致癌性和致突变性,对肺部、肝脏、神经系统等器官具有极强的毒性[1]。1993 年,黄曲霉毒素被世界卫生组织癌症研究机构列为一类致癌物,常见的黄曲霉毒素(B1、B2、G1、G2),AFG1的毒性仅次于AFB1[2,3]。玉米、花生、大豆等农作物在种植、收获、储藏、加工等过程中易滋生毒素。常采用物理、化学、生物等传统方法去除黄曲霉毒素[4-8]。虽然吸附、热处理、萃取等物理方法可以去除黄曲霉毒素,但存在去除效率较低、成本高、对温度的要求较高等问题。经酸碱、氧化还原等化学方法处理易产生副产物以及残留试剂,导致二次污染。生物方法主要采用微生物或其产生的酶及其制剂来对黄曲霉毒素进行去除,过程中有可能产生新的有毒物质。所以研究一种高效去除黄曲霉毒素的方法十分必要。DNA 是生物体内主要的遗传物质,广泛存在于自然界中,具有极高的生物安全性。黄曲霉毒素属呋喃香豆素的衍生物,是一类典型DNA 嵌入剂分子,因此,通过生物安全的DNA 选择性主动俘获消除黄曲霉毒素的创新构想,正好为更加安全高效地消除黄曲霉毒素提供了新思路和借鉴。
DNA 主要由含氮碱基、戊糖和磷酸骨架组成,具有独特的双螺旋结构,对许多平面芳香结构的化合物具有很好的亲和力[9]。1961 年,Lerman[10]发现吖啶分子可以通过疏水作用、氢键、离子相互作用、范德华力等非共价作用方式嵌入DNA 双螺旋结构中。类似吖啶的多环小分子化合物能与DNA 通过非共价相互作用嵌入DNA 碱基对之间并与之形成嵌插复合物,诸如吖啶、溴化乙锭、道诺霉素以及蒽醌类复合物等多环类化合物[11-13],通过对这些多环类化合物的深入研究,构建了成熟的DNA 嵌入理论。利用嵌入剂所具有的嵌入性质,可以设计出高效的DNA 嵌入剂,用于选择性去除有害的多环类化合物。同时,本实验室通过共振散射光谱对AFB1、多环芳烃、茜草色素光泽汀以及大黄素等多种平面小分子与DNA 的相互作用进行研究[14-18]。依据DNA 嵌入理论设计的一系列新型吸附材料,如磁珠负载DNA、DNA 凝胶珠、DNA 组装的聚砜颗粒等DNA 嵌插材料[19-21],用以选择性去除溴化乙锭、多环芳烃、吖啶橙等有害物质。
紫外光谱、共振散射光谱、圆二色谱等实验已经充分证明AFG1与DNA之间的相互作用是典型嵌插结合模式[22]。为此,本文首先通过共振散射光谱检测AFG1的DNA 结合饱和值,并通过AFG1的DNA 结合饱和值进一步评价AFG1嵌入DNA 分子的能力大小。然后,再通过检测AFG1的DNA 结合饱和值变化,揭示温度、pH、氯化钠、氯化钙、L-天冬氨酸、葡萄糖、尿素、亮氨酸、赖氨酸等外部因素的变化对AFG1嵌入DNA 分子能力的影响,据此构建和进一步优化DNA 选择性吸附消除AFG1的有效方法。最后通过吸附动力学、等温吸附模型以及吸附热力学等进一步探究DNA 选择性吸附AFG1过程,为探索构建一种新型高效去除黄曲霉毒素的方法提供参考。
1 材料与方法
1.1 试剂与仪器
AFG1(Pribolab 公司)溶液的配制:利用适量的φ=98%无水乙醇溶解AFG1粉末后用Tris-HCl 缓冲溶液稀释至所需浓度待用。DNA(Solarbio Science 公司)溶液的配制:超纯水溶解DNA 粉末,于0~4 ℃下保存,其纯度以260 nm 与280 nm 吸光度的比值检测(A260nm/A280nm=1.87>1.8,符合试验要求),由公式C=A/εL(ε=6 600 L/(mol·cm))确定浓度。活性炭的配制:取1.25 mg 活性炭用Tris-HCl 浸泡活化一段时间稀释待用。Tris-HCl 缓冲液的配制:按照不同比例将0.1 mol/L Tris(三羟甲基氨基甲烷)与0.1 mol/L HCl溶液混合配制成一系列的缓冲液待用。环境共存物的配制:环境共存物均以0.1 mol/L 配制稀释成所需浓度待用。绑定液的配制:按比例将0.01 mol/L Tris-HCl(pH 值8.0)与0.001 mol/L EDTA 配制成绑定液待用。磁珠,富生物科技有限公司。
荧光分光光度计,Cary Eclipse Agilent;紫外分光光度计,Cary 60 Agilent Technologies;DF-101S 集热式恒温加热磁力搅拌器,巩义市予华仪器有限责任公司;恒温振荡器,IS-RDV3 CRYSTAL;TGL-16G 高速离心机,上海市安亭科学仪器厂。
1.2 DNA 结合饱和值
1.2.1 共振散射光谱与DNA 结合饱和值检测
在30 ℃条件下,首先向1.0×1.0 cm 的石英比色皿中加入2 mL 的AFG1溶液(pH 值为7.40,5.31×10-7mol/L)待溶液稳定时于荧光分光光度计上进行同步扫描并记录。随后每次滴加10 μL DNA 溶液于AFG1溶液,充分混匀后静置10 min 扫描共振光散射光谱,当溶液共振光散射强度不再发生变化时,此时达到饱和,根据公式计算DNA 结合饱和值。
1.2.2 环境因素对AFG1-DNA结合饱和值的效果
向试管中分别加入0.5 mL AFG1、0.5 mL DNA、1 mL 环境因素、1 mL pH 值7.40 的Tris-HCl 缓冲液,经恒温振荡器摇匀,静置5 min 待溶液稳定后,扫描并记录共振散射光谱。选择对AFG1-DNA 影响最大的共振散射强度对应的环境因素的浓度,测定DNA 结合饱和值。
1.3 吸附因素对AFG1去除率计算
1.3.1 AFG1标准曲线
以不同浓度的AFG1为横坐标,对应的荧光强度为纵坐标,绘制出AFG1的标准曲线,如图1。
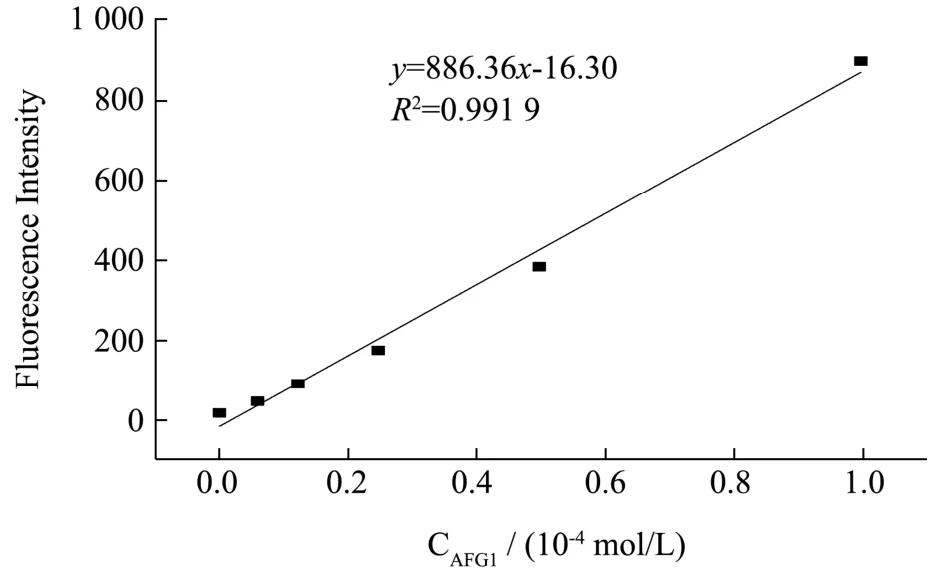
图1 荧光光谱测定AFG1的标准曲线Fig.1 Standard curve for determination of AFG1 by fluorescence spectroscopy
1.3.2 DNA 和活性炭在去除AFG1效果的比较
首先将100 μL AFG1和100 μL DNA 混匀后在30 ℃下反应10 min、随后依次加入100 μL 磁珠、200 μL 绑定液等放置于EP 管内,摇匀,然后放置于恒温振荡器中反应60 min,用磁铁分离上清液,经离心后,扫描上清液的荧光光谱(Ex=370 nm;扫描范围:220~600 nm;扫描速度:快;Ex silt=10 nm;Em silt=10 nm)并记录。代入标准曲线(荧光强度与AFG1浓度的线性曲线)求出Ct。其中,AFG1与DNA结合的量由AFG1吸附量(Q)和AFG1去除率(%)确定,其计算公式如下[23]。将活性炭替代DNA 做类似处理,其中活性炭在pH 值为7.40 的Tris-HCl 缓冲液中活化一段时间后,加入AFG1溶液反应,实验条件以及计算方法同DNA。

式中:
Q——吸附剂的吸附容量,mg/g;
F——AFG1去除率,%;
C0——AFG1的初始浓度,mol/L;
Ct——AFG1的平衡浓度,mol/L;
V——溶液体积,L;
m——吸附剂的质量,g。
1.3.3 共存物对AFG1去除率的效果
向EP 管内分别加入100 μL AFG1溶液、100 μL DNA 溶液、100 μL 磁珠、100 μL 环境因素、200 μL绑定液,其操作条件以及方法同1.3.2,计算共存物对AFG1去除率。
1.4 DNA 对AFG1吸附行为的研究
1.4.1 速率模型
吸附动力学描述了吸附剂的吸附速率。测定不同时间下每单位质量的吸附剂的吸附量,常用Pseudo-first Order Kinetics 模型(3)和Pseudo-second Order Kinetics 模型(4)来描述。用线性公式表示如下[24]:
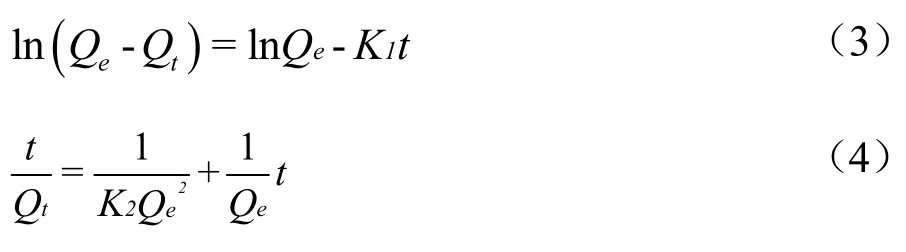
式中:
Qe——平衡时每单位质量的吸附剂的吸附质量,mg/g;
Qt——在t时刻每单位质量的吸附剂的吸附质量,mg/g;
t——时间,min;
K1——准一阶吸附速率常数,1/min;
K2——准二阶吸附速率常数,g/(mg·min)。
1.4.2 等温吸附模型
用Langmuir 和Freundlich 吸附等温线来分析等温吸附过程[24],评价吸附剂的吸附特性、吸附容量和表面性质。Langmuir 和Freundlich 等温线的一般形式由式(5)、(6)给出。

式中:
Qe——单位重量吸附剂对AFG1的吸附量,mg/g;
Qmax——AFG1的最大吸附量,mg/g;
Ce——达到吸附平衡时对AFG1的吸附量,mg/g;
KL——与吸附能相关的Langmuir 常数,L/mg;
Kf——Freundlich 常数,mg/g;
1/n——吸附剂表面的不均匀程度。
1.4.3 热力学模型
在30、35、40、45 和50 ℃的温度下,分析吸附热过程。利用Vant Hoff 方程(7)~(9)[25]确定吸附过程的ΔH0和ΔS0。


式中:
K——吸附分布常数;
ΔH0——焓变;
ΔS0——熵变;
T——开尔文温度;
R——气体常数8.314 J/(K·mol);
ΔH0——由斜率计算;
ΔS0——由lnK和1/T拟合的曲线(9)的截距计算。
1.5 去除花生油中的AFG1
向花生油样品中加入适量AFG1标准液,得到AFG1浓度为84.75 μg/L 的花生油样品。用DNA(25.00×10-3μg/mL)吸附去除污染花生油中的AFG1。在最佳吸附温度和吸附时间下,加入磁珠,反应80 min,经磁铁分离磁珠,洗脱后萃取,然后用荧光光谱法测定洗脱液中AFG1的荧光强度。AFG1浓度的计算方法同1.3。
1.6 数据处理
本试验中采用Excel 2016 以及SPSS 19.0 进行数据分析处理,采用Origin 2018 绘制分析图以及模型拟合的分析处理。
2 结果与分析
2.1 DNA 结合饱和值
2.1.1 DNA 结合饱和值的检测
DNA 结合饱和值可以用来评价平面小分子与DNA 嵌插结合能力的大小。平面小分子与DNA 分子的结合的位点和数量是确定的,其结构决定了嵌入DNA 的能力强弱。当平面小分子的浓度过量时,共振光散射信号随着DNA 浓度的增加而增强。然而,当DNA 浓度达到极限时,即使DNA 浓度增加,共振散射信号也不再增加。此时的DNA 浓度为饱和DNA 浓度(计算公式如(10))。图2 可知,在30 ℃,pH 值7.4 条件下,当AFG1的浓度一定时,随着DNA 浓度的增加,共振散射信号也逐渐增加,但是当DNA 的浓度达到3.19×10-7mol/L,共振散射峰信号强度不再增强。此时,认为AFG1与DNA 的结合达到饱和,DNA 结合饱和值为1.66。溴化乙锭和补骨脂素是非常典型的DNA 嵌入剂,实验室前期人员还对溴化乙锭、黄曲霉毒素B1、补骨脂素的DNA 结合饱和值(表1)进行了测定。从表中可以看出AFG1与DNA 的结合和饱和值小于溴化乙锭和AFB1的结合饱和值,但是大于补骨脂素的DNA 的结合饱和值。所以,AFG1与DNA的结合能力小于溴化乙锭和AFB1,大于补骨脂素。

表1 不同试剂与DNA 相互作用的DNA 结合饱和值Table 1 DNA binding saturation values of interaction between different reagents and DNA
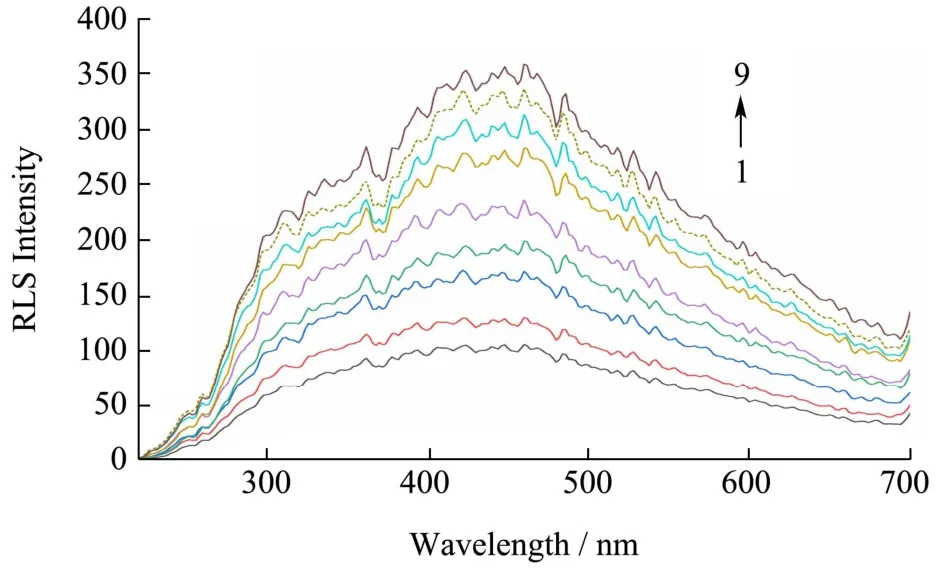
图2 DNA 浓度对AFG1-DNA 共振散射光谱的影响Fig.2 Effect of DNA concentration on resonance scattering spectra of AFG1-DNA

式中:
Z——DNA 结合饱和值(BSV);
Cm——平面小分子的浓度,mol/L;
Cn——饱和DNA 的浓度,mol/L。
2.1.2 环境因素对AFG1-DNA结合饱和值的影响
2.1.2.1 温度和pH 对AFG1-DNA 结合饱和值的影响
由图3a 可知,随着温度的升高,信号强度先增大后下降,开始时分子与分子之间的相对运动加快。30 ℃时,共振散射峰信号强度最大,温度的升高,DNA双链受热解旋,结构不稳定,不利于AFG1-DNA 结合。25 ℃、30 ℃以及35 ℃的饱和值分别为1.38、1.66、1.23。30 ℃时饱和值最大,AFG1-DNA 的结合能力最强,因此30 ℃为AFG1-DNA 的相互作用的适宜温度[27]。
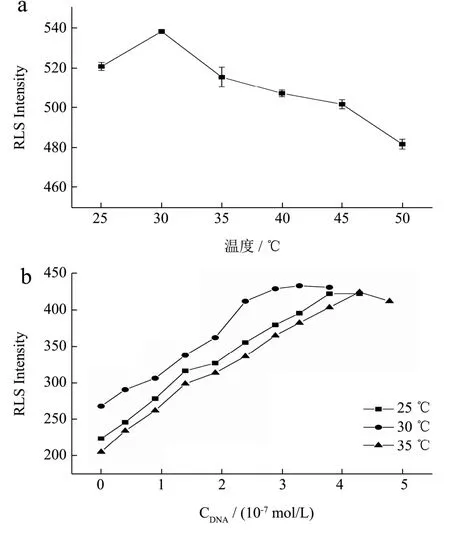
图3 (a)温度对AFG1-DNA 共振散射峰信号的影响,(b)不同DNA浓度下对AFG1-DNA 的共振散射强度的影响Fig.3 (a) Effect of temperature on the resonance scattering peak intensity of AFG1-DNA;(b) Effect of DNA concentration on resonance scattering intensity (p<0.05)
图4 为pH 值对AFG1-DNA 嵌插结合的影响,在pH 值5.80~7.40 之间,体系溶液呈现酸性,共振散射峰信号强度逐渐增大,DNA 双链中的氢键在酸性条件下,不稳定且易断裂,同时溶液中的氢离子与DNA 中带负电的磷酸基团相互吸引,大量的氢离子聚集在DNA 碱基周围,阻碍了AFG1与DNA 相互结合。在pH 值7.40~9.00 之间,体系溶液呈现碱性,使得DNA 变性解旋,导致AFG1与DNA 相互结合的部位减少,共振散射峰信号逐渐减弱[28]。在pH 值5.80、7.40 和9.00 的条件下,AFG1-DNA 结合饱和值分别为1.47、1.66、1.65,pH 值7.40 时,AFG1-DNA 结合饱和值最大,因此,pH 值7.40 为AFG1-DNA 的相互作用的适宜pH 值。

图4 pH 对AFG1-DNA 共振散射峰信号的影响Fig.4 Effect of pH on resonance scattering peak signal of AFG1-DNA (p<0.05)
2.1.2.2 氯化钠、氯化钙、L-天冬氨酸和葡萄糖对AFG1-DNA 结合饱和值的影响
图5a 中,NaCl 的浓度在0~1.00×10-5mol/L 之间时,AFG1-DNA 共振散射峰信号先增大后减小。原因可能是由于在低离子强度时钠离子与DNA 中带负电的磷酸基团反应,静电相互吸引从而有利于AFG1-DNA 的相互作用,随着离子强度的增加,DNA断裂,破坏了DNA 分子的稳定性,DNA 的结构发生变化[29]。固定氯化钠和 AFG1的浓度分别为1.00×10-5mol/L 和5.31×10-7mol/L 时,AFG1-DNA 结合饱和值为1.45。
图5b 所示,0~1.00×10-7mol/L 之间,随着钙离子浓度的增加,遂导致AFG1-DNA 的共振散射峰信号强度增加,钙离子对磷酸盐有高化学亲和性,不是在DNA 表面简单的缩合,而是在DNA 碱基中的磷酸基团点状吸附,逐渐聚集在 D N A 的周围。在1.00×10-7mol/L~1.00×10-4mol/L 范围内,随着钙离子浓度的增加,体系溶液富含大量钙离子,钙离子与DNA 的这种极化效应不会一直增加,所以,AFG1-DNA 的共振散射峰信号强度减弱。由于钙离子吸附在DNA 的周围,阻碍了AFG1-DNA 的结合[30]。固定氯化钙和AFG1的浓度为1.00×10-7mol/L 和5.31×10-7mol/L 时,AFG1-DNA 结合饱和值为1.45。
如图5c,0~1.28×10-8mol/L 时,AFG1-DNA 的相互作用的共振散射峰信号强度逐渐增加,在浓度1.28×10-8mol/L~1.60×10-6mol/L 范围内变化时,AFG1-DNA的相互作用的共振散射峰信号强度逐渐减弱。原因可能是天冬氨酸带负电与DNA 中带负电的磷酸基团相互排斥从而影响结构的稳定性,不利于AFG1与DNA 相互作用[31]。固定L-天冬氨酸的浓度为1.28×10-8mol/L,AFG1-DNA 结合饱和值为1.29。
由图5d 可知,葡萄糖浓度在0~6.10×10-7mol/L范围内变化时,共振散射信号先增大后减小。原因可能是蛋白质在体内和体外都容易发生糖基化,与蛋白质类似,糖基化也可能会影响DNA 的结构。在体外,葡萄糖的羰基与DNA 中的碱基的反应与葡萄糖的羰基和蛋白质的氨基发生的非酶促反应类似,破坏DNA双链的完整性,使得DNA 结构不稳定,不利于AFG1与DNA 的相互作用[32]。固定葡萄糖的浓度为6.10×10-7mol/L,AFG1-DNA 结合饱和值为1.05。

图5 氯化钠(a)、氯化钙(b)、L-天冬氨酸(c)、葡萄糖(d)的浓度变化对AFG1-DNA 共振散射峰强度的影响Fig.5 Effects of the concentration changes of sodium chloride(a),calcium chloride (b),L-aspartic acid (c) and glucose (d) on the intensity ofAFG1-DNA resonance scattering peak
2.1.2.3 尿素、亮氨酸、L-赖氨酸和维生素C 对AFG1-DNA 结合饱和值的影响
由图6a 可知,尿素的浓度在0~3.20×10-6mol/L之间变化时,随着尿素浓度的变化,尿素溶液中的带正电的铵根离子与DNA 碱基中带负电的磷酸基团相互吸引,通过静电相互作用结合,使得DNA 分子的结构变得稳固,有利于AFG1-DNA 的相互作用。但是当尿素浓度逐渐变大时,高浓度的尿素使得DNA 发生变性解旋。从而不利于AFG1与DNA 的相互作用。同时,尿素分子存在于生物分子周围,影响生物分子的性质和相互作用,作为一种良好的氢键受体和供体,尿素不仅可以与芳香基团发生特殊的结合,也可以与核酸碱基类似物,核甘和单磷酸核甘等模型化合物结合,并且优先与后者模型化合物结合[33]。固定尿素的浓度为3.20×10-6mol/L,AFG1-DNA 的结合饱和值为1.95。由此可以推测,适宜浓度的尿素溶液,有利AFG1-DNA 的相互作用。
图6b 可知,在0~1.28×10-8mol/L 浓度范围内,随着亮氨酸的浓度的增加,对AFG1与DNA 相互作用的共振散射强度的影响时先增加后减弱,由曹伟娜等研究结果,我们可以推测,亮氨酸与DNA 带负电的磷酸基团发生静电结合现象,DNA 分子结构收缩,DNA 结构趋于稳定[34]。当亮氨酸的浓度不断增加的过程中,亮氨酸的存在对DNA 双螺旋结构的构象的影响不显著,促进作用不明显。固定亮氨酸的浓度为1.28×10-8mol/L,AFG1-DNA 的结合饱和值为1.95。基于以上分析可以推测亮氨酸有利于AFG1与DNA的相互作用。
图6c 赖氨酸的浓度为0~4.00×10-7mol/L 为范围内变化时,AFG1-DNA 的相互作用的共振散射峰信号强度逐渐增加,在4.00×10-7~1.00×10-5mol/L 范围内变化时,共振散射峰信号强度逐渐减弱。固定赖氨酸的浓度为4.00×10-7mol/L,AFG1-DNA 的结合饱和值为2.32。原因可能是带正电荷的赖氨酸与DNA 中带负电的磷酸骨架相吸引,增强DNA 链刚性构象,从而使DNA 的分子结构趋于稳定。有利于AFG1与DNA 的相互作用[31]。
如图6d 在浓度0~1.02×10-9mol/L 范围内时,共振散射峰信号强度逐渐增加,在浓度1.02×10-9~3.2×10-6mol/L 范围内变化时,共振散射峰信号强度逐渐减弱。固定维生素C 的浓度为1.02×10-9mol/L,AFG1-DNA 结合饱和值为2.90。原因可能是在适宜浓度下对DNA 氧化损伤有保护作用。保护了DNA 结构的完整性,从而有利于AFG1与DNA 的结合[35]。

图6 尿素(a)、亮氨酸(b)、赖氨酸(c)、维生素C(d)的浓度变化对AFG1-DNA 共振散射峰强度的影响Fig.6 Effect of the concentration changes of urea (a),leucine (b),lysine (c) and vitamin C (d) on the intensity of AFG1-DNA resonance scattering peak
在30 ℃,pH 值7.40 的条件下,添加共存物后时,AFG1的结合饱和值的变化见表3。根据DNA 结合饱和值的变化可知,氯化钠和氯化钙、葡萄糖以及L-天冬氨酸存在时,AFG1的DNA 结合饱和值小于基准条件下的DNA 结合饱和值,尿素、赖氨酸、亮氨酸以及维生素C 存在时,AFG1的DNA 结合饱和值大于基准条件下的DNA 结合饱和值。共存物的浓度、黏度以及带电性等因素均可能对AFG1与DNA嵌插结合产生影响,其中氯化钠和氯化钙、葡萄糖以及带负电基团的L-天冬氨酸不利于AFG1嵌入DNA 分子。而带正电基团的尿素、赖氨酸以及亮氨酸、维生素C等有利于AFG1嵌入DNA 分子。
2.2 影响DNA 对AFG1吸附的因素分析
2.2.1 DNA 用量、温度和反应时间对AFG1去除率的影响
由图7a 可知,AFG1的去除率逐渐增加,DNA 的用量达到2.50×10-5g/mL 时,去除率为86.42%,之后去除率不再发生显著的变化,表明吸附接近平衡。正如Hashem[36]所述,随着DNA 用量的不断增加,吸附位点的不饱和度逐渐降低,单位面积的吸附位点的数量相应的也减少。此外,吸附剂的颗粒过多拥挤,导致吸附位点重叠,不能对AFG1进行有效的吸附。

图7 DNA 用量、温度、反应时间对AFG1去除率的影响Fig.7 Effects of DNA dosage,temperature,and reaction time on AFG1 removal rate
图7b 表明,在30 ℃时,去除率为87.08%,随着温度的升高,AFG1的吸附率逐渐减小,原因可能是随着温度的升高,DNA 的结构变得松散不稳定,不利于AFG1与DNA 的嵌插作用,从而使得AFG1从DNA中脱落下来,解吸在溶液中。
图7c 为DNA 对AFG1的吸附率随时间的变化情况,80 min 时,AFG1的去除率达到了88.14%,80 min之后,AFG1的去除率几乎不发生变化。吸附过程是缓慢而动态的,初始阶段AFG1快速与DNA 上的结合位点结合。随着吸附时间的延长,有效的吸附位点逐渐减少,导致吸附速率也随之缓慢,表明吸附达到平衡状态。
2.2.2 DNA 和活性炭对AFG1去除率的影响
基于AFG1与DNA 嵌插结合作用,利用DNA 吸附AFG1,并进行了活性炭去除水中AFG1的实验对比,DNA 和活性炭对AFG1的吸附量见表2。DNA 对AFG1吸附量为7.54×10-3mol/g(2 180.34 mg/g),AFG1去除率为88.14%。活性炭对AFG1的吸附量为3.66×10-5mol/g(9.10 mg/g),去除率为75.67%,与传统活性炭法相比,DNA 去除AFG1的效果较好,即DNA 含量仅为活性炭的1/125。实验结果表明,DNA能有效地去除AFG1。

表2 DNA 和活性炭吸附AFG1的效果Table 2 Effect of DNA and activated carbon on adsorption of AFG1
2.2.3 共存物对AFG1去除率的影响
通过DNA 结合饱和值的大小,预测共存物对AFG1-DNA 嵌插结合的影响,在此基础上,观察DNA吸附AFG1的效果。如表3,在30 ℃,pH 值7.40 条件下,当DNA 用量为2.50×10-3mg 时,AFG1的浓度为1.20×10-4mol/L 时,AFG1的去除率为88.14%。添加共存物后,根据DNA 结合饱和值以及AFG1的去除率可知,氯化钠、氯化钙、L-天冬氨酸和葡萄糖不利于DNA 对AFG1的吸附,尿素、亮氨酸、赖氨酸和维生素C 有利于DNA 对AFG1的吸附。
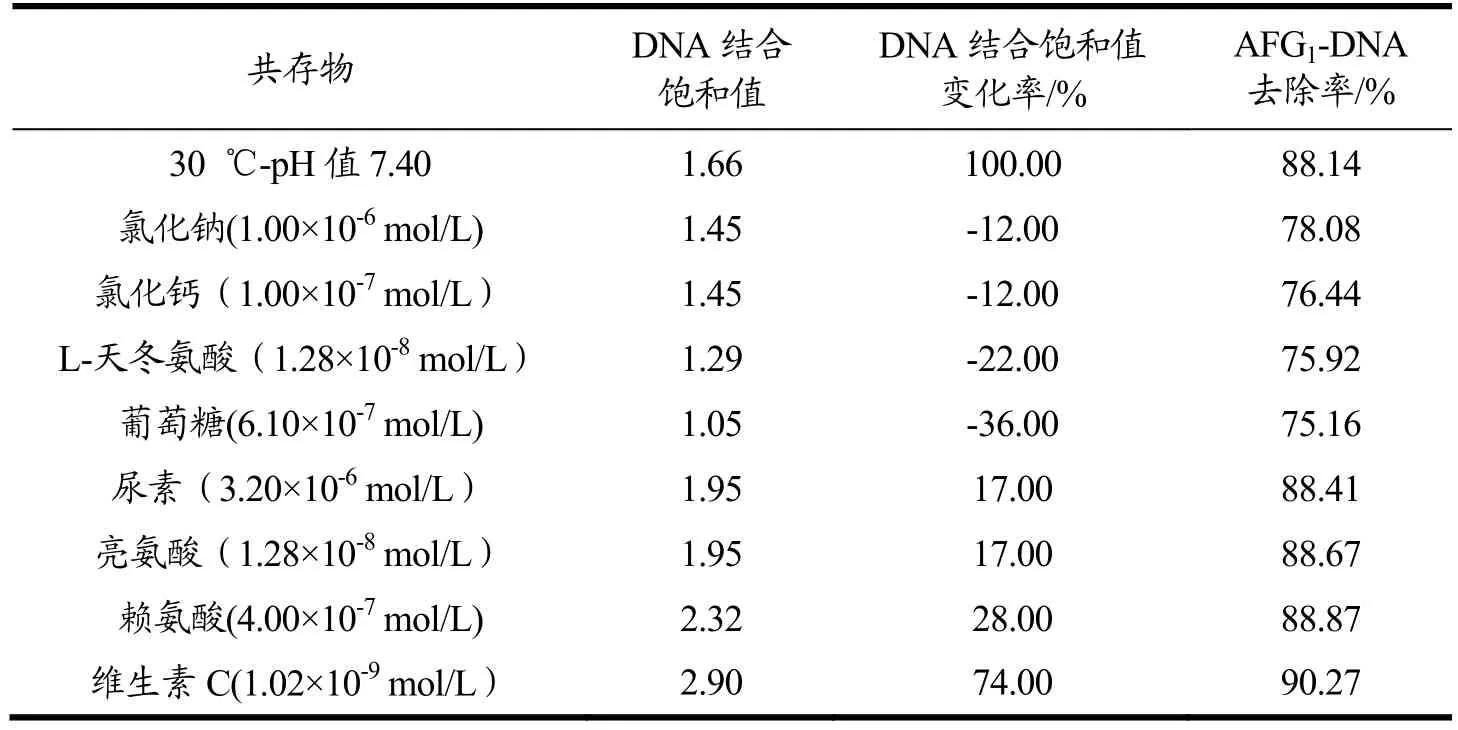
表3 DNA 结合饱和值以及AFG1去除率Table 3 DNA binding saturation value and AFG1 removal rate
2.3 DNA 对AFG1吸附行为的研究
2.3.1 速率模型
准一阶和准二阶两种动力学模型的动力学参数分别显示在图8a、8b 和表4,当DNA 的用量为1.00、1.50、2.50 μg 时,准二阶动力模型的相关系数(0.997 0、0.998 8、0.999 2)均大于准一阶动力学模型(0.754 3、0.689 6、0.836 9),这一结果表明:准二阶动力学模型有较好的相关性。根据准一阶动力学方程计算,DNA对AFG1的最大吸附量(238.65、123.46、80.38 mg/g)。而根据准二阶动力学方程计算DNA对AFG1的最大吸附量(469.48、303.95、194.93 mg/g),更接近实验Qe的值。吸附过程更符合准二阶动力学模型的描述,表明吸附过程的限速步骤为化学相互作用。

表4 不同附剂用量下准一阶和准二阶动力模型的动力学参数Table 4 Kinetic parameters of pseudo-first order and pseudo-second order models under different dosage of additives
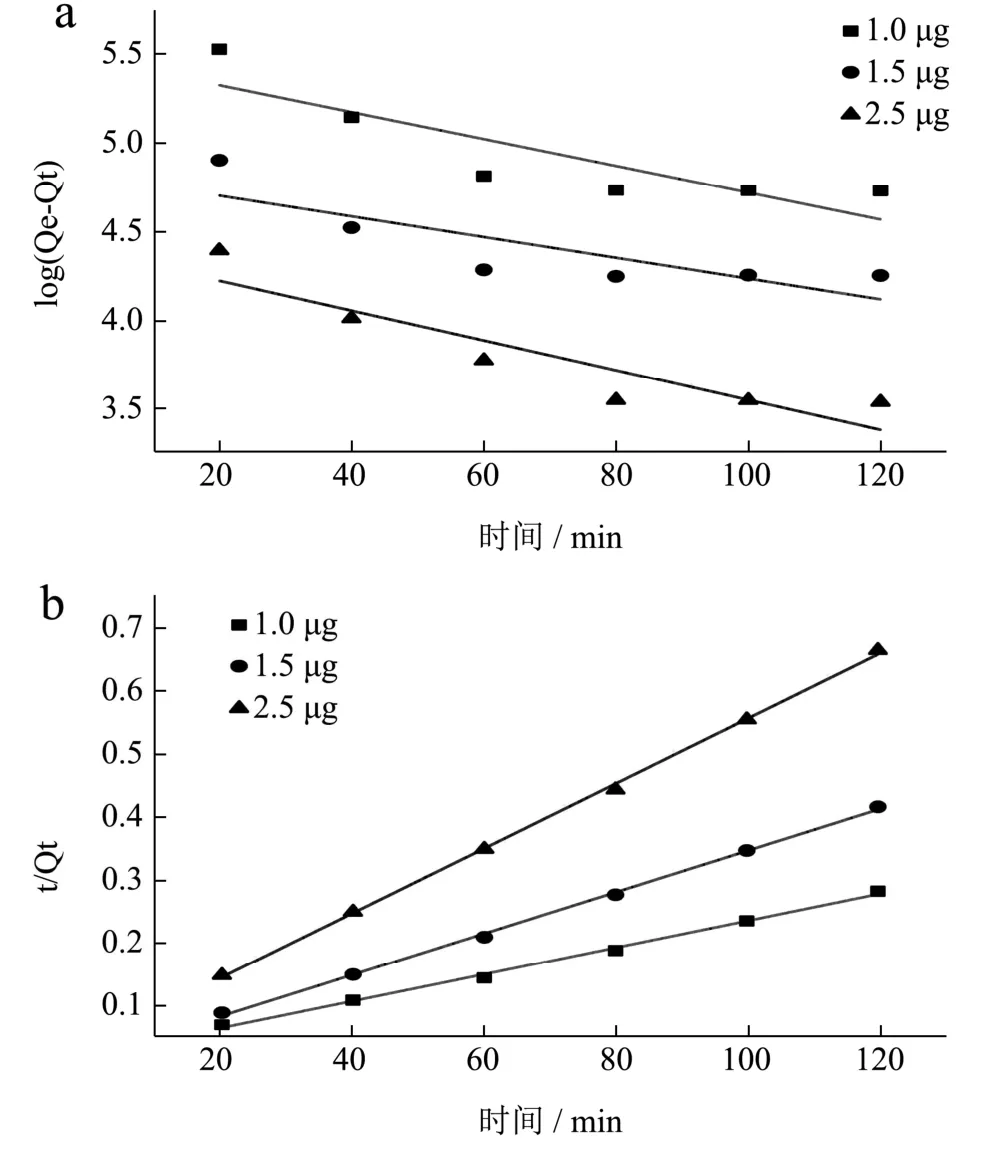
图8 (a、b)分别为准一阶和准二阶动力模型线性拟合图Fig.8 (a,b) shows the linear fitting diagram of pseudo-first order and pseudo-second order model
2.3.2 等温吸附模型
等温吸附的平衡吸附容量为最大吸附容量。Langmuir 和Freundlich 模型的参数如表5。Freundlich模型的相关系数(0.999 9)大于Langmuir 模型的相关系数(0.974 8)。Langmuir 模型所揭示的吸附过程为单层吸附,而Freundlich 模型所揭示的吸附过程为多层吸附。根据实验所得结果,DNA 对AFG1的吸附过程更符合Freundlich 模型,该吸附过程为多层吸附。
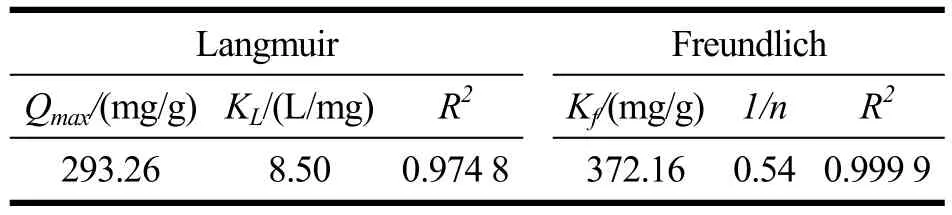
表5 等温吸附模型的相关参数Table 5 Parameters of Langmuir and Freundlich isothermal adsorption models

图9 (a)(b)分别为Langmuir、Freundlich 等温吸附模型Fig.9 (a) and (b) show Langmuir and Freundlich isothermal adsorption models respectively
2.3.3 热力学模型
表6 可知,ΔH0(-90.33)<0,表明DNA 对AFG1的吸附是一个放热过程。ΔS0(307.33)>0,说明体系中溶液的无序性增加,计算得到标准自由能ΔG0<0,说明该吸附过程是能够自发进行的放热反应。
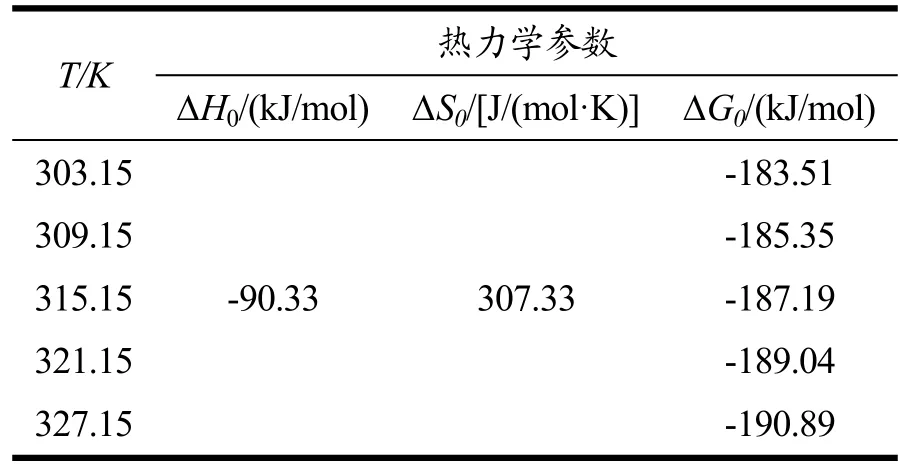
表6 不同温度下AFG1在DNA 上吸附的热力学参数Table 6 Thermodynamic parameters of AFG1 adsorption on DNA at different temperatures
2.4 除去花生油中的AFG1
在超市购买的花生油中添加适量的AFG1,此时测得花生油中AFG1的含量为84.75 μg/kg,在花生油中的去除率达到了 85.25%~86.46%,残留量在11.47~12.50 μg/kg,结果表明,利用AFG1与DNA 嵌插结合,可以去除油中的AFG1。由于花生油的产地和工艺的差别,AFG1的含量存在差异。测得两个地区售卖的毛油中AFG1的浓度分别为82.70、99.01 μg/kg,去除率在 80.48%~85.45%之间。且残留量在14.42~18.37 μg/kg 之间。Rosa 等[37]采用生物吸附的方法吸附时间为6 h 时,AFG1的去除率为82.00%。杜黎等[38]通过冷等离子体处理后降解大豆油中黄曲霉毒素的去除率仅为79.65%。综上DNA 可以有效的去除黄曲霉毒素。

表7 除去花生油中黄曲霉毒素G1Table 7 Pollution of aflatoxin G1 from different sources
3 结论
本文利用DNA 嵌插原理去除AFG1,通过DNA构建选择性消除AFG1的方法。通过对温度、pH 值、氯化钠、氯化钙、葡萄糖、维生素C 等外部因素的探究。进一步优化DNA 去除AFG1的条件。实验结果表明,AFG1的浓度为5.31×10-7mol/L 时,30 ℃,pH 值7.40 为AFG1嵌入DNA 分子的最佳条件,此时DNA结合饱和值为1.66 和去除率为88.14%,NaCl、CaCl2、L-天冬氨酸、葡萄糖、尿素、亮氨酸、赖氨酸、维生素C 等外部因素存在下,其DNA 结合饱和值分别为1.45、1.45、1.29、1.05、1.95、1.95、2.32 和2.90。去除率分别为78.08%、76.44%、75.92%、75.16%、88.41%、88.67%、88.87%、90.27%。根据DNA 结合饱和值以及AFG1的去除率的结果可知环境因素的浓度、黏度以及带电性等均可能对DNA 吸附AFG1产生影响,其中氯化钠和氯化钙、葡萄糖在实验浓度下不利于DNA 吸附消除AFG1以及带负电基团的L-天冬氨酸也不利于AFG1嵌入DNA 分子。而带正电基团的尿素、赖氨酸以及亮氨酸、维生素C 等有利于AFG1嵌入DNA 分子,进而对DNA 消除AFG1产生影响。并且通过与活性炭对比可知,当活性炭为DNA 用量的125 倍时,DNA 的去除率为88.14%,而活性炭的去除率为75.67%仍低于DNA 的去除效率,所以DNA能较好的去除AFG1。影响吸附过程的原因除了以上环境因素外,与DNA 用量、温度以及反应时间有关。实验结果表明,在30 ℃、DNA 用量为2.50×10-5g/mL时,DNA 吸附AFG1在80 min 时接近平衡,AFG1去除率为88.14%。通过动力学数据和热力学参数的结果可知,得出DNA 对AFG1的吸附过程符合准二级动力学模型,表明吸附过程的限速步骤为化学相互作用。Langmuir(R2=0.974 8)和Freundlich(R2=0.999 9)等温吸附模型拟合结果表明吸附过程更加符合Freundlich 模型,该吸附过程为多层吸附。热力学模型拟合参数显示该过程是自发进行的放热过程。去除花生油中的AFG1,其去除率在80.48%~86.46%。残留量在11.00~18.37 μg/kg。本文对DNA 吸附消除黄曲霉毒素G1进行了初步探索。有望应用于DNA 固定化的研究,将DNA 与丝素纤维、丝素蛋白交联构建DNA固定化材料,进一步消除AFG1。

