褪黑素减轻猕猴桃果实冷害与碳水化合物代谢的关系
李素方,苏金龙,张楚瑶,郭婉君,高慧
(西北大学食品科学与工程学院,陕西西安 710069)
猕猴桃是原产于我国的一种特色浆果,它皮薄多汁、口味酸甜清香,营养甚为丰富,故深为全世界消费者所喜爱。猕猴桃果实以鲜销为主,生产实践中,普遍使用低温贮藏技术以保持其货架品质,延长保鲜期[1]。但长时间的低温环境下,猕猴桃果实易发生冷害,并表现出果皮凹陷、果肉组织水渍化、木质化等冷害症状,严重影响其商品价值[2]。针对这一问题,1-甲基环丙烯[3]、草酸[4]、水杨酸[5]、多胺[6]和24-表油菜素内酯[7]等化学处理已被用于提高低温贮藏猕猴桃果实抗冷性,并获得了较为理想的效果。
褪黑素(Melatonin,MT)是一种吲哚胺类植物激素,具有调节植物分化、生长、衰老以及应对生物、非生物胁迫等多种功能[8]。近年来,人们对MT 的认识不断深入,最近的研究发现其在园艺产品采后冷害的预防上也具有良好效应[9,10]。目前,关于MT 用于猕猴桃低温贮藏方面的报道较少,有研究认为0.1 mmol/L MT 处理通过促进抗氧化酶如超氧化物歧化酶、过氧化氢酶、抗坏血酸过氧化物酶和谷胱甘肽还原酶活性以及抗坏血酸和还原型谷胱甘肽含量,减少了活性氧自由基的积累,继而保持了“华优”猕猴桃果实的冷藏品质[11]。前人研究表明,碳水化合物在植物抵御低温胁迫过程中发挥着重要的调控作用。植物会动员储备淀粉,释放能量、可溶性糖及其衍生代谢物以对抗胁迫[12]。吴炼等[13]发现浸钙处理可有效减缓猕猴桃果实的淀粉降解,降低果糖和蔗糖积累,从而延长低温贮藏期。但在其他一些冷敏果实上,研究人员则认为较高水平的可溶性糖有利于提高果实抗冷性。如蔗糖有利于减缓桃和梨等果实冷害的发生[14-16],而果糖、山梨醇和葡萄糖则在杏果实抗低温胁迫中发挥了一定作用[17]。这些结果表明碳水化合物代谢与冷害的关系可能因果实种类的不同而不同。那么,MT处理减轻猕猴桃果实冷害与碳水化合物代谢关系如何呢?相关内容还鲜有较为系统的报道。本研究以“徐香”猕猴桃为试材,探究MT 处理对冷害、碳水化合物代谢的影响,以期为MT 在猕猴桃果实低温贮藏保鲜中的应用提供理论依据,同时为生产实践提供一定的技术支持。
1 材料与方法
1.1 材料与试剂
“徐香”猕猴桃(商业成熟度)采摘于陕西省西安市城郊一管理规范的果园,之后立即运回实验室,取果形端正、大小均匀、无微生物侵染和机械损伤的果实用于试验。
MT(纯度≥99.0%),合肥博美生物科技有限公司;乙腈(色谱纯),美国Tedia 公司;果糖、葡萄糖和蔗糖标准品,美国Sigma 公司;所用其他试剂均为国产分析纯。
1.2 仪器与设备
TGL-20bR 高速低温冷冻离心机,上海安亭科学仪器厂;UV-2600 紫外可见分光光度计,岛津公司;高效液相色谱仪(配备Shodex RI-201H 示差折光检测器),中国江苏汉邦科技有限公司;KQ-100DE 型数控超声波清洗器,昆山市超声仪器有限公司。
1.3 方法
1.3.1 材料处理
将猕猴桃果实随机分为两组,每组210 个果实。分别采用浓度为0(对照)和0.05 mmol/L 的MT 溶液浸泡10 min[18],果实晾干表面水分后装入聚乙烯薄膜袋,置于0~1 ℃的机械冷库贮藏90 d。期间每15 d 取样,并测定果实的硬度。取果肉样品在液氮中快速冷冻,之后立即于-80 ℃冰箱保存,用于后续指标的测定。同时,按上述处理另准备相同数量的猕猴桃用于确定冷害指数。为准确获得数据,需将果实从0~1 ℃移至常温下(20 ℃)贮藏3 d,以模拟货架期[2]。
1.3.2 冷害指数和硬度的测定
参考Yang 等[2]方法并略修改后测定。果实的冷害程度分为5 级,0 级:无冷害症状;1 级:冷害面积小于20%;2 级:冷害面积20%~40%;3 级:冷害面积40%~60%;4 级:冷害面积大于60%。冷害指数计算公式如下:
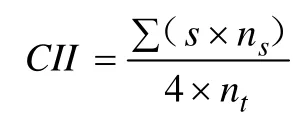
式中:
CII——冷害指数;
s——冷害级数;
ns——该等级果实个数;
nt——果实总个数。
采用GY-3 型果实硬度计测定赤道两侧去皮果肉硬度,探头直径为8 mm,结果表示为N。
1.3.3 丙二醛含量的测定
参考Gao 等[19]方法测定。称取果肉样品2 g,以6 mLw=10%三氯乙酸溶液(含w=0.5%硫代巴比妥酸)匀浆。混合物在沸水中煮沸10 min,流动水迅速冷却后,于5 000 r/min 离心15 min。取上清液,测定其在450、532、600 nm 处吸光度值。丙二醛(Malondialdehyde,MDA)含量以鲜重计,单位:µmol/g。
1.3.4 淀粉、可溶性糖含量测定
淀粉的提取和测定参考曹建康等[20]方法,采用碘-淀粉比色法测定。称取果肉样品2 g,依次以5 mL乙醚和80%乙醇匀浆,过滤,弃去滤液,重复上述步骤3 次。将滤渣完全转移至烧杯中,并于沸水浴中加热至淀粉完全糊化,冷却后用蒸馏水定容至25 mL,即为淀粉提取液。将2 mL 淀粉提取液与7.8 mL 蒸馏水混匀,再加入0.2 mL 5 g/L碘液,混匀并静置10 min。测定其在660 nm 处吸光度值。淀粉含量根据淀粉标准曲线计算,以鲜质量计,%。
果糖、葡萄糖和蔗糖的提取参考Zhou 等[21]方法。称取果肉样品2 g,以6 mL 乙腈-水溶液(V/V=4:6)匀浆,75 ℃热水浸提20 min,超声波提取30 min,4 ℃、12 000 r/min 离心15 min 后取上清液,经0.45 µm 微孔滤膜过滤后用于高效液相色谱分析。色谱条件:Athena NH2-RP 色谱柱(4.6×250 mm,5 µm),柱温35 ℃,检测器:示差折光检测器,流动相:乙腈-水溶液=78:22(V/V),流速:1 mL/min,进样体积:10 µL。果糖、葡萄糖和蔗糖含量分别根据其标准曲线计算,以鲜重计,单位:mg/g。
1.3.5 碳水化合物代谢相关酶活性测定
总淀粉酶活性参考曹建康等[20]方法测定。称取果肉样品3 g,以5 mL 蒸馏水匀浆,室温下放置提取20 min。4 ℃、8 000 r/min 离心20 min 后,收集上清液为淀粉酶粗提液。淀粉酶粗提液和10 g/L 淀粉溶液置于40 ℃水浴中预保温10 min 后,取1 mL 淀粉酶粗提液与1 mL 淀粉溶液混匀,于40 ℃水浴中准确保温反应5 min,再加入2 mL DNS 试剂,混匀并于沸水浴中煮沸5 min,流动水迅速冷却。以灭活的酶液为对照,测定其在540 nm 处的吸光度值。总淀粉酶活性以每分钟每克鲜重果肉样品中酶催化产生的麦芽糖含量表示,单位:mg/(g·min)。
蔗糖代谢相关酶的提取参考Deng 等[22]方法。蔗糖磷酸合成酶(Sucrose Phosphate Synthase,SPS)、蔗糖合酶(Sucrose Synthase,SS)、酸性转化酶(Acid Invertase,AI)和中性转化酶(Neutral Invertase,NI)活性参考Sun 等[23]方法测定。SPS 活性以每小时每克鲜重果肉样品中酶催化产生的蔗糖含量表示,将每小时催化反应体系生成1 mg 蔗糖所需的酶量定义为1个酶活性单位(U),单位:U/g。SS、AI 和NI 活性均以每小时每克鲜重果肉样品中酶催化产生的还原性糖含量表示,将每小时催化反应体系生成1 mg 还原性糖所需的酶量定义为1 个酶活性单位(U),单位:U/g。
己糖激酶(Hexokinase,HK)和果糖激酶(Fructokinase,FK)活性参考Cao 等[24]方法测定。均以每分钟每克鲜重果肉样品中酶催化反应体系在340 nm 处吸光度变化表示,将每分钟催化反应体系吸光度变化0.01所需的酶量定义为1个酶活性单位(U),单位:U/g。
1.4 数据处理
所有指标的测定均完全随机重复3 次,实验数据采用Excel 2019 软件进行统计,相关性系数采用SPSS 21.0 数据分析软件进行统计分析,Origin 8.5 软件进行差异显著性检验和作图,p<0.05 表示差异显著。
2 结果与讨论
2.1 MT 处理对猕猴桃果实冷害指数、硬度和MDA 含量的影响
如图1a 所示,对照果实在贮藏第45 d 时开始表现出冷害症状,冷害指数为0.02,之后,随贮藏时间延长,冷害指数不断增大。MT 处理将冷害症状的出现时间延迟了15 d,且显著抑制了贮藏60~90 d 果实冷害指数的升高(p<0.05)。贮藏结束时,MT 处理果实的冷害指数为0.19,较对照果实(0.36)低47.22%。表明0.05 mmol/L MT 处理有利于猕猴桃果实抗冷性的提高。这与胡苗等以0.1 mmol/L MT 处理“华优”猕猴桃得到的结论相似[11]。硬度是猕猴桃果实贮藏品质的重要评价指标之一。如图1b 所示,对照和MT处理果实的硬度均呈下降趋势变化,且均在贮藏30~60 d 损失较快,贮藏45~90 d 时差异显著(p<0.05)。贮藏第90 d 时,对照和MT 处理果实的硬度分别由采收当天的117.60 N 降至32.67 N 和41.16 N,下降了72.22%和65.00%。冷害的发生往往伴随着猕猴桃果实的软化[25]。对对照和MT 处理果实的硬度与冷害指数进行相关性分析发现,均呈极显著负相关关系(r=-0.898 和r=-0.925,p<0.01)(图1d)。由此可知,MT 处理可以通过延缓冷害的发生进而一定程度上保持了果实的硬度。细胞膜是果实冷害发生的原初部位。低温胁迫下,细胞膜相变导致脂质过氧化反应的发生,并引发细胞膜氧化损伤。MDA 是细胞膜脂质过氧化的终产物之一,是公认的细胞膜氧化损伤标识物[2]。如图1c 所示,对照和MT 处理果实的MDA含量均随贮藏时间的延长而呈上升趋势变化,但MT处理果实的MDA 含量在整个贮藏期内始终低于对照(p<0.05)。贮藏第90 d 时,MT 处理果实的MDA含量为9.40 µmol/g,而对照果实的MDA 含量为11.45 µmol/g,是MT 处理果实的1.22 倍。结果表明MT处理可以减轻低温对猕猴桃果实细胞膜的损伤,抑制MDA 的生成,促进细胞膜结构的完整与功能的稳定,进而提高了猕猴桃果实的抗冷性,延缓了冷害的发生。这与前人在桃、石榴、杏等果实上的研究结果一致[9,10]。
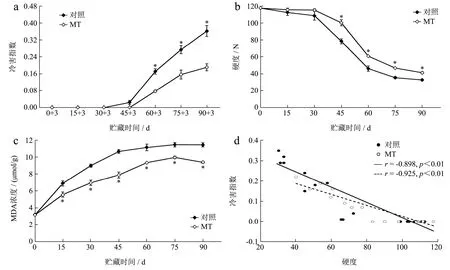
图1 MT 处理对猕猴桃果实冷害指数(a)、硬度(b)和MDA 含量(c)的影响及对照、MT 处理果实冷害指数与硬度(d)的相关性Fig.1 Effect of MT treatment on chilling injury index (a),firmness (b) and MDA content (c) in kiwifruit and correlations between chilling injury index and firmness (d) in control and MT-treated fruit
2.2 MT 处理对猕猴桃果实淀粉、果糖、葡萄糖和蔗糖含量的影响
淀粉具有维持果实细胞膨压,支持果实硬度的作用。淀粉还能降解为可溶性糖为果实提供呼吸底物,对果实的品质和保鲜期产生影响[26]。猕猴桃是典型的淀粉积累型果实,贮藏期间,保持果实中较高的淀粉含量是促进贮藏品质、延长贮藏期限的有效方法。如图2a 所示,对照和MT 处理果实的淀粉含量均随贮藏时间的延长逐渐降低,但MT 处理果实的淀粉降解较为缓慢,均与对照差异显著(p<0.05)。对照和MT处理果实在贮藏期内的淀粉含量损失分别为98.02%和84.89%,贮藏结束时,MT 处理果实的淀粉质量分数为1.07%。果糖、葡萄糖和蔗糖是猕猴桃果实中最主要的三种可溶性糖。如图2b、2c 所示,对照果实的果糖和葡萄糖含量在贮藏的0~45 d 几乎线性上升,第45 天时,两者的含量分别较采收当天升高了2.37 倍和2.68倍,随后上升变缓。MT 处理果实的果糖和葡萄糖含量在贮藏前30 d 亦表现为近乎线性上升,且与对照无明显差异(p>0.05),之后上升变缓,但始终低于对照,到贮藏结束,分别为21.57 和21.19 mg/g,分别较对照果实低10.09%和10.85%(p<0.05)。对照和MT 处理果实的蔗糖含量在贮藏期间均呈先上升后下降趋势变化,且在贮藏第45 天时达到最大值30.03 和26.85 mg/g,但MT 处理抑制了贮藏中后期果实中蔗糖的积累(p<0.05)(图2d)。以上结果表明,MT 处理在抑制猕猴桃果实淀粉降解,延缓果糖、葡萄糖和蔗糖累积方面发挥了正向的调控作用,促进了果实贮藏品质的保持。进一步分析发现,对照和MT 处理果实的淀粉含量与冷害指数均呈极显著负相关关系(r=-0.863 和r=-0.820,p<0.01)(图2e),与硬度间均呈极显著正相关关系(r=0.974 和r=0.941,p<0.01)(图2f)。由此可知,较高的淀粉含量有利于猕猴桃果实抵御低温胁迫,MT 处理对淀粉降解的抑制作用是其减轻猕猴桃果实冷害和硬度损失的重要原因之一。
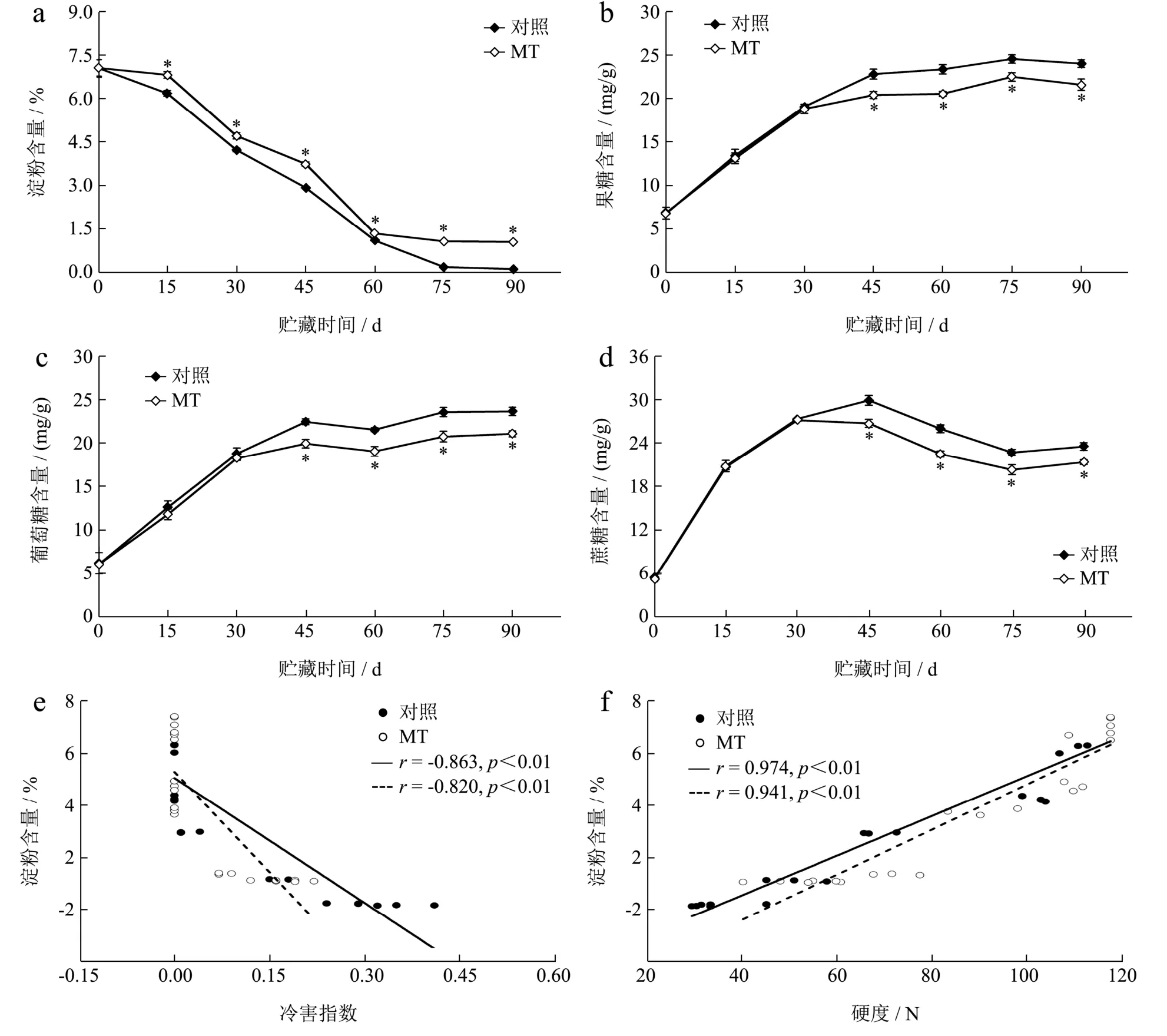
图2 MT 处理对猕猴桃果实淀粉(a)、果糖(b)、葡萄糖(c)和蔗糖(d)含量的影响及对照、MT 处理果实淀粉含量与冷害指数(e)和硬度(f)的相关性Fig.2 Effect of MT treatment on the contents of starch (a),fructose (b),glucose (c) and sucrose (d) in kiwifruit and correlations between starch content and chilling injury index (e) and firmness (f) in control and MT-treated fruit
2.3 MT 处理对猕猴桃果实总淀粉酶活性的影响
淀粉酶是引起果实中淀粉降解的起始酶,其活性升高可直接导致猕猴桃果实的快速软化[27]。如图3 所示,贮藏第45 d 时,对照和MT 处理果实的总淀粉酶活性均达到峰值,分别为7.40 mg/(g·min)和3.95 mg/(g·min),其中MT 处理果实的总淀粉酶活性仅为对照的53.38%(p<0.05)。贮藏结束时,MT 处理果实的淀粉酶活性为1.91 mg/(g·min),较对照低41.77%(p<0.05)。整个贮藏期内,MT 处理果实的总淀粉酶活性平均较对照低41.27%,表明MT 处理有效抑制了果实的总淀粉酶活性,并进一步延迟了淀粉向可溶性糖的转化,使MT 处理果实较对照保持了较高的淀粉含量。淀粉对细胞的支撑作用赋予了MT 处理果实较高的硬度,再结合其较低的冷害指数综合考虑认为,MT 处理介导的猕猴桃果实抗冷性提高与其对总淀粉酶活性的调控密切相关。因此,我们推测淀粉可能是猕猴桃果实冷害发生的一个重要生物标志物。
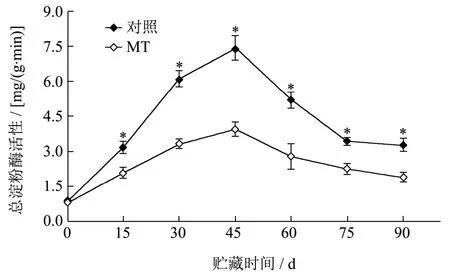
图3 MT 处理对猕猴桃果实总淀粉酶活性的影响Fig.3 Effect of MT treatment on the activity of total amylase in kiwifruit
2.4 MT 处理对猕猴桃果实SPS、SS、AI 和NI 活性的影响
SPS 是果实蔗糖代谢的一个限速关键酶,负责催化蔗糖的合成。如图4a 所示,对照果实的SPS 活性在贮藏的第60 天达到酶活峰值(10.02 U/g),随后下降。MT 处理果实的SPS 活性则仅在贮藏的前45 d 缓慢上升至峰值8.54 U/g,且除第15 天外,始终低于对照(p<0.05)。贮藏结束时,MT 处理果实的SPS 活性为7.51 U/g,较对照果实低9.52%。表明MT 处理从抑制酶活力和缩短酶活力持续时间两个方面发挥作用使猕猴桃果实的SPS 活性处于较低水平。对对照和MT 处理果实的SPS 活性与蔗糖含量进行相关性分析,结果表明均呈极显著正相关关系(r=0.911 和r=0.955,p<0.01)(图4e)。由此可知,SPS 活性与猕猴桃果实的蔗糖合成直接相关,MT 处理则通过抑制SPS 活性减缓了果实中蔗糖的累积。不同于SPS,SS、AI 和NI 是蔗糖代谢中负责将蔗糖催化裂解为果糖和葡萄糖的关键酶。如图4b 所示,对照和MT 处理果实的SS 活性变化与SPS 活性相似,贮藏30~90 d时,MT 处理对SS 活性呈现了抑制效应(p<0.05)。同时,MT处理也抑制了果实的AI和NI活性(p<0.05)(图4c、4d)。贮藏第90 d 时,MT 处理果实的SS、AI 和NI 活性仅为11.96、38.92 和54.96 U/g,分别较对照果实低9.12%、8.55%和9.74%。对对照和MT 处理果实的SS、AI 和NI 活性与蔗糖含量进行相关性分析,结果表明SS 和NI 活性均与蔗糖含量呈极显著正相关关系(r=0.863、r=0.727 和r=0.848、r=0.709,p<0.01)(图4f、4h),而AI 活性则与蔗糖含量的相关性较低(图4g)。由此可知,SS 和NI 主要参与了猕猴桃果实的蔗糖裂解过程,且与其活性与蔗糖裂解的速率密切相关,MT 处理则主要通过对SS 和NI 的共抑制,减缓了果实中蔗糖的累积。研究表明,高活性的蔗糖合成-裂解循环一定程度上可促进果实中淀粉向可溶性糖的转化[28]。因此,削弱蔗糖合成-裂解循环可能是MT 处理延缓淀粉降解的又一可能途径,是MT 处理减轻猕猴桃果实冷害的又一可能机制。
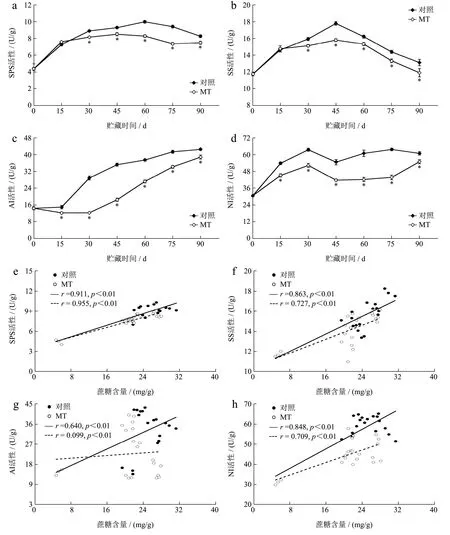
图4 MT 处理对猕猴桃果实SPS(a)、SS(b)、AI(c)和NI(d)活性的影响及对照、MT 处理果实SPS、SS、AI 和NI 活性分别与蔗糖含量(e~h)的相关性Fig.4 Effect of MT treatment on the activities of SPS (a),SS (b),AI (c) and NI (d) in kiwifruit and correlations between the activities of SPS,SS,AI and NI and sucrose content (e~h) in control and MT-treated fruit
2.5 MT 处理对猕猴桃果实HK 和FK 活性的影响
HK 和FK 是果实己糖代谢的关键酶,主要催化果糖和葡萄糖的磷酸化[29]。如图5 所示,对照和MT 处理果实的HK 和FK 活性均呈先升高后下降趋势变化,并在贮藏的第15 d 达到峰值。整个贮藏期内,MT 处理果实具有较高的HK 和FK 活性,MT 处理促进了0~15 d 果实HK 和FK 活性的升高,分别由采收当天的1.08 U/g 和0.90 U/g 升高至2.44 U/g 和1.65 U/g。同时,MT 处理也抑制了随后的活性下降,贮藏结束时,较对照果实高61.54%和67.50%(p<0.05)。结果表明MT 处理从促进酶活力和延长酶活力持续时间两个方面发挥作用使猕猴桃果实的HK和FK活性处于较高水平。HK 和FK 是糖酵解产生能量的重要影响因素[29],Zhao 等[30]在油桃果实上发现较高的HK 和FK活性有助于充足的能量供应和果实抗冷性的提高。据此,我们推测MT 处理可以通过促进能量供应减缓猕猴桃果实冷害的发生,但相关内容还待进一步验证。
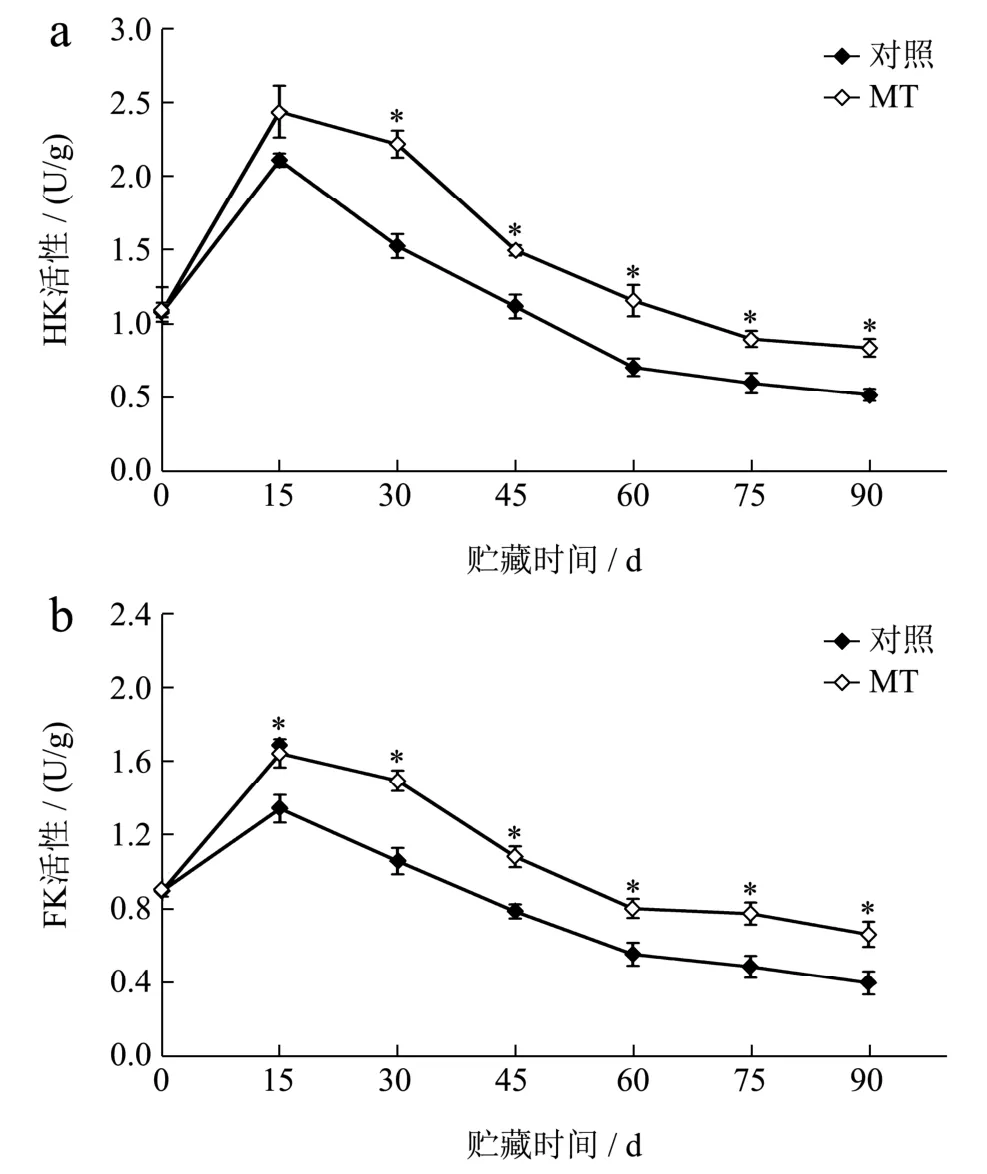
图5 MT 处理对猕猴桃果实HK(a)和FK(b)活性的影响Fig.5 Effect of MT treatment on the activities of HK (a) and FK(b) in kiwifruit
3 结论
0.05mmol/L MT 处理延缓了猕猴桃果实冷害的发生,具体表现为降低了果实的冷害指数、硬度损失和MDA 积累。淀粉可能是猕猴桃果实冷害发生的一个重要生物标志物,MT 处理对淀粉含量的影响可能与其对总淀粉酶活性和蔗糖合成-裂解循环的共调控直接相关。

