月桂酰精氨酸乙酯的抑菌活性
蒋思雨,郝刚,唐善虎,李思宁,孙栋,张林
(西南民族大学食品科学与技术学院,四川成都 610041)
月桂酰精氨酸乙酯(Lauroyl arginine ethyl ester,LAE)是一种阳离子表面活性剂,在前期的研究中发现它对G-、G+菌及霉菌有广谱的抑菌活性,在体内能被胃蛋白酶和胰蛋白酶水解,具有高度的安全性[1]。目前,LAE 被美国FDA 批准为一般公认安全(GRAS)食品添加剂,通过欧洲EFSA 的安全食品认证[2]。2020年国家药监局已批准LAE 作为化妆品防腐剂使用。2018 年我国食品安全风险评估中心发布了关于《食品添加剂月桂酰精氨酸乙酯盐酸盐》的征求意见,截止目前,GB 2760《食品添加剂使用标准》还未将LAE纳入其中。LAE 作为新型保鲜剂,具有较高的食品应用潜力,常与其他保鲜剂协同使用。彭美玲等[1]研究发现LAE 与壳聚糖以及乳酸链球菌素进行复配,可以有效抑制牦牛鲜肉肠中微生物生长;陈山乔等[3]发现LAE 与山梨酸钠复配可以有效抑制榨菜中的致腐菌。
目前,已有一些关于LAE 抑菌机理的研究报道。李阳等[4]发现LAE与尼泊金甲酯钠具有良好的协同抑菌效果;Rodríguez 等[5]研究了LAE 对鼠伤寒沙门氏菌和金黄色葡萄球菌细胞的影响,发现LAE 可以导致细胞膜发生损伤,但未能使细胞裂解。Xu 等[6]研究了LAE 对指状青霉菌和胡萝卜果胶杆菌的抗菌活性和作用机制,发现LAE 具有明显破坏真菌和细菌细胞结构的能力,能够影响细胞膜的通透性,干扰膜电位,抑制细菌的生长。Kim 等[7]研究了LAE 阻断铜绿假单胞菌生物膜形成的信号,发现LAE 可以有效阻断铜绿假单胞菌所需的铁信号,抑制G-菌细胞膜的形成。
月桂酰精氨酸乙酯(LAE)作为一种潜在的新型保鲜剂,很多研究表明其具有良好的抑菌性,但对LAE 抑菌机理全面、深入的研究相对较少。本研究选择大肠杆菌和英诺克李斯特菌作为G-、G+菌的代表菌,通过考察LAE 的抑菌活性、对细菌表面特性的影响、以及LAE 对脂质体包裹的荧光染料的泄漏与LAE对细菌内膜和外膜渗透性的影响,较全面地研究LAE以细菌细胞膜为主要作用靶点的抑菌作用机理,提出了LAE 渗透细胞膜的作用模式。
1 材料与方法
1.1 材料与试剂
大肠杆菌(Escherich coilATCC51459)、英诺克李斯特菌(Listeria innocuaATCC33090)为西南民族大学食品科学与技术实验室保存。
月桂酰精氨酸乙酯(BR),成都傲飞生物化学品责任有限公司;内毒素检测鲎试剂盒,厦门鲎试剂生物科技股份有限公司;大豆卵磷脂、甘油磷酸酯、邻硝基苯-β-D-吡喃半乳糖苷(ONPG)、利福平、十六烷、钙黄绿素、β-巯基乙醇,上海罗恩试剂公司;红霉素,上海阿拉丁生化科技股份有限公司;钾离子、钙离子检测试剂盒,南京建成生物工程研究所。
1.2 培养基与缓冲液
LB 培养基(g/L):5 g 酵母提取物、10 g 胰蛋白胨、10 g NaCl,pH 值调至7.0。
M9 培养基(g/100 mL):1.28 g Na2HPO4·7H2O、0.3 g KH2PO4、0.05 g NaCl、0.1 g NH4Cl、0.05 g MgSO4、0.001 g CaCl2、0.5 g 乳糖。注意:MgSO4单独灭菌后混匀,以避免产生沉淀。
PBS 缓冲溶液(g/L):7.9 g NaCl、0.2 g KCl、0.24 g KH2PO4、1.8 g K2HPO4,pH 值调至7.4。
β-半乳糖苷酶反应缓冲液(g/100 mL):0.8 g NaCl、0.02 g KCl、0.29 g Na2HPO4·12H2O、0.024 g KH2PO4、0.025 g MgSO4·7H2O、0.39 gβ-硫基乙醇。
1.3 仪器与设备
5804R 型台式冷冻离心机,德国Eppendorf 公司;318cf 型酶标仪,上海沛欧分析仪器有限公司;RE-52A型旋转蒸发器,上海亚荣生化仪器厂;MB99-2 型自动液相色谱分离层析仪,上海泸西分析仪器厂有限公司;SCIENTZ-IID 型超声波细胞粉碎机,宁波新芝生物科技股份有限公司;Zetasizer Nano ZS 型激光粒度仪,马尔文仪器有限公司;F-4700 型荧光/化学发光分析仪,日本株式会社日立高新技术科学那珂事业所。
1.4 实验方法
1.4.1 抑菌曲线的测定
参照杨昆等[8]的方法稍作修改。取200 μL LB 培养基培养至对数生长期的待测菌液置于96 孔细胞培养板中,加入5 μL LAE 溶液,终浓度为1 MIC、2 MIC,37 ℃摇床培养;对照组为无菌水。每隔半小时酶标仪λ=630 nm 测A 值,并以时间为横坐标,A 值为纵坐标绘制抑菌曲线。实验重复三次,取平均值。
1.4.2 LAE 结合脂多糖(LPS)中和内毒素的活性
参照内毒素检测鲎试剂盒说明书进行适当的修改。实验重复三次,取平均值。
1.4.3 LAE 对细菌表面电位的影响
参照郭彦君等[9]的方法稍作修改。在无菌超净台上,将培养至对数生长期的待测菌液离心,使用无菌超纯水洗涤2 次后重悬,取少量菌悬液至离心管中,加入LAE 溶液终浓度分别为1 MIC、2 MIC,阴性对照为无菌超纯水,充分振荡悬匀静置10 min,离心后弃上清液,使用1 mol/L KNO3溶液洗涤2 次,最后用KNO3溶液将其重悬至1×108CFU/mL,使用激光粒度仪测定细菌细胞表面电位。实验重复三次,取平均值。
1.4.4 LAE 对细菌表面疏水性的影响
参照李钰芳等[10]的方法稍作修改。将培养至对数生长期的待测菌液离心,用生理盐水洗涤2 次,并用1 mol/L KNO3将其重悬至1×108CFU/mL,每管加入LAE 溶液使其最终浓度为1/2 MIC、1 MIC、2 MIC,阴性对照为生理盐水。将其置于水浴锅37 ℃孵育15 min 后,在λ=630 nm 处测量(记为A0)。再取1.2 mL的菌液加入0.2 mL 十六烷,将其置于旋涡器剧烈振荡,常温静置25 min,待两相完全分离后,取下层水相溶液在λ=630 nm 处测量(记为A1)。实验重复三次,取平均值。计算公式如下:

式中:
X——细菌吸附率,%。
1.4.5 LAE 与脂质体的相互作用
(1)制备包裹钙黄绿素的脂质体
参照薄膜分散法[11]制作钙黄绿素脂质体,采用大豆卵磷脂和大豆心磷脂进行制备。先取0.4 g 磷脂(卵磷脂:心磷脂=4:1)于烧杯中,加入30 mL 氯仿溶解,加入10 mL 50 mmol/L 钙黄绿素/PBS 混合溶液,使其充分溶解,溶解过程要注意避光,直到无沉淀物质为止。置于超声波细胞粉碎机,在冰浴条件下300 W 间歇超声30 min,使其变为均一相;随后置于旋转蒸发仪中,温度<40 ℃减压蒸发除去氯仿,溶液呈胶状时,补加2~3 mL PBS 缓冲溶液洗脱。形成的脂质体在0.22 μm 的聚碳酸酯滤器进行过滤,弃去滤液,取未能过滤的溶液上葡聚糖凝胶G-25 柱(1.6×50 cm),使用PBS 溶液进行洗脱,根据峰值,收集脂质体,4 ℃进行保存。制备空白脂质体,则取相同的0.4 g 磷脂(卵磷脂:心磷脂=4:1)于烧杯中,加入30 mL 氯仿,加入10 mL PBS 缓冲溶液。混匀后进行超声波破碎,置于旋转蒸发仪进行蒸发。使用前可做适当的稀释。
(2)LAE 引起包裹钙黄绿素的脂质体的泄漏的影响
取1.5 mL 已包裹钙黄绿素的脂质体溶液于试管中,加入1.5 mL 不同浓度(8、16、32、64、128 μg/mL)的LAE 溶液,测其荧光强度为F;阳性对照为加入1.5 mL PBS 缓冲溶液,+30 μLφ=10% Triton X-100 溶液,测其荧光强度为Ft;阴性对照加入1.5 mL PBS缓冲溶液,测其荧光强度为F0。样品在室温下孵育5 min 后用荧光/化学发光分析仪进行检测,激发波长485 nm,发射波长535 nm,电压400 V,狭缝2.5 nm。实验重复三次,取平均值。钙黄绿素泄漏率计算公式如下:

式中:
L——泄漏率,%;
F——样品组的荧光强度;
F0——阴性对照组的荧光强度;
Ft——阳性对照组的荧光强度。
(3)LAE 对空白脂质体膜破裂实验的影响
取100 μL 空白脂质体于96 孔细胞培养板中,每孔再加入100 μL 不同浓度(8、16、32、64、128 μg/mL)的LAE 溶液;阳性对照为加入100 μL PBS 缓冲溶液+10 μLφ=10% Triton X-100 溶液;阴性对照为加入100 μL PBS 缓冲溶液。室温下孵育5 min 后,置于λ=595 nm 的酶标仪中测量A2值。实验重复三次,取平均值。
1.4.6 LAE 对G-菌外膜的渗透性的影响
参照郝刚等[12]的方法稍作修改。在无菌超净台中,将培养至对数生长期的大肠杆菌菌液离心、洗涤、重悬。取160 μL 大肠杆菌菌液于96 孔细胞培养板中,每孔中再加入20 μL LAE 溶液,使其终浓度为1/2 MIC,再分别加入20 μL 红霉素与利福平;阴性对照为加入20 μL 无菌超纯水+20 μL 红霉素与利福平。37 ℃培养10 h 后酶标仪λ=630 nm 处测A3值,根据吸光度的减少来检测LAE 是否可以增加G-菌外膜的渗透性。实验重复三次,取平均值。
1.4.7 LAE 对胞内K+、Ca2+的泄漏的影响
参照钾离子、钙离子检测试剂盒说明书进行适当的修改。实验重复三次,取平均值。
1.4.8 LAE 对细胞质膜的渗透性的影响
参照苏战强等[13]的方法稍作修改。在无菌超净台中,将LB 培养基培养至对数生长期的大肠杆菌菌液离心,无菌生理盐水(0.85wt%)洗涤,重悬。取2 mL菌悬液,加入10 mL 的M9 乳糖诱导培养基,37 ℃培养8 h 后进行离心洗涤,使用β-半乳糖苷酶反应缓冲液将其重悬至A4=0.2(λ=630 nm)。
(1)细胞质膜的渗透性检测
取800 μL 待测菌液于离心管里,加入100 μL LAE溶液(终浓度为MIC、2 MIC),再加入100 μL 1 mg/mL的邻硝基苯-β-D-吡喃半乳糖苷(ONPG)进行混匀,37 ℃培养,每隔0.5 h 测一次At值(λ=405 nm);阴性对照为加100 μLβ-半乳糖苷酶反应缓冲液+100 μL ONPG,测A5值。实验重复三次,取平均值。计算公式如下:

式中:
A——细胞质膜渗透性增加导致吸光度值的增加值;
At——每隔半小时的吸光度值;
A0——阴性对照组的吸光度值。
(2)β-半乳糖苷酶渗透至胞外的检测
取900 μL 菌液于离心管中,加入100 μL LAE 溶液(终浓度为MIC、2 MIC),混匀后,37 ℃孵育1 h。孵育结束后离心取上清900 μL,再加100 μL 的1 mg/mL ONPG 混匀后继续孵育4 h,测量A6值(λ=405 nm);阴性对照为取900 μL 菌液于离心管中,37 ℃培养1 h后置于超声波细胞粉碎机300 W间歇超声30 min,加入100 μL 的1 mg/mL ONPG 混匀后继续培养4 h,测A7值。实验重复三次,取平均值。计算公式如下:

式中:
H——β-半乳糖苷酶相对活性,%;
A6——样品组的吸光度值;
A7——阴性对照组的吸光度值。
1.5 数据处理
采用Microsoft excel 进行数据统计、Origin 2018 软件进行绘图、IBM SPSS Statistics 20 进行显著性分析。
2 结果与讨论
2.1 LAE 对大肠杆菌和英诺克李斯特菌的抑菌曲线
以大肠杆菌和英诺克李斯特菌作为G-、G+菌的代表菌,LAE 对细菌的抑杀作用可用菌液的吸光度值的变化来检测,通过抑菌曲线进一步比较LAE 对G-、G+菌的抑菌效果。大肠杆菌和英诺克李斯特菌最小抑菌浓度(MIC)均为8 μg/mL。如图1 显示,测试的大肠杆菌和李斯特菌在无LAE 处理时的生长状态都良好,LAE 1/2 MIC 时也无法抑制细菌的生长,当菌液加入LAE 1 MIC 后,两种菌的吸光度值都明显下降。LAE 对大肠杆菌的抑菌速度非常快,LAE 1 MIC处理30 min 后,大肠杆菌吸光度值由0.526 降低至0.135,随后趋于稳定,LAE 2 MIC 抑制效果明显优于LAE 1 MIC。LAE 对英诺克李斯特菌的抑菌速度相对缓慢,1 h 后李斯特菌数量减少一半左右,后逐渐趋于稳定。由此可见,LAE 对G-、G+菌均有明显的抑菌活性,但对G-菌的抑菌速度要高于G+菌,暗示LAE 对G-、G+菌的抑菌机理可能存在不同。
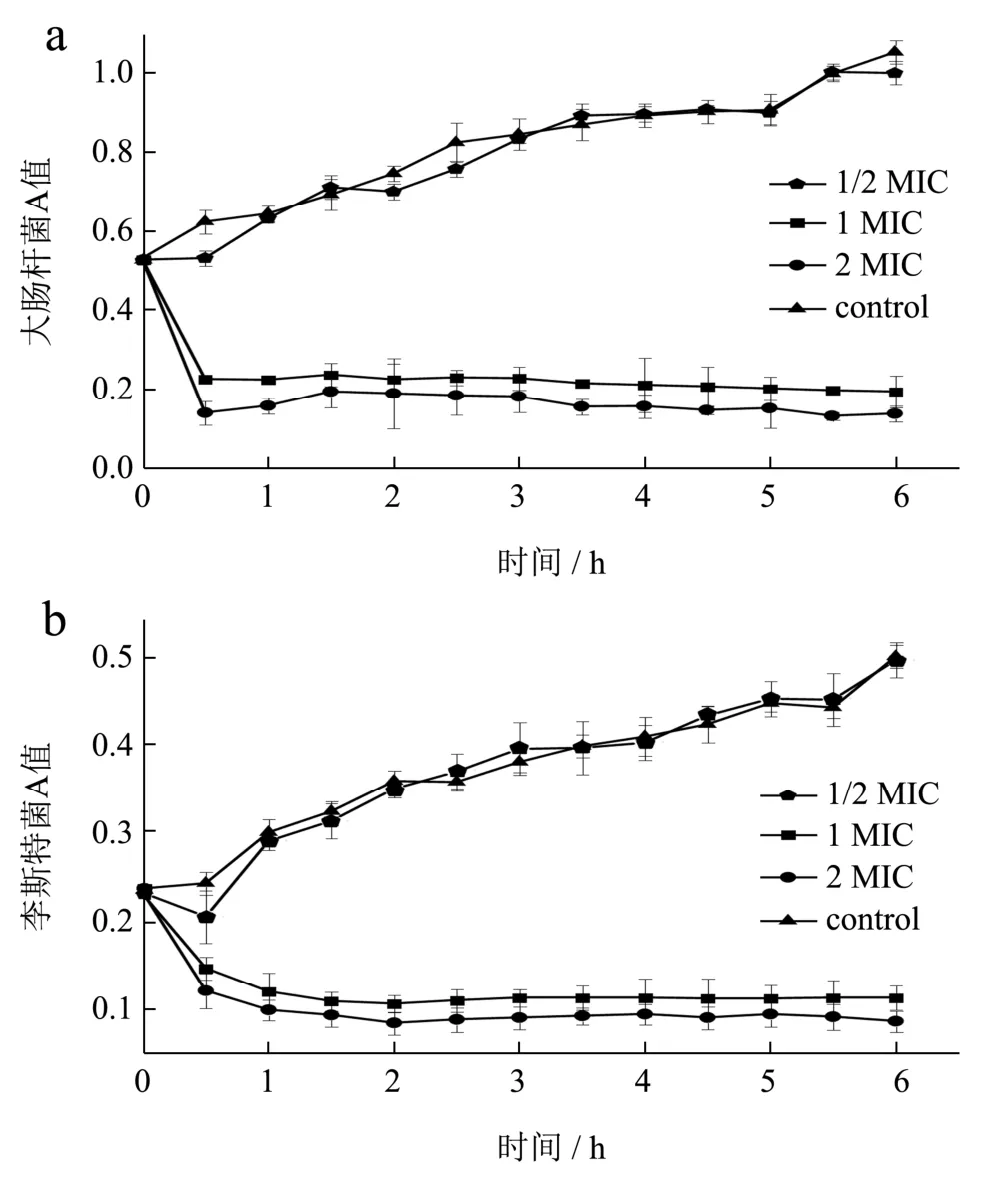
图1 LAE 对大肠杆菌(a)和李斯特菌(b)的时间-抑菌曲线Fig.1 Time-kill curves of LAE against E.coli (a) and Listeria (b)
2.2 LAE 结合细菌脂多糖(LPS)中和内毒素的活性
革兰氏阴性菌的外膜上存在一种电负性糖脂类物质-脂多糖(LPS),是内毒素主要成分之一。带正电荷的物质与脂多糖的结合可以用内毒素中和作用来检测,可根据LAE 中和内毒素的能力来判断LAE 结合LPS 的亲和力[14]。由图2 可以看出,LAE 在8 μg/mL的时候可以与脂多糖相互结合,中和率为26.72%,随着浓度的增加中和内毒素的能力也随之呈显著性增加并趋于稳定(p<0.05),最高可达到96.56%且保持在90.05%以上的结合能力,对内毒素的中和能力也被认为贡献了部分的抗菌活性[15]。阴离子的脂多糖是细胞外膜的外侧唯一的脂质种类,LAE 与LPS 之间极强的亲和能力说明阳离子LAE 与G-菌细胞最初的相互作用是经过与脂多糖的结合,LPS 可能是LAE 作用于G-菌外膜的一种重要的杀菌机制,同时也说明静电相互作用在杀菌过程中起着重要的作用[16]。
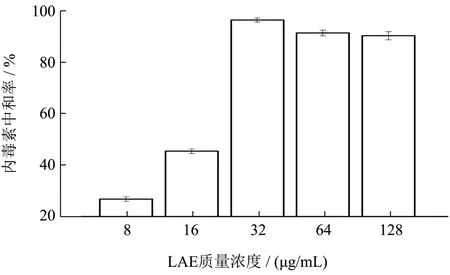
图2 LAE 与细菌脂多糖的结合性Fig.2 Binding of LAE to Bacterial Lipopolysaccharides
2.3 LAE 对细菌表面电位的影响
细菌的表面存在一些羧基或磷壁酸等阴性基团,使细菌表面携带负电荷,细菌表面电荷的大小影响到细菌表面粘附作用和聚集作用等特性[17]。LAE 与细菌细胞表面作用是LAE 与细菌接触的第一步。由表1可以看出经过LAE 处理过的2 种菌细胞表面Zeta 电位都发生变化,细菌表面电负性都呈显著降低的趋势(p<0.05),且随着LAE浓度的增加电负性降低越多。Wang 等[18]研究发现乳酸处理单核细胞增生李斯特菌可导致其Zeta 电位变为较小的负值,甚至转变为正值。与LAE 作用于细胞表面电位相似,LAE 可以干扰细菌表面电荷,使正电荷的LAE 与细菌表面多种阴性分子间发生静电作用,中和了一部分电荷[17,19]。
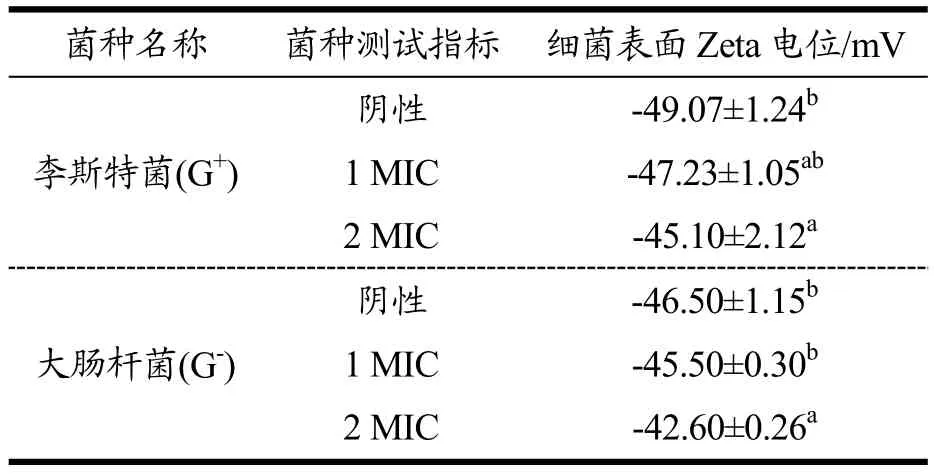
表1 LAE 对细菌细胞表面电位的影响Table 1 Effect of LAE on bacterial bell surface potential
2.4 LAE 对细菌表面疏水性的影响
十六烷是一种疏水性溶液,其对细菌的吸附率的改变可以体现细菌表面疏水性的变化[20]。由表2 可以看出,LAE 作用于李斯特菌和大肠杆菌后,随着LAE浓度的增加,十六烷对细菌的吸附率呈显著性增加(p<0.05),从李斯特菌组结果观察发现,经LAE 1/2 MIC处理后,细菌表面吸附率为1.60%,LAE 2 MIC 处理后增加为5.44%,表明LAE 对菌体细胞表面疏水性呈浓度依赖性;而大肠杆菌组结果观察发现十六烷对细菌的吸附率增加幅度更加明显,经LAE 1/2 MIC 处理后,细菌表面吸附率为2.57%,LAE 1 MIC 处理后吸附率为19.37%,随之增长为LAE 2 MIC 后,细菌表面吸附率增加为26.05%。这可能与LAE 的分子结构有关,LAE 分子是由月桂酸、L-精氨酸、乙醇组成,呈长链状,具两亲性,LAE 分子一侧是亲水性的精氨酸的侧链胍基带正电荷,另一侧是疏水性的月桂酸的十二烷脂肪链烃。推测LAE 分子接触细菌是先以胍基结合细菌表面带负电荷的基团,然后疏水的脂肪链烃尾部附着于细菌表面,使得细菌表面的疏水性提高[21]。由于G-菌细胞外膜有大量的带负电的脂多糖,能结合更多的LAE,这使得被LAE 吸附的大肠杆菌表面疏水性增加。这也能从侧面解释为什么LAE 对大肠杆菌的杀菌速度相比较李斯特菌更加迅速。
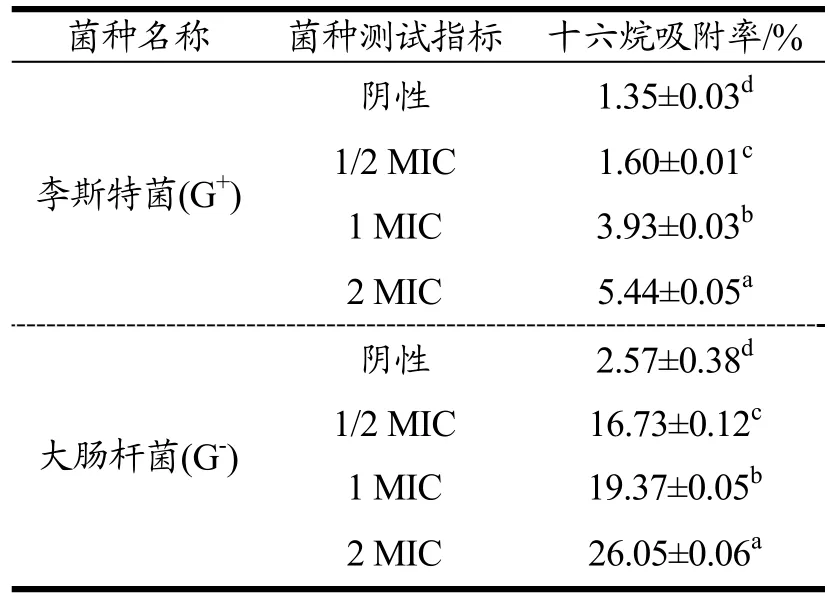
表2 LAE 对细菌细胞表面疏水性的影响Table 2 Effect of LAE on the hydrophobicity of bacterial cell surface
2.5 LAE 与脂质体的相互作用
2.5.1 LAE 引起包裹钙黄绿素脂质体泄漏的影响
为了研究LAE 与膜的相互作用,我们构建脂质体模型来模拟细胞质膜。磷脂成分的选择反应了细菌质膜的组成,我们选用中性的蛋黄卵磷脂(磷脂酰胆碱,EYPC)和带负电的蛋黄心磷脂(磷脂酰甘油,EYPG)按4:1(m:m)混合配制,使脂质体包裹着小分子水溶性钙黄绿素荧光指示剂[22,23]。通过LAE 作用于钙黄绿素脂质体引起荧光素的泄露来考察LAE 与膜的作用方式。由图3 看出,LAE 可以使脂质体中钙黄绿素发生泄漏,8 μg/mL 时就能引起接近70%的荧光素泄露,并与浓度呈正相关,当LAE 达到128 μg/mL 时,其所引起的钙黄绿素泄漏达到80%。李元生等[24]研究中抗菌肽Shepherin 能迅速作用于磷脂双分子层使其产生孔隙造成钙黄绿素的泄漏。Amanda 等[25]发现随着抗菌肽的浓度增加,钙黄绿素的泄漏率会随之增加。上述研究表明LAE 可能与某类抗菌肽抑制机制类似,可以扰动脂质体膜磷脂双分子层失去平衡。

图3 LAE 引起包裹钙黄绿素的脂质体的泄漏Fig.3 LAE causes leakage of liposomes encapsulating calcein
2.5.2 LAE 对空白脂质体膜破裂的影响
Triton X-100 溶液是一种乳化剂,可以溶解脂质,完全破坏细胞膜。考察了LAE 对空白脂质体膜的破裂作用,由图4 可知φ=0.5%的Triton X-100 溶液完全破坏了脂质体膜。而LAE 处理与阴性对照相比仅有略微下降。郝刚[12]发现抗菌肽BF2-A和BF2-X均不能引起脂质体的膜破裂,即LAE 与抗菌肽BF2-A 和BF2-X 对空白脂质体的影响相似。根据LAE 引起钙黄绿素脂质体泄漏的变化得出,LAE 可能并没有使脂质体膜完全崩塌[26,27]。
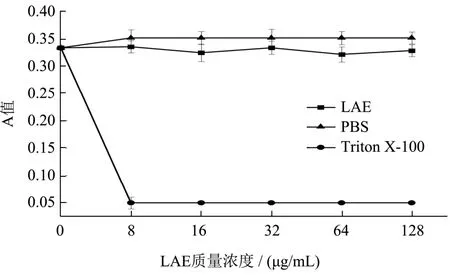
图4 LAE 对脂质体膜破裂Fig.4 Rupture of liposome membrane by LAE
2.6 LAE 对G-菌外膜的渗透性的影响
红霉素与利福平是疏水性的抗生素药物,这2 种抗生素不能进入细胞壁膜完整的革兰氏阴性菌外膜内,但可以穿过某些外膜缺陷突变株或外膜被螯合剂破坏的细胞外膜[28]。因此可以将这2 种抗生素作为抑菌剂诱导G-菌细胞外膜渗透性增加的探针。我们通过检测LAE 与红霉素和利福平的协同抗菌作用来考察LAE 渗透G-菌细胞外膜的能力[29]。由图5 可知LAE与红霉素或利福平协同作用于大肠杆菌的吸光度值明显低于红霉素或利福平单独作用于大肠杆菌的吸光度值。结果表明LAE 与这两种疏水性抗生素间具有明显的协同抑菌作用,抗生素浓度越大效果越明显。1/2 MIC的LAE 不足以抑制大肠杆菌的生长,但似乎扰乱了大肠杆菌细胞外膜结构,诱使其渗透性增加,使大肠杆菌对各种浓度的红霉素和利福平变得更加敏感。
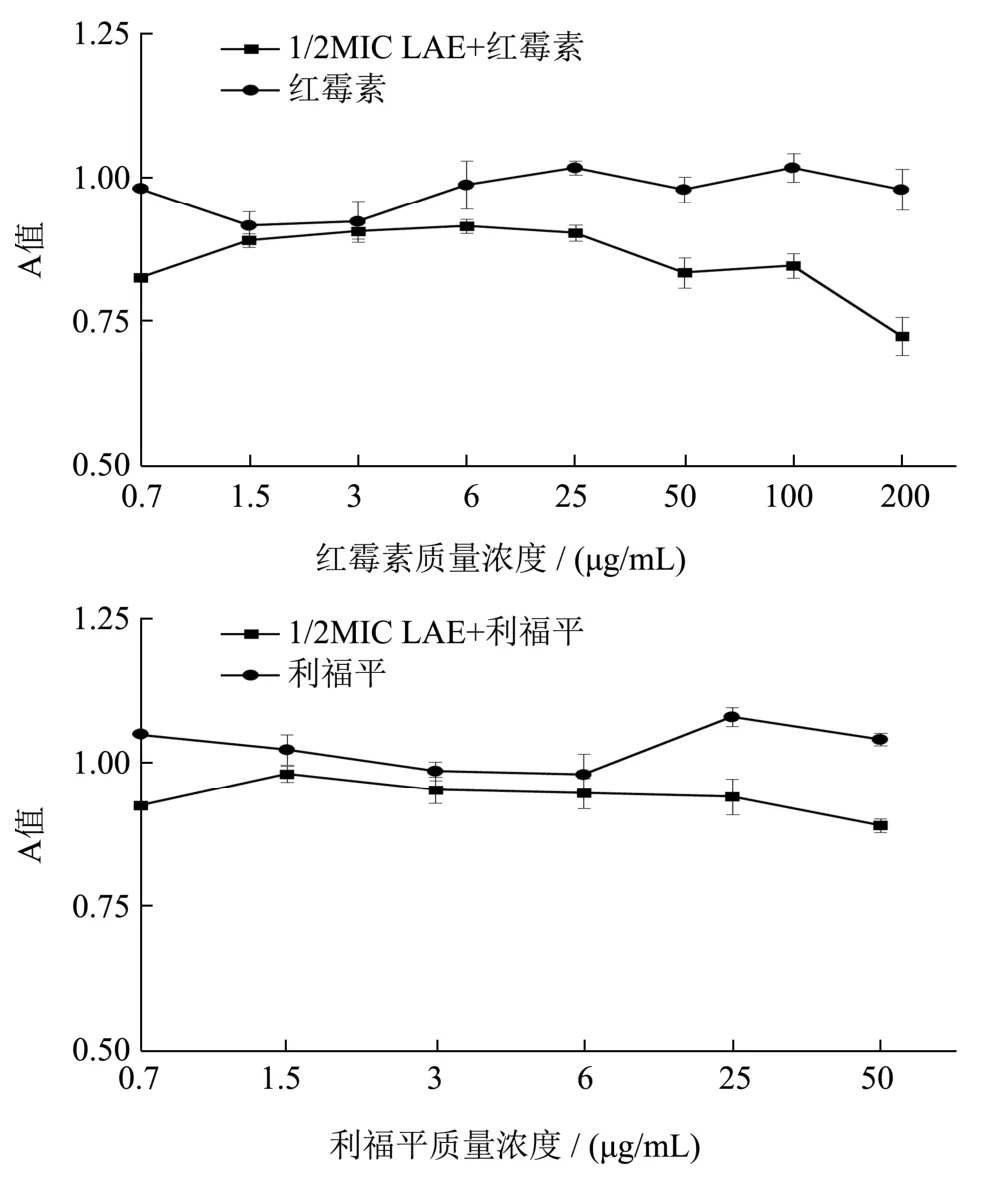
图5 LAE 对大肠杆菌菌外膜的渗透性检测Fig.5 Permeability test of LAE to the outer membrane of E.coli
2.7 胞内K+、Ca2+的泄漏
K+、Ca2+的泄漏情况可以反映细胞膜通透性的变化程度。由图6 可以看出,与对照组比较,发现浓度为1/2 MIC 的LAE 并不会导致K+、Ca2+的泄漏增加;当LAE 浓度升高,K+、Ca2+的泄漏率才随之呈显著性增加(p<0.05),LAE 处理后细胞释放的K+、Ca2+量的增加说明LAE 作用胞膜后确实增加了通透性,导致离子泄漏,并且在LAE 高浓度下(≥2 MIC),LAE对李斯特菌的K+、Ca2+离子泄漏率均高于大肠杆菌,这可能是LAE 对李斯特菌细胞质膜的扰动要更大一些。表明经LAE 处理后,菌体细胞膜上的离子通道可能发生损伤,引起离子的泄漏,而K+、Ca2+是维持细胞渗透压和膜电位的关键性离子,其泄露会导致细胞膜内外渗透压的失衡,从而导致细胞死亡[30,31]。此结果与ε-聚赖氨酸损伤大肠杆菌细胞,引起大肠杆菌胞内离子泄漏情况类似[32]。
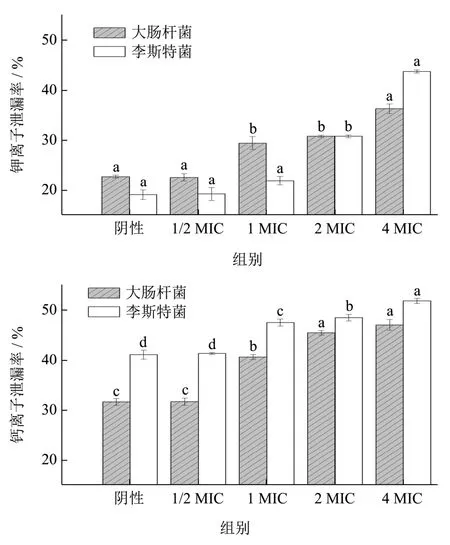
图6 LAE 对胞内K+、Ca2+的泄漏Fig.6 Leakage of intracellular K+ and Ca2+ by LAE
2.8 LAE 对细胞质膜的渗透性的影响
2.8.1 细胞质膜的渗透性检测
β-半乳糖苷酶是细菌中普遍存在的一种诱导酶,当培养基中有葡萄糖时不表达,葡萄糖耗尽而培养基里又有乳糖时,乳糖可诱导β-半乳糖苷酶产生,分泌于细菌细胞质内。邻硝基苯-β-D-吡喃半乳糖苷(ONPG)是β-半乳糖苷酶的底物,可被β-半乳糖苷酶水解为黄色的邻-硝基苯酚,可以用来检测β-半乳糖苷酶的活性。ONPG 进入胞质内还需要乳糖透性酶的运输,因此对于质膜完整的细胞来说其β-半乳糖苷酶的活性变化较慢。如果细菌细胞膜被破坏,其渗透性发生变化,ONPG 可以迅速进入细胞内,被β-半乳糖苷酶水解,吸光度值会增加,以此考察LAE 对大肠杆菌细胞质膜渗透性的影响[33]。如图7 所示,经处理30 min 后,吸光度值快速升高,2 MIC 的菌液中β-半乳糖苷酶的含量在30 min 内达到最大值。这说明ONPG 已迅速进入胞内并被水解,LAE 可以使大肠杆菌细胞质膜渗透性增加,浓度随之增加,对细胞膜的渗透性越强。这与LAE 对大肠杆菌抑菌曲线和脂质体荧光素泄露的研究结果一致[34]。

图7 细胞质膜的渗透性检测Fig.7 Permeability test of plasma membrane
2.8.2β-半乳糖苷酶渗透至胞外的检测
前面的研究已经发现LAE 可以扰乱细胞膜,使离子、ONPG、荧光素等小分子物质可以进出胞膜。β-半乳糖苷酶是大分子细菌内源性酶,存在于细胞膜内,而在胞外是无法检测到,当细菌细胞膜受到外界的严重破坏,会使β-半乳糖苷酶泄漏至胞外[35]。我们通过测量LAE 处理细菌后上清中β-半乳糖苷酶的相对活性,来判断β-半乳糖苷酶是否从细胞中泄漏,从而判断LAE对细胞质膜的破坏程度。由表3可以看出,经1 MIC、2 MIC 浓度的LAE 处理后,上清液中β-半乳糖苷酶的相对活性为56.26%、60.31%。这表明LAE 展现出一定程度的细胞质膜破坏能力,使膜产生较大孔洞,导致胞内大分子的酶蛋白物质的泄漏。

表3 β-半乳糖苷酶渗透至胞外的检测Table 3 Detection of β-galactosidase permeation into the extracellular space
3 结论
本实验选择大肠杆菌和英诺克李斯特菌作为G-、G+菌的代表菌,研究了LAE 以细菌细胞壁膜为主要作用靶点的抑菌机制。通过分析LAE 的抑菌特性,并结合LAE 的分子结构特征,推测LAE 与细菌壁膜的作用模式可能是以分子精氨酸侧链带正电的胍基以静电吸引与细菌表面带负电的基团相互作用,吸附在细菌表面,中和部分电荷,使膜电位降低;大肠杆菌的细胞壁带有更多的负电荷基团,吸附了更多的LAE,使得大肠杆菌表面的疏水性更大。吸附在细菌表面的LAE 用疏水性的脂肪链烃端插入磷脂双分子层膜,在扰动脂质体膜的过程中引起了包裹的荧光指示剂泄露;在扰动G-外膜时,使得疏水性探针红霉素和利福平能进入外膜;在扰动细胞质膜时,不仅能使小分子的K+、Ca2+从细胞中泄露,以及ONPG 渗入细胞内,还使得大分子酶蛋白也能从胞内渗出胞外。LAE 并不能使脂质体膜崩塌,但1MIC 的LAE 可以导致半数的β-半乳糖苷酶泄露,说明胞膜的破坏程度比较大。在后续的研究中我们会继续探索LAE 作用细菌的其他胞内物质靶点。

