复合乳杆菌对盐酸洛哌丁胺致慢传输型便秘小鼠的缓解作用
陈家伦,黄桂霞,甘聃
(仙乐健康科技股份有限公司,广东汕头 515041)
随着生活水平的提高,人们的饮食结构和生活方式发生很大变化,便秘的发病率也因此呈现逐年上升趋势,引起越来越多的关注[1]。慢传输型便秘(Slow transit constipation,STC)作为一种多因素特发疾病,发病机制较为复杂,严重便秘症状会引发皮肤痤疮、内分泌失调、腹胀甚至导致心肌梗塞和猝死。长时间服用溶剂性、刺激性泻药会带来严重副作用,导致肠道粘膜、肠神经和肠道菌群平衡遭受损害[2],引发后续性便秘。通过使用微生物制剂来改善肠道微生态,提升胃肠道功能,来达到缓解便秘的方法逐渐开始流行。在针对慢传输型便秘肠道转运时间缓慢的研究中,发现动物双歧杆菌DN173010(每天摄入3.7×1010CFU)[3]和干酪乳杆菌shirota(每天摄入6.5×109CFU)[4]均能够缩短肠转运时间。多菌株制剂在市场应用更多,人群适用性更广,常见多菌制剂的研究如二联菌(动物双歧杆菌BB-12+嗜酸乳杆菌La-5)[5]、三联菌(短双歧杆菌+嗜酸乳杆菌+两歧双歧杆菌)[6]均能改善便秘症状,而益生菌的功效与菌株特异性关联紧密,复合乳杆菌(鼠李糖乳杆菌LrGG-100+长双岐杆菌BL-11+嗜酸乳杆菌LA-99+干酪乳杆菌LC-88)中所有菌株均未曾报道过与缓解便秘功效相关的研究,因此本文中选用该复合菌研究缓解便秘方向功能具有一定创新性。
在研究中发现,STC 的发病机制与肠神经系统(Enteric Nervous System,ENS)的改变密切相关,位于肠道内壁的神经系统,独立于中枢神经系统,调节胃肠道的运动、分泌、新陈代谢等功能[7]。Cajal 间质细胞(Interstitial Cells of Cajal,ICC)作为胃肠道的起搏细胞,参与胃肠道的动力学变化[8,9],在STC 患者结肠发现ICC特异性酪氨酸蛋白激酶受体c-kit的显著降低[10],表明其在STC 发病机制中的重要性。水通道蛋白(Aquaporins,AQP)在人体水运输中发挥重要作用,AQP3 在结肠粘膜上皮表达,已经成为便秘治疗的一个新靶点[11]。越来越多研究表明益生菌定植于肠道,通过调节肠道免疫来稳定肠道内稳态[12-14]。
本研究通过使用盐酸洛哌丁胺造模便秘小鼠模型,探索复合乳杆菌对胃肠道功能的作用,同时通过检测胃肠调节肽、AQP3、c-kit、细胞因子等指标对复合乳杆菌的作用机制进行探索,为治疗STC 的产品开发应用提供支持。
1 材料与方法
1.1 材料与仪器
SPF 级BALB/c 雄性小鼠,6 周龄,购自北京维通利华公司,在江南大学实验动物中心饲养,许可证号:SYXK(苏)2021-0056,实验方案通过江南大学伦理委员会批准(JN.No20190930b0501220);复合乳杆菌(鼠李糖乳杆菌LrGG-100:长双岐杆菌BL-11:嗜酸乳杆菌LA-99:干酪乳杆菌LC-88=4:2:1:1),仙乐健康科技股份有限公司;易蒙停盐酸洛哌丁胺(每粒2 mg),西安杨森制药;活性炭及引物合成,生工生物;小鼠P 物质(Substance P,SP)、胃动素(Motilin,MTL)、胃泌素(Gastrin,Gas)、血管活性肠肽(Vasoactive Intestinal Peptide,VIP)、生长抑素(Somatostatin,SS)、内皮素(Endothelin 1,ET-1)、D-乳酸、紧密连接蛋白(Occludin)、肿瘤坏死因子-α(Tumor Necrosis Factor-α,TNF-α)、干 扰 素-γ(Interferonγ,IFN-γ)、白介素2(Interleukin 2,IL-2)、白介素4(Interleukin 4,IL-4)、白介素6(Interleukin 6,IL-6)、白介素10(interleukin 10,IL-10)、白介素12(Interluekin 12,IL-12)、白介素17(Interleukin,IL-17)和抗体(sIgA)酶联免疫试剂盒,南京森贝伽生物;阿拉伯树胶粉,国药试剂。
PB300-N 电子天平,梅特勒-托利多;Multiscan Go多功能酶标仪,赛默飞公司;CFX384 Real Time PCR System,伯乐生命医学产品公司。
1.2 实验方法
1.2.1 样品配制
使用生理盐水稀释动物歧岐杆菌BB-12成菌悬液2.5×109CFU/mL(阳性对照),稀释成复合乳杆菌重悬液2.5×109CFU/mL(低剂量)和2.5×1010CFU/mL(高剂量)。
墨汁配制:阿拉伯胶、水和活性炭按比例2:2:1混合煮沸,冷藏保存。
盐酸洛哌丁胺悬液:使用生理盐水重悬盐酸洛哌丁胺。
1.2.2 动物模型建立与分组
小鼠饲养在(23±2)℃,相对湿度50%±10%环境中,12 h 明暗交替节律,实验期间,饮水进食自由。
适应培养一周后,将小鼠随机分成5 组,每组10只:健康组、便秘组、阳性组、复合乳杆菌低剂量组、复合乳杆菌高剂量组。便秘组灌胃生理盐水,阳性、低、高剂量组灌胃菌悬液,持续7 d,第8 天开始根据小鼠体重按量灌胃盐酸洛哌丁胺悬液,灌胃剂量10 mg/kg 造模,以显著延长的首粒黑便排除时间为造模成功依据,造模后,阳性、低、高剂量组按0.2 mL BB-12、复合乳杆菌低、高剂量悬液进行灌胃,每天1次,持续7 d,健康组全程灌胃生理盐水。
1.2.3 小鼠首粒黑便时间、黑便粒数、黑便质量及小肠推进率的测定
灌胃至第21 天,健康组灌胃生理盐水0.2 mL、其余组均根据小鼠体重按量给予0.2 mL 生理盐水重悬的盐酸洛哌丁胺悬液(剂量10 mg/kg),1 h 后,开始灌胃墨汁,记录小鼠首粒黑便排出时间、6 h 内黑便排出粒数和黑便总质量。
禁食24 h,第22 天,给予健康组生理盐水0.2 mL灌胃,同时其余组根据小鼠体重按量给予0.2 mL 生理盐水重悬盐酸洛哌丁胺悬液(剂量10 mg/kg)灌胃,30 min 后,健康组和便秘组灌胃墨汁,其余组给与含对应内容物的等量墨汁。30 min 后,脱颈小鼠,取整个肠管,测小肠和墨汁推进长度,计算小肠推进率:
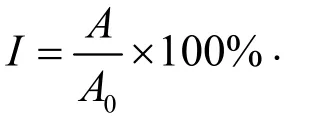
式中:
I——小肠推进率,%;
A——墨汁推进长度,cm;
A0——小肠总长度,cm。
1.2.4 细胞因子及胃肠调节肽检测
采血前禁食不禁水12 h,采用异氟烷对小鼠进行麻醉,眼眶取血,收集小鼠血液,3 000g离心15 min后收集上清,使用对应ELISA 试剂盒小鼠血清中细胞因子及胃肠调节肽(SP、MTL、Gas、VIP、SS、ET-1)含量,具体步骤参考试剂盒说明书。
1.2.5 小鼠结肠组织AQP3 和c-kit 基因表达水平检测
取结肠组织,Trizol 法提取总RNA,逆转录成cDNA,采用实时荧光定量聚合酶链反应(Quantitative real-time polymerase china extraction,qRT-PCR)来测定相关蛋白的表达量。由生工生物工程有限公司合成AQP3(AF104417)、c-kit(NM_021099)、actin(AY618199)引物序列,如表1 所示。以cDNA 为模板,反应体系10 μL,反应条件为:95 ℃预变性2 min,95 ℃变性30 s,59 ℃退火30 s,72 ℃延伸20 s,共38 个循环,以actin基因为内参,采用2-△△Ct 法分析数据,健康组的数值为1,结果由CFX96 Manager软件分析。
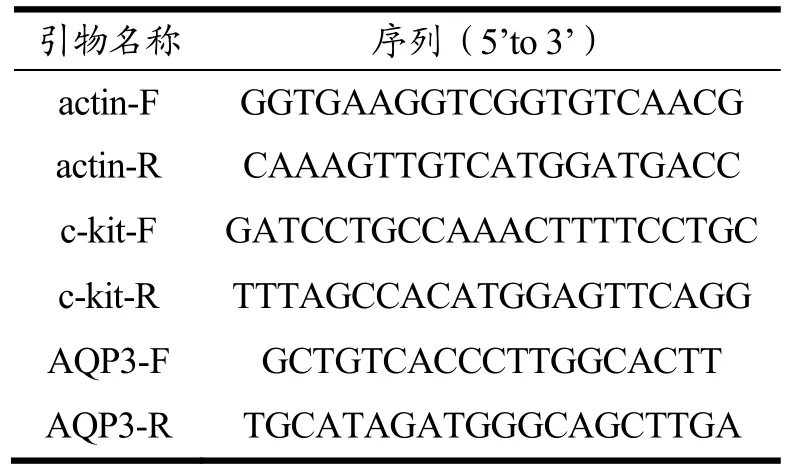
表1 引物序列Table 1 Primer sequences
1.3 统计分析
数据采用SPSS 21.0 进行显著性分析,GraphPad prism 8 作图,采用one-way ANOVA 多重比较组间差异,数据以平均数±标准差(mean±SD)表示。
2 结果与分析
2.1 复合乳杆菌对便秘小鼠肠道功能的影响
小肠运动形式主要有三种,紧张性收缩、分节运动和蠕动[15],蠕动的作用是推进肠内容物,通过洛哌丁胺抑制小肠蠕动,造模便秘小鼠。通过测定小肠推进率、首粒黑便时间、6 h 排便粒数和粪便质量,对小鼠胃肠道功能进行评价。
如图1 所示,便秘组在小肠推进率(图1a)、首粒黑便时间(图1b)、黑便粒数(图1c)和黑便质量(图1d)与健康组差异显著(p<0.05),表明洛哌丁胺造模便秘小鼠模型成功。与便秘组相比,复合乳杆菌能够显著改善便秘小鼠胃肠道功能(p<0.05),表现为复合乳杆菌低、高剂量组的小肠推进率显著提高61.45%(p<0.05)、1.22 倍(p<0.05),排便时间缩短21.42%(p<0.05)、29.14%(p<0.05),排便数量增加1.50 倍(p<0.05)、1.52 倍(p<0.05),排便质量增加1.13 倍(p<0.05)、1.25 倍(p<0.05),同时复合乳杆菌与阳性组效果无显著差异(p>0.05)。这表明复合乳杆菌具有促进小鼠胃肠道功能,缓解便秘的功效。王琳琳[16]研究了双歧杆菌对便秘小鼠的改善作用,结果和本研究一致。
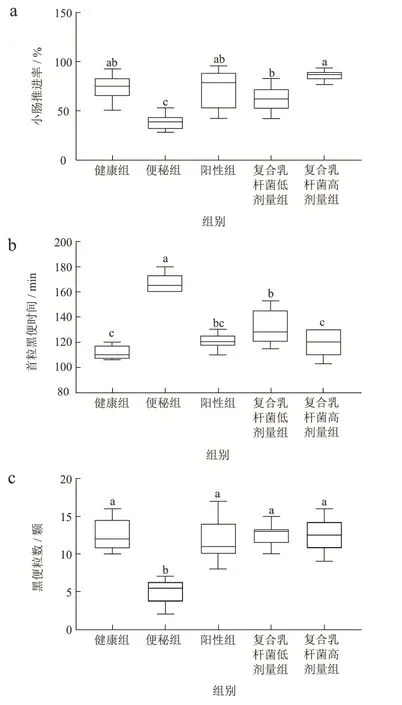

图1 复合乳杆菌对洛哌丁胺引起的便秘小鼠肠道排泄影响Fig.1 Effects of compound lactobacillus on excretion in loperamide induced constipation mouse model
2.2 复合乳杆菌对便秘小鼠血清细胞因子的影响
肠道疾病通常会引起肠道免疫应答,研究中发现,益生菌有调节免疫应答的功能,CD4+辅助T 细胞(Thelpercells,Th)可分为Th1、Th2、Th17 和Treg 细胞[17],Th1 分泌细胞因子IL-2(图2a)、TNF-α(图2g)和IFN-γ(图2h)介导巨噬细胞活化,参与细胞免疫功能;Th2 分泌IL-4(图2b)、IL-6(图2c)和IL-10(图2d)介导嗜酸性粒细胞活化,调节体液免疫应答,IL-12 和IL-4 分别参与诱导Th1 和Th2 的极化,Th1/Th2 的平衡对于维护机体稳态至关重要。Th17 分泌IL-17(图2f),Treg 分泌IL-10(图2d),炎症发生过程中,导致大量Treg 转化成Th17[18],而胃肠道是Th17 主要的控制部位[19],Th17/Treg 的平衡对于肠道稳态的维持很重要。如图2 中各细胞因子的分泌所示,便秘组相比健康组的各细胞因子出现下降,其中IL-6和IL-10 质量浓度显著下降(p<0.05),其余细胞因子分析无显著性(p>0.05),给予便秘小鼠复合乳杆菌后,会提高细胞因子分泌水平,各组间分析无差异(p>0.05)。这表明复合乳杆菌可能有调节细胞因子趋于稳定水平,维持Th1/Th2、Th17/Treg 平衡的能力。
紧密连接蛋白和D-乳酸在肠道屏障中起重要作用[20],sIgA 是肠道粘膜免疫的关键性指标[21]。便秘组相比健康组在紧密连接蛋白(图2j)和D-乳酸(图2k)质量浓度有所下降,差异不显著(p>0.05);sIgA 的含量(图2i)在各组中未发现明显改变(p>0.05),表明肠屏障未受到明显损伤。
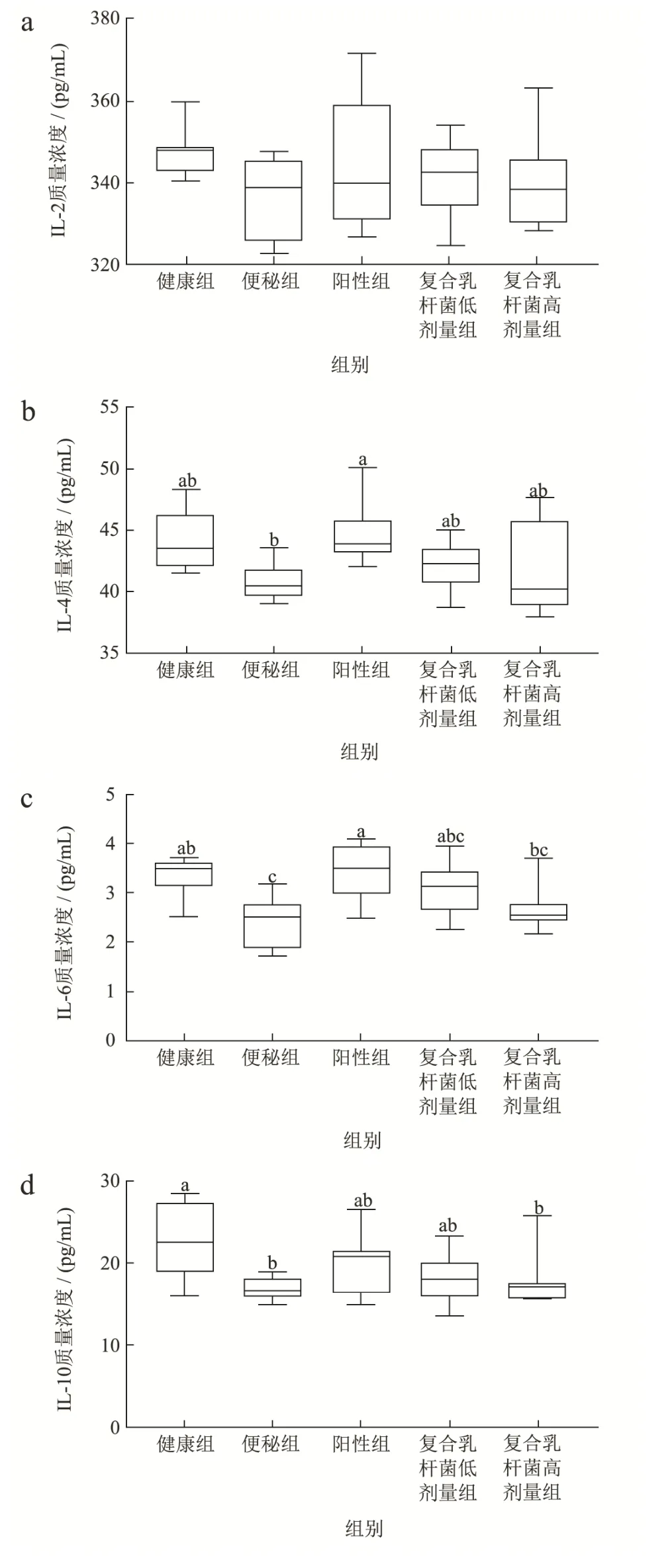


图2 复合乳杆菌对洛哌丁胺引起的便秘小鼠血清指标的影响Fig.2 Effects of compound lactobacillus on serum indicators in a loperamide induced constipation mouse model
肠道微生物群和免疫稳态之间关联密切,这是因为肠道微生物对免疫系统的发育、细胞因子和趋化因子的分泌至关重要,肠道微生物能够激活肠道粘膜免疫系统,促进淋巴细胞增殖分化,激活巨噬细胞和陷光细胞因子分泌,然而关于炎症调节细胞因子对于便秘的影响始终存在争论。Marjan 等[22]发现血清细胞因子水平与年龄相关性便秘之间存在显著关联,降低Th1/Th2 比率,提高促炎性细胞因子IL-6 和TNF-α质量浓度,而在Jin 等[23]的研究中发现,血清细胞因子IL-10/IL-12 和TNF-α并未发生显著变化。肠道稳态离不开肠道上皮、细胞因子和微生物菌群之间复杂的相互作用,从总体变化水平可以看出复合乳杆菌具有平衡细胞因子趋于健康组的作用。
2.3 复合乳杆菌对便秘小鼠结肠组织AQP3和c-kit 转录水平的影响
水通道蛋白AQP3 在水代谢和肠道通透性中起重要作用[24],ICC 能够促进肠道蠕动[25],c-kit 在ICC 发育过程中具有重要作用,研究中常用c-kit 表达水平反映ICC 细胞数量。如图3 所示,复合乳杆菌灌胃便秘小鼠后,能够显著促进AQP3 和c-kit 的转录(p<0.05),表现为高剂量组的AQP3 和c-kit 基因转录水平分别是便秘组的1.82 倍(p<0.05)和2.00 倍(p<0.05),且低、高剂量组、阳性组与健康组之间均无差异(p>0.05)。

图3 复合乳杆菌对AQP3 和c-kit 基因表达量的影响Fig.3 Effects of compound lactobacillus on expression of AQP3 and c-kit in mice colon
水通道蛋白的异常会影响结肠水代谢和肠道通透性,与STC 的发病紧密相关[26],本研究发现便秘组小鼠的AQP3 转录水平显著下降,给予复合乳杆菌后,AQP3 转录水平显著提高,小鼠排便质量上升(图1d),这表明服用复合乳杆菌后,能够改善水分重吸收,从而提高粪便含水量,改善便秘,结果和Yu 等[27]的研究一致。STC 患者的结肠ICC 数量明显低于正常[28],c-kit 作为其特异性指标能够一定程度上反应ICC 数量,复合乳杆菌能够提高c-kit 的转录水平,表明灌胃便秘小鼠复合乳杆菌后,小鼠肠道ICC数量得到提升,从而促进了肠道蠕动。
2.4 复合乳杆菌对便秘小鼠血清胃肠调节肽的影响
胃肠调节肽分为以SP、MTL 和Gas 为代表的兴奋性递质,以VIP、SS 和ET-1 为代表的抑制性递质[29],如图4 所示,洛哌丁胺造模便秘后,促进型递质SP(图4a)、MTL(图4b)和Gas(图4c)质量浓度显著下降(p<0.05),而给予复合乳杆菌高剂量治疗后,能够显著提高SP 和MTL 质量浓度(p<0.05),效果与阳性组一致,Gas 质量浓度治疗后略有提高,但不显著(p>0.05)。抑制型递质VIP(图4d)、SS(图4e)和ET-1(图4f)在便秘组中质量浓度最高,显著高于其余组别(p<0.05),在复合乳杆菌治疗后,VIP、SS 和ET-1 显著下降(p<0.05)。结果表明复合乳杆菌对小鼠慢传输型便秘可能通过提高SP 和MTL,抑制VIP、SS 和ET-1 来实现的。
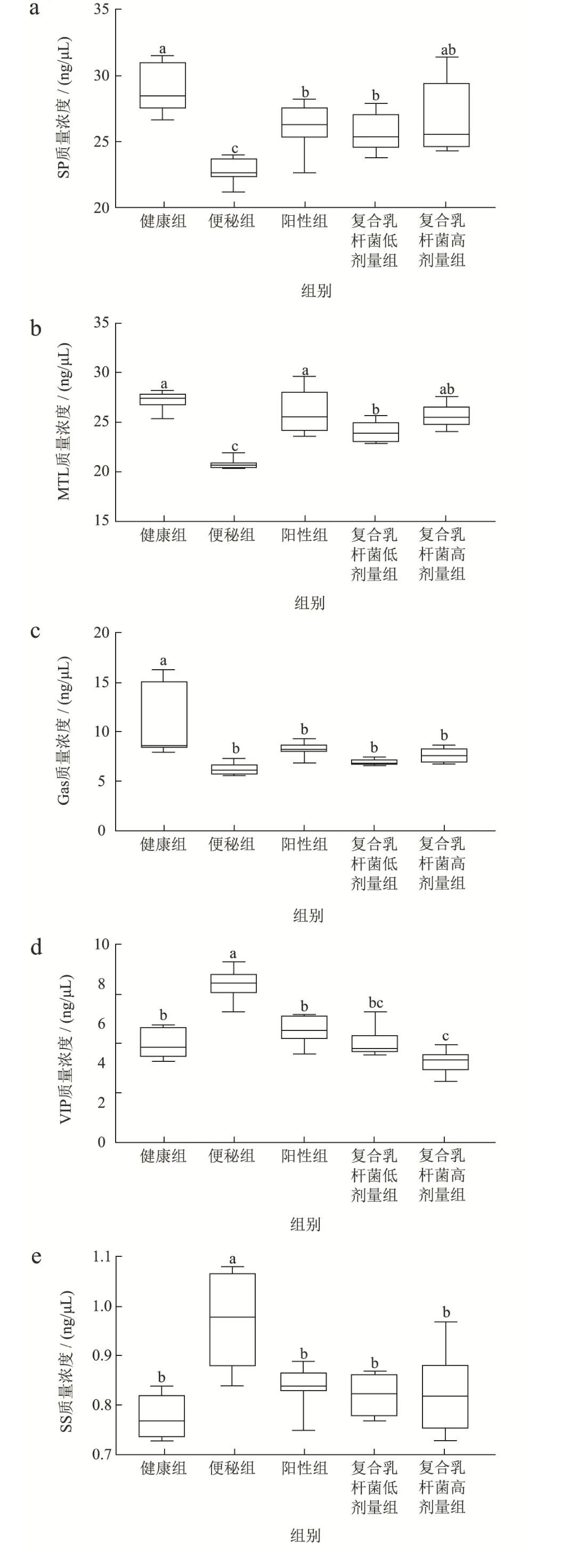
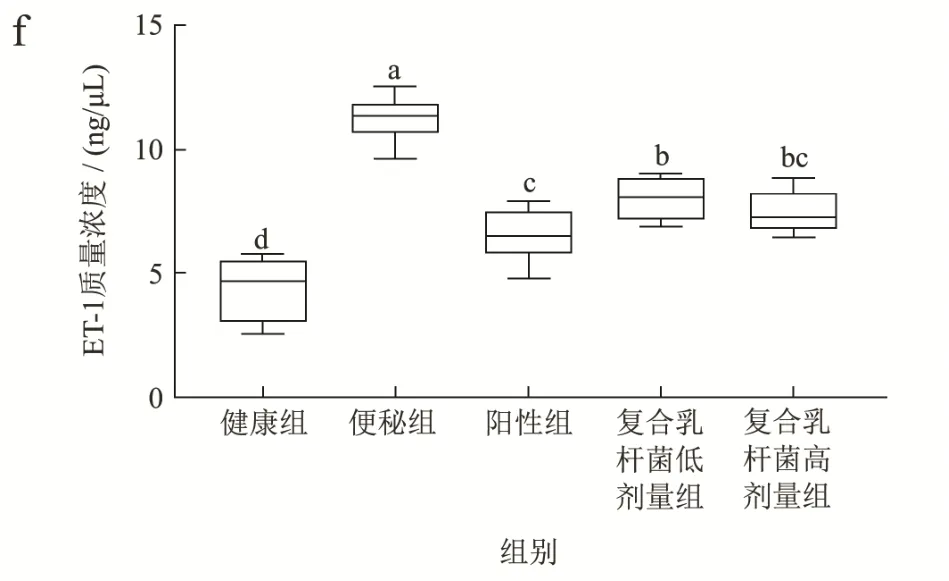
图4 复合乳杆菌对洛哌丁胺引起的便秘小鼠血清中胃肠调节肽的影响Fig.4 Effects of compound lactobacillus on gastrointestinal hormones in serum samples of loperamide induced constipation mouse model
ENS 中存在复杂的生化信号通路,胃肠调节肽作为生化信号传导的重要递质,参与通路的组成,承担着信号传递功能。研究表明,便秘患者的兴奋性递质表达减少,抑制性递质表达增加,导致肠道动态平衡被打破,肠道运动收到抑制[29-31]。MTL 促进胃肠道运动,Gas 与胃酸分泌,加速胃排空有关,SP 促进胃肠道平滑肌收缩,刺激结肠粘膜分泌水和电解质,促进肠道蠕动;而VIP 的功能是放松胃肠道括约肌,从而导致肠道转运速率减缓,ET-1 维持血管张力,调节肠道功能,SS 放松平滑肌,减缓胃排空速度。本研究发现便秘小鼠的兴奋性递质SP 和MTL 相比健康组显著下降,抑制性递质VIP、SS 和ET-1 显著上升,给予复合乳杆菌后,能够恢复平衡,从而改善便秘症状。
3 结论
本研究通过对小鼠胃肠道功能进行评价,发现复合乳杆菌能够显著促进肠道蠕动,提高推进率,改善排泄功能。通过初步探索复合乳杆菌改善便秘的机制发现,复合乳杆菌并未影响肠道免疫,而是可能通过调控水通道蛋白AQP3 和c-kit 的表达,来控制肠道水转运和肠道蠕动,同时调节胃肠调节肽来影响肠道神经系统。该研究为开发相关功能性食品奠定了理论基础。

