基于响应面法优化-UPLC-MS/MS测定西洋参中拟人参皂苷F11的方法研究
韩慧琴,姚宝林,张 淼,荆燕燕,尹贻珍*
(1张家口市食品药品检验中心中药室,张家口 075000;2承德市食品药品检验检测中心中药室;3石家庄市食品药品检验中心中药室;*通讯作者,E-mail:hnhiqg668899@Sohu.com)
西洋参为五加科人参属植物,原产于北美洲,以加拿大和美国为主产区,目前我国山东、东北等地区亦引种栽培多年[1]。作为贵细药材,西洋参有养阴润肺、清心安神之功效[2]。从西洋参中分离得到的化合物主要有人参皂苷类、萜类、多糖、黄酮类、维生素等[3-5]。现代药理学研究证实人参皂苷类为主要活性成分,有降血糖,保护心脏,增强记忆力、改善阿尔茨海默病及抗肿瘤等作用[6-9]。拟人参皂苷F11可作为西洋参的质量标记物[10],可用于西洋参质量的评价与控制。
皂苷类化合物的提取方法有:水煎法、有机溶剂回流法、微波辅助提取法和超声辅助提取法等[11-13],水煎法或有机溶剂回流法,能耗高、提取率低,且皂苷类成分有被破坏的可能;微波辅助提取效率虽高,但微波辐射不容忽视[14]。超声辅助提取具有效率高、用时短、温度低、适应性广、能耗低、提取药液杂质少,有效成分易于分离纯化等优点[15,16],目前被广泛应用于试验室和工业化生产中。
本试验以西洋参为研究对象,采用超高效液相色谱-串联质谱(aultra high performance liquid chromatography coupled with mass spectrometry,UPLC-MS/MS)法测定拟人参皂苷F11的含量,超声辅助提取法结合星点设计-效应面法优化西洋参中拟人参皂苷F11的提取率,以期达到高效提取拟人参皂苷F11的目的。
1 材料与仪器
BP211D电子天平(德国赛多利斯科学仪器有限公司),超高效液相色谱-API 5500三重四级杆质谱联用仪(美国AB公司);KQ-600DB超声波清洗仪(昆山市超声仪器有限公司),超纯水仪(成都浩康科技有限公司)。拟人参皂苷F11对照品(批号:110841-202108)、人参及西洋参对照药材(批号分别为120917-201712,120997-201810)均购自成都埃法生物科技有限公司;西洋参样品购自华佗药房连锁有限公司(批号为210506);乙醇、乙腈均为色谱纯(美国Thermo公司);超纯水。
2 方法与结果
2.1 拟人参皂苷F11的测定
2.1.1 色谱、质谱条件 色谱条件:Shim-pack GIST C18色谱柱(2.1 mm×100 mm,2 μm;P/N:227-30001-04;S/N:18I07025);流动相Ⅰ为乙腈,流动相Ⅱ为水,在不同的时间以不同的比例进行洗脱:0~2 min,80%→50%Ⅱ;2~4.5 min,50%→20%Ⅱ;柱温38 ℃,流速0.3 ml/min;进样量5 μl。
质谱条件:ESI离子源;负离子扫描;多反应监测(MRM)模式;定量离子799.500→653.500(碰撞能量CE:-45 V),定性离子799.500→491.600(CE:-50 V)。离子源温度500 ℃;离子喷雾电压-4 500 V;雾化气Gas1:50 psi、辅助气Gas2:45 psi。
2.1.2 溶液制备 对照品溶液:用精密电子天平称取拟人参皂苷F11对照品50.25 mg,用色谱纯乙醇100 ml溶解稀释成含有拟人参皂苷F11为502.5 μg的母液,精密吸取40 μl母液置于100 ml量瓶中,用20%乙腈稀释至刻度,作为贮备液(浓度:201 ng/ml)。
供试品溶液:市售西洋参粉碎过40目筛,精密称取1.0 g,置于具塞锥形瓶中,用大肚吸管精密量取25 ml体积分数为80%的乙醇,称定质量,置于超声波清洗仪中超声提取40 min,取出放至室温后,称重,补足缺失质量。提取液过滤,精密量取续滤液500 μl,置100 ml量瓶中,20%乙腈定容至刻度,即得供试品溶液。
西洋参对照溶液:精密称取粉碎过筛的西洋参对照药材1.001 6 g,按“供试品溶液”的制备方法,制备西洋参对照溶液。
人参对照溶液:精密称取粉碎过筛的人参对照药材粉末1.008 3 g,按“供试品溶液”的制备方法,制备人参对照溶液。
所有溶液注入液相色谱仪前需经0.22 μm有机滤膜过滤。
2.1.3 专属性试验 取“2.1.2”项下各溶液,照前述“2.1.1”项下方法进样,比较市售西洋参溶液、西洋参对照药材溶液及人参对照药材溶液中拟人参皂苷F11的情况。试验结果表明拟人参皂苷F11对照品溶液峰形良好,市售西洋参溶液和西洋参对照药材溶液的拟人参皂苷F11峰形对称,灵敏度较高,而人参中未检出拟人参皂苷F11(见图1),选择拟人参皂苷F11作为西洋参的质量标记物合理可行。
2.1.4 标准曲线 将“2.1.2”项下的对照品贮备液逐级稀释成浓度分别为5.025,10.05,20.10,50.25,100.5 ng/ml的系列对照品溶液,设置自动进样体积为5 μl,按“2.1.1”项下方法进样。以人参皂苷F11的浓度为横坐标(x),以峰面积为纵坐标(y)得回归方程为y=323.711 7x-717.164 5(r=0.999 2),线性范围为5.025~100.5 ng/ml,能够满足拟人参皂苷F11的测定。
2.1.5 准确性试验 分别精密称取已知含量为2.679 mg/g粉碎过筛的西洋参样品(批号:210506)9份,每份约1.0 g,精密称定,每3份为一组,分别按样品中含量的50%,100%,150%的量加入拟人参皂苷F11对照品母液3 ml,5 ml和8 ml,照“2.1.2”项下供试品溶液的制备方法制备供试品溶液,按“2.1.1”项下方法检测,结果平均回收率为98.2%,RSD值为0.9%(见表1)。表明该提取方法可行。
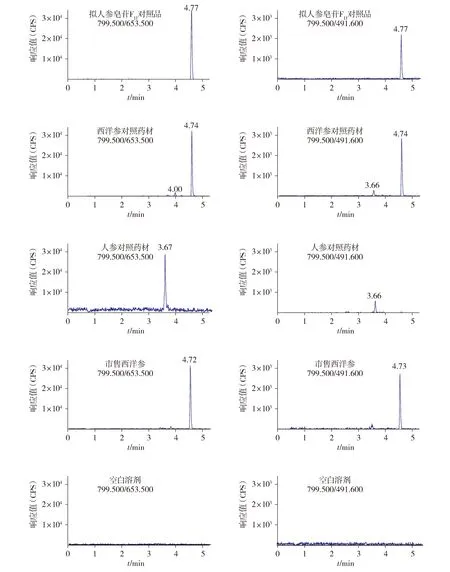
左边图为定量离子对(799.500/653.500)质谱图;右边图为定性离子对(799.500/491.600)质谱图图1 UPLC-MS/MS二级离子流图Figure 1 UPLC-MS/MS Secondary ion flow diagram

表1 拟人参皂苷F11的回收率试验结果 (n=9)
2.1.6 稳定性试验 取同一批西洋参(批号:210506),照“2.1.2”项下供试品溶液的制备方法,制备西洋参供试品溶液,室温放置,分别于0,1,2,4,8,12,16,18,24 h,按“2.1.1”项下方法检测。结果所得质量标记物拟人参皂苷F11含量的RSD为0.49%,表明制备好的供试品溶液在24 h内稳定。
2.1.7 精密度试验 取同一对照品溶液,按“2.1.1”项下的方法连续进样测定6次,测得拟人参皂苷F11峰面积RSD为0.41%,表明仪器精密度良好。
2.2 单因素试验
2.2.1 超声功率的考察 精密称取1.0 g市售西洋参粉末(粉碎过40目筛)5份,分别置具塞锥形瓶中,分别精密加入25 ml体积分数为80%的乙醇,密塞,称定质量,设定超声功率分别为240,300,360,420,480 W,超声提取40 min后冷却至室温,称定质量,补足缺失质量。提取液用20%乙腈溶液稀释200倍后用0.22 μm滤膜过滤,注入超高效液相质谱仪测定,结果显示拟人参皂苷F11的提取率随超声功率的增大而增加,但超声功率超过360 W时,提取率反而略有下降(见图2),原因可能为超声功率过大时对苷类结构有所破坏,故超声功率选择360 W。

图2 超声功率对拟人参皂苷F11提取率的影响Figure 2 Effect of the ultrasonic power on the yield of pseudo-ginsenoside F11
2.2.2 超声时间的考察 精密称取1.0 g市售西洋参粉末(粉碎过40目筛)5份,分别置具塞锥形瓶中,分别精密加入25 ml体积分数为80%的乙醇,密塞,称定质量,超声功率设定为360 W,分别提取20,30,40,50,60 min后放至室温,其余操作同“2.2.1”,结果显示拟人参皂苷F11的提取率随超声时间的延长而增加,但超声时间超过40 min时,提取率不再随之增加,反而略有下降(见图3),故超声时间选择40 min。
2.2.3 乙醇体积分数的考察 精密称取1.0 g市售西洋参粉末(粉碎过40目筛)5份,分别置具塞锥形瓶中,分别精密加入25 ml体积分数分别为60%,70%,80%,90%的乙醇及无水乙醇,密塞,称定质量。超声功率设定为360 W,超声提取40 min后放至室温,其余操作同“2.2.1”,结果显示拟人参皂苷F11的提取率随乙醇体积分数的增大而增加,当乙醇体积分数为80%时达到最大值,随后提取率下降(见图4),分析其原因为拟人参皂苷F11极性较大,在80%乙醇中溶解度较大,故提取溶剂采用80%乙醇。
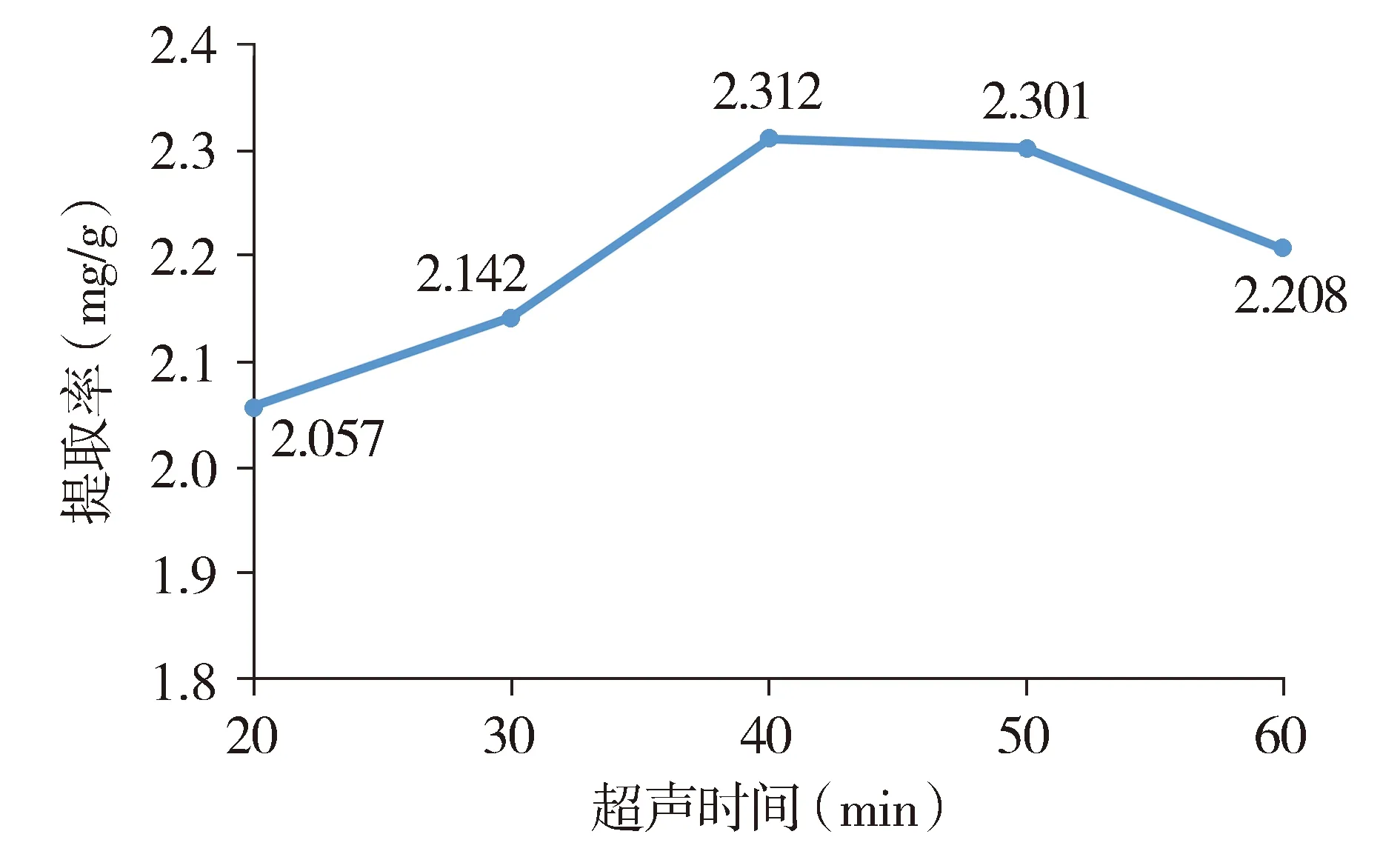
图3 超声时间对拟人参皂苷F11提取率的影响Figure 3 Effect of the ultrasonic time on the yield of pseudo-ginsenoside F11
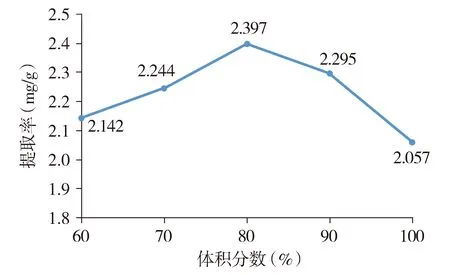
图4 乙醇体积分数对拟人参皂苷F11提取率的影响Figure 4 Effect of the ethanol concentration on the yield of pseudo-ginsenoside F11
2.2.4 液料比的选择 精密称取1.0 g市售西洋参粉末(粉碎过40目筛)5份,分别置具塞锥形瓶中,分别加入体积分数为80%的乙醇15,20,25,30,35 ml,即液料比分别为15 ml ∶1 g,20 ml ∶1 g,25 ml ∶1 g,30 ml ∶1 g和35 ml ∶1 g,密塞,称定质量。超声功率设定为360 W,超声时间为40 min,其余操作同“2.2.1”,结果发现拟人参皂苷F11的含量随液料比的增大而升高,但液料比大于25 ml ∶1 g时,含量不再随之增加(见图5),故选择25 ml ∶1 g的液料比进行优化试验。

图5 液料比对拟人参皂苷F11提取率的影响Figure 5 Effect of the ratio of liquid to solid on the yield of pseudo-ginsenoside F11
2.3 星点设计-响应面法优化提取工艺
根据单因素试验结果,选择超声功率(A)、提取时间(B)、乙醇体积分数(C)和液料比(D)为影响因素,每个因素设置3个水平(见表2),以拟人参皂苷F11提取率为评价指标,采用Design Expert 8.0.5设计Box-Behnken试验(见表3),应用Design Expert软件对表3数据进行拟合,求得回归方程,采用方差分析对回归模型进行显著性检验,通过软件分析并由二项式方程模型进行预测分析,确定最佳提取工艺。
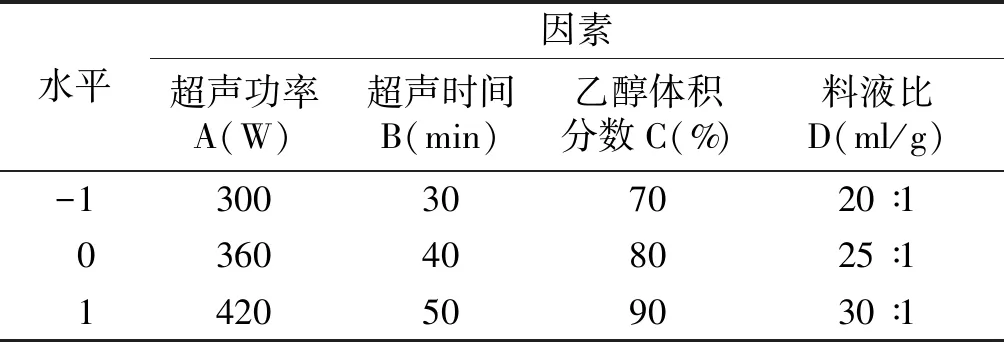
表2 因素水平表

表3 Box-Behnken试验方案及提取率
应用Design Expert软件对表3数据进行拟合,得回归方程为:Y=-77.439 37+0.070 38A+1.582 85B+0.678 00C+0.914 85D+0.000 19AB+0.000 11AC+0.000 05AD-0.004 39BC-0.000 59BD-0.000 07CD-0.000 12A2-0.018 39B2-0.003 47C2-0.016 99D2,由方程可知,因素A(超声功率)、B(超声时间)、C(乙醇体积分数)和D(液料比)对提取率均为正相关作用。采用方差分析对回归模型进行显著性检验,结果见表4,二项式拟合模型R2=0.977 2,P<0.000 1,表明用二次回归方程拟合模型合适;失拟项P>0.05,失拟不显著,表明回归方程可准确预测实际情况。因素A、C和D的影响显著(P<0.05);因素B的影响不显著(P>0.05);交互项中,BC影响显著(P<0.05),而其他影响不显著(均P>0.05);A2、B2、C2、D2均显著(均P<0.05)。

表4 回归模拟方差分析表
通过软件分析并由二项式方程模型进行预测分析,确定最佳提取工艺:超声功率为367.06 W,超声时间为34.82 min,乙醇体积分数81.11%,液料比26.69 ml ∶1 g,提取率为2.740 mg/g。考虑到实际操作情况,将其修正为超声功率370 W,超声时间35 min,乙醇体积分数81%,液料比27 ml ∶1 g。
2.4 验证试验
为验证响应面优化结果的可靠性,按上述最优条件进行3次验证试验,结果拟人参皂苷F11提取率为(2.679±0.016)mg/g,与预测值接近,表明本模型可较好地预测实际提取率。
3 讨论
目前关于西洋参提取的研究主要集中在总皂苷、总多糖及多种人参皂苷方面,这些研究为西洋参的深入开发提供了科学依据,但由于生物合成途径相近,导致人参、三七、西洋参所含化学成分相似,人参皂苷类为其共有成分[10],以总皂苷或人参皂苷为指标,不能真实反映西洋参质量。本试验以西洋参特有成分拟人参皂苷F11作为质量标志物,具有代表性,亦可作为药材判别依据。三萜皂苷类成分紫外吸收弱,液相测定时多采用蒸发光散射检测器[17-19],该测定方法灵敏度较低,测定效果欠佳;另外西洋参属于贵细药材,在中药成方中用量较少,常规检测手段难以有效控制药物质量,故亟待建立灵敏度更高的检测方法,UPLC-MS/MS具有检测限更低、分析时间快、自动化程度高的优点,可以排除干扰,提升质量控制水平。
皂苷类化合物属于四环三萜类,其母核上有羟基、甲基等不同的取代基,在前期摸条件时选用ESI+与ESI-分别进行扫描,结果ESI+同时出现了[M+H]+和[M+Na]+峰,导致二级质谱分析时母离子的浓度降低,灵敏度较差。试验过程中发现,形成的[M+Na]+峰信号不稳定,[M+H]+峰信号较弱,无法用于样品的检测。改用负离子检测模式后,可以形成[M-H]-峰且信号响应稳定,因此选用ESI-作为离子化模式。对母离子[M-H]-准分子离子峰进行碰撞诱导解离,以获得2次碎裂产生的子离子,分别选择离子丰度高、基线噪声低的离子对作为定性离子对,选择离子丰度最高的离子对作为定量离子对。
试验过程中,笔者发现拟人参皂苷F11的母离子响应值较低,因此不仅按常规的思路优化去簇电压和碰撞能量,对其他参数包括离子源温度、电压、雾化器、辅助气、碰撞气、碰撞室出口电压等都进行了优化,使得响应值达到最高。采用了API2000和API5500两种型号的质谱仪进行测定,结果API5500的检测灵敏度远远高于API2000,故选用API5500进行测定。
本试验采用超声辅助提取的方法,通过Box-Behnken试验设计优化了西洋参中拟人参皂苷F11的提取工艺,并采用专属性强灵敏度高的UPLC-MS/MS法进行检测,可为西洋参的真伪优劣鉴别提供更加可靠的依据。

