基于RhoA/ROCK/NF-κB信号通路探究益肾活血化痰方对动脉粥样硬化小鼠炎症反应的影响
陈小英,姚明龙,林燕云,郑关毅
(福建医科大学附属协和医院中医科,福州 350001;*通讯作者,E-mail:xycpt21@sina.com)
动脉粥样硬化(atherosclerosis,AS)是一种慢性炎症疾病,可引起血管内皮障碍、血脂代谢紊乱、炎症因子激活等,是心脑血管疾病的病理基础,可导致心肌梗死、冠心病等疾病的发生,因此防治AS显得尤为重要[1,2]。RhoA/ROCK信号通路与AS的形成密切相关,研究显示,抑制RhoA/ROCK信号通路可抑制血管钙化、炎症反应、血管平滑肌细胞增殖与迁移等多种过程,进而抑制AS的形成[3]。RhoA/ROCK通过调控NF-κB的活化,抑制RhoA/ROCK/NF-κB通路可抑制炎症反应,减轻心肌缺血-再灌注损伤[4]。益肾活血化痰方主要由熟地、枸杞、山茱萸等中药组成,临床显示,益肾活血化痰方可改善2型糖尿病合并颈动脉粥样硬化患者中医证候及颈动脉内中膜厚度、斑块数目、血流速度、血流阻力等[5]。本研究在临床应用基础上,进一步从RhoA/ROCK/NF-κB信号通路途径探讨益肾活血化痰方对AS的抗炎作用机制,为临床治疗AS提供理论基础。
1 材料与方法
1.1 材料
1.1.1 动物 SPF级雄性ApoE-/-小鼠,体质量19~26 g,购自广东省实验动物监测所[生产许可证号:SCXK(粤)2018-0044]。
1.1.2 药物和试剂 益肾活血化痰方(熟地20 g,枸杞15 g,山茱萸12 g,菟丝子12 g,山药12 g,赤芍15 g,牛膝15 g,丹皮9 g,陈皮6 g,半夏9 g等)购自福建医科大学附属协和医院中药房,中药预先浸泡30 min后水煎2次,再合并水煎液,于水浴锅中浓缩成含生药量2 g/ml,分装冻存备用。阿托伐他汀钙片(国药准字H20163270,20 mg)购自乐普制药科技有限公司;通用SP检测试剂盒(SP0041)购自北京索莱宝生物科技有限公司;油红O(O0625)、Y-27632(Y0503,纯度≥98%)购自美国Sigma公司;BCA蛋白浓度测定试剂盒(P0011)、RIPA裂解液(P0033)购自碧云天生物科技有限公司;RhoA(ab86297)、ROCK(ab134181)、p-NF-κB p65(ab239882)、NF-κB p65(ab207297)抗体、山羊抗兔IgG H&L(HRP)(ab6721)、TNF-α(ab208348)、IL-1β(ab197742)、IL-6(ab222503)检测试剂盒购自美国Abcam公司。
1.2 方法
1.2.1 动物分组及造模 小鼠适应性饲养1周后,制备AS模型,将小鼠分为对照组与AS模型组,AS模型组小鼠给予高脂饲料(含脂肪21%,胆固醇0.15%)喂养12周,对照组给予普通饲料喂养,造模后,随机取5只小鼠处死,在光镜下观察小鼠心脏主动脉根部有AS斑块形成,即为造模成功[6]。
将小鼠按照随机数字表法分为对照组、模型组、药物组(益肾活血化痰方)、抑制剂组和阳性药物组,每组10只,小鼠给药量根据公式=9.1×成人临床药量[g/(kg·d)]换算,药物组小鼠造模后使用303 mg/kg益肾活血化痰方灌胃给药,阳性药物组小鼠造模后使用3.03 mg/kg的阿托伐他汀[7]给药,药物使用蒸馏水溶解后灌胃给药,对照组与模型组给予灌胃等量的蒸馏水,每天1次,连续给药两周,抑制剂组小鼠造模后仅腹腔注射ROCK抑制剂Y-27632(5 mg/kg),连续给药3 d。
1.2.2 主动脉油红O染色 给药后小鼠眼眶取血,3 000 r/min离心10 min,收集血清,-80 ℃保存,用于血清炎症因子与血脂检测。脱颈处死10只小鼠,取胸主动脉,其中5只使用4%甲醛固定过夜,分别使用10%,20%和30%蔗糖溶液脱水,切片后使用油红O染色,封片晾干后,显微镜(型号:Ⅸ71,日本Olympus公司)观察并拍照,Image J图像分析软件分析斑块面积比,斑块面积比=斑块面积/管腔面积×100%。
1.2.3 血清炎症因子与血脂检测 将各组小鼠眼眶取血的血清按2倍稀释后,按照试剂盒说明书分别检测血清炎症因子(TNF-α、IL-1β、IL-6)水平,自动生化分析仪检测血脂(TG、TC、LDL-C、HDL-C)水平。
1.2.4 免疫组化染色 取另外5只小鼠的主动脉组织,其中一部分保存用于Western blot检测,另一部分石蜡包埋切片,使用SP试剂盒进行染色,切片经二甲苯脱蜡乙醇梯度脱水后封闭,分别加入IL-1β一抗和二抗进行孵育,DAB显色,苏木精复染,以PBS代替一抗作为阴性对照,显微镜观察,阳性细胞呈棕色至棕褐色着色,Image Pro Plus软件检测图片平均光密度值。
1.2.5 Western blot法检测主动脉组织RhoA、ROCK、p-NF-κB p65、NF-κB p65蛋白 取小鼠主动脉组织50 mg,研磨后加入蛋白裂解液,冰上裂解1 h后离心取上清液,BCA对蛋白进行定量,取30 μg蛋白煮沸变性后,电泳分离并转膜,10%脱脂奶粉封闭2 h,加入RhoA(1 ∶1 000稀释)、ROCK(1 ∶1 000稀释)、p-NF-κB p65(1 ∶1 500稀释)、NF-κB p65(1 ∶1 500稀释)一抗,4 ℃孵育过夜,加入二抗孵育并显色放大,凝胶成像仪(型号JP-2880,上海金鹏分析仪器有限公司)成像,Image J图像分析软件分析蛋白,以β-actin为内参,计算各蛋白相对表达水平,以p-NF-κB p65/NF-κB p65表示NF-κB p65磷酸化水平。
1.3 统计学方法
2 结果
2.1 益肾活血化痰方对AS小鼠血脂水平的影响
与对照组比较,模型组小鼠血清TG、TC、LDL-C水平显著升高,HDL-C水平显著降低(P<0.05);与模型组比较,药物组、抑制剂组、阳性药物组小鼠清TG、TC、LDL-C水平显著降低,HDL-C水平显著升高(P<0.05),药物组与阳性药物组、药物组与抑制剂组之间各指标差异无统计学意义(P>0.05,见表1)。结果表明,益肾活血化痰方与阳性药物、抑制剂的药效一样,具有降低AS小鼠血脂水平的作用。
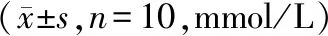
表1 益肾活血化痰方对AS小鼠血脂水平的影响
2.2 益肾活血化痰方对AS小鼠主动脉斑块面积的影响
油红O染色显示脂肪斑块呈橘红色或红色,对照组未见明显斑块,模型组小鼠斑块明显,斑块面积百分比较对照组显著升高(P<0.05);与模型组比较,药物组、抑制剂组、阳性药物组斑块面积显著降低(P<0.05),药物组与阳性药物组、药物组与抑制剂组斑块面积差异不显著(P>0.05,见图1和表2)。实验结果表明益肾活血化痰方与阳性药物、ROCK抑制剂作用一样,均有降低AS小鼠主动脉斑块面积的作用。

图1 益肾活血化痰方对AS小鼠主动脉斑块面积的影响 (油红O染色,×100)Figure 1 The effect of Yishen Huoxue Huatan formula on the aortic plaque area of AS mice (oil red O staining, ×100)

表2 益肾活血化痰方对AS小鼠主动脉斑块面积的影响
2.3 益肾活血化痰方对AS小鼠血清炎症因子的影响
与对照组比较,模型组小鼠血清TNF-α、IL-1β、IL-6水平显著升高(P<0.05);与模型组比较,药物组、抑制剂组、阳性药物组小鼠血清TNF-α、IL-1β、IL-6水平显著降低(P<0.05),药物组与阳性药物组、药物组与抑制剂组血清TNF-α、IL-1β、IL-6水平比较,差异无统计学意义(P>0.05,见表3),表明益肾活血化痰方和阳性药物、ROCK抑制剂均有抑制血清炎症因子释放的作用。
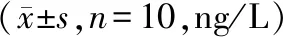
表3 益肾活血化痰方对AS小鼠血清炎症因子的影响
2.4 各组AS小鼠主动脉组织IL-1β免疫组化染色结果
免疫组化结果显示,与对照组比较,模型组小鼠主动脉组织褐色着色加深,IL-1β阳性表达升高(P<0.05);与模型组比较,药物组、抑制剂组、阳性药物组小鼠主动脉组织褐色着色减轻,IL-1β阳性表达减少(P<0.05),药物组与阳性药物组、药物组与抑制剂组IL-1β阳性表达差异无统计学意义(P>0.05,见图2与表4)。实验结果提示益肾活血化痰方和阳性药物、ROCK抑制剂均有抑制炎症因子表达的作用。
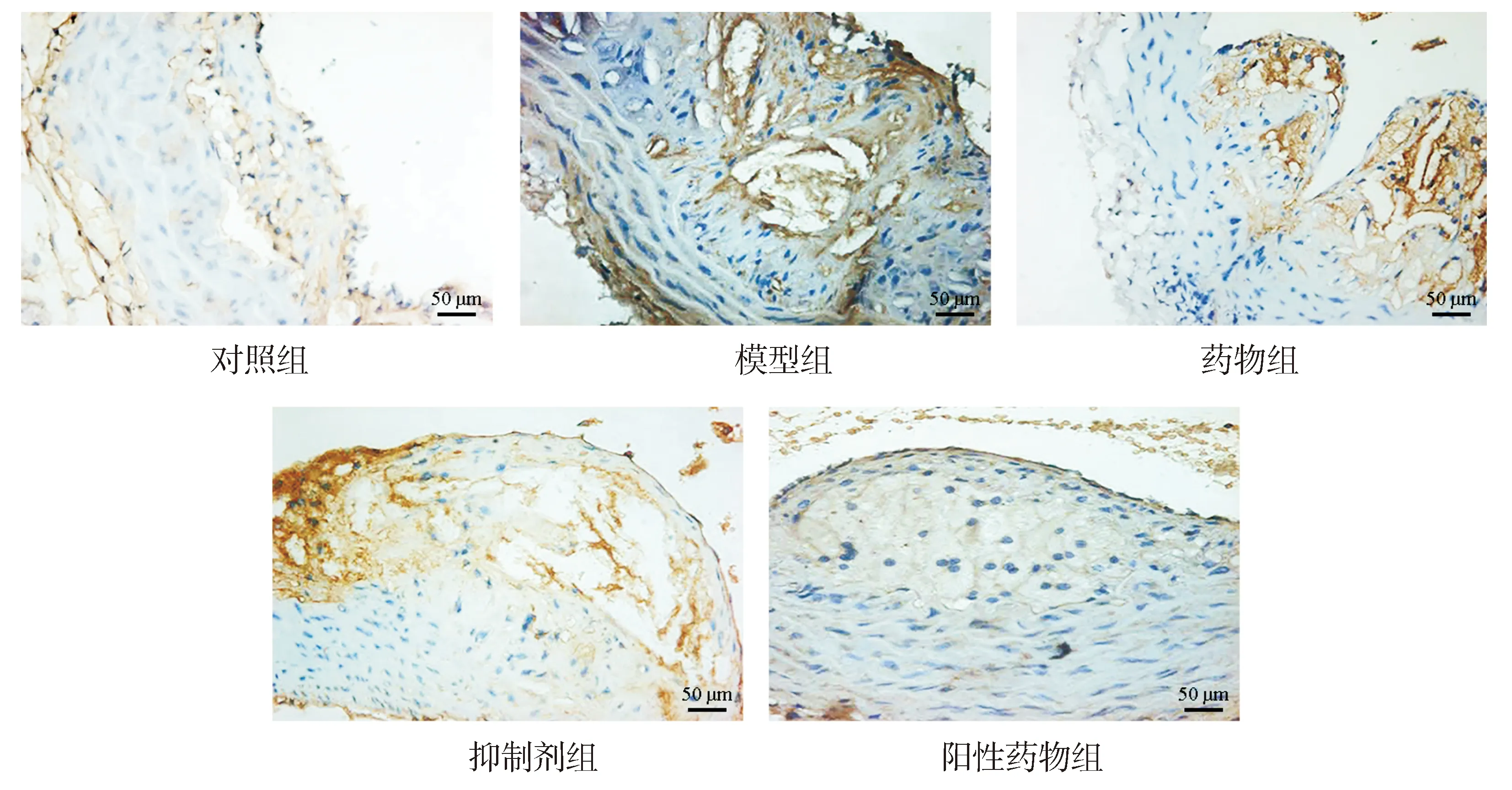
褐色为IL-1β阳性表达,蓝色为细胞核图2 各组小鼠主动脉组织IL-1β免疫组化染色结果 (SP,×200)Figure 2 Immunohistochemical staining of IL-1β in aorta tissue of mice in each group (SP,×200)

表4 各组小鼠主动脉组织IL-1β免疫组化染色结果比较
2.5 益肾活血化痰方对AS小鼠主动脉组织RhoA、ROCK、p-NF-κB p65/NF-κB p65蛋白表达的影响
Western blot结果显示,与对照组比较,模型组小鼠主动脉组织RhoA、ROCK、p-NF-κB p65蛋白表达水平显著升高(P<0.05);与模型组比较,药物组、抑制剂组、阳性药物组小鼠主动脉组织RhoA、ROCK蛋白表达水平及p-NF-κB p65/NF-κB p65显著减少(P<0.05),药物组与抑制组各蛋白表达差异无统计意义(P>0.05,见图3与表5)。此结果提示益肾活血化痰方与ROCK抑制剂均有抑制RhoA/ROCK/NF-κB信号通路激活的作用。

图3 各组小鼠主动脉组织RhoA、ROCK、p-NF-κB p65蛋白表达Figure 3 Expression of RhoA, ROCK, p-NF-κB p65 protein in aortic tissue of mice in each group by Western blot

表5 小鼠主动脉组织RhoA、ROCK、p-NF-κB p65/NF-κB p65蛋白表达比较
3 讨论
AS的发生发展过程与脂质代谢异常、炎症因子释放、血管内皮损伤等有密切关系,因此缓解炎症反应、改善脂质代谢对于治疗AS有重要意义[8]。ApoE-/-小鼠通过高脂饲料喂养建立AS模型是常用的动物模型,本研究显示建模后,AS小鼠血清炎症因子水平与血脂水平升高,主动脉斑块面积增大,与以往报道结果类似[9]。
中医上AS应属于中医“血瘀证”、“痰证”等范畴,造成AS形成的因素来自“虚”和“损”两个方面,其中“虚”以肾虚为主,“损”以痰阻血瘀为主,肾虚影响肾之精气,而致血瘀、痰阻,痰、瘀等损伤性因素可侵入脉络,导致AS的发生[10]。使用活血祛痰法、活血法防治AS已得到研究证实[11,12]。根据临床经验,发现使用益肾活血化痰方的AS病人症状及颈动脉斑块等均有改善,此方主要使用左归丸加活血化痰中药,主要包括山药、熟地、枸杞、山茱萸等多味中药,方中熟地、枸杞、山茱萸、菟丝子、山药滋补肾阴,赤芍、牛膝、丹皮凉血活血化淤,陈皮、半夏燥湿化痰,防凉血不利气机畅通之弊,诸药合用具有益肾活血化痰之效。本研究给予小鼠益肾活血化痰方治疗后,可显著降低小鼠血清TNF-α、IL-1β、IL-6水平,改善小鼠的血脂异常,降低小鼠主动脉病变斑块的面积,与阿托伐他汀治疗的效果类似,提示益肾活血化痰方对改善AS有一定效果。研究显示,炎症是AS发生的基础,在AS的发展过程中多种促炎因子如TNF-α、IL-6显著升高[13]。过量的脂质摄入会导致机体产生氧化应激,诱导炎症反应,激活NF-κB等信号通路,促进促炎因子IL-6、IL-1β等释放,促进AS的形成[14]。
RhoA/ROCK信号通路介导的炎症反应可以引起血管内皮损伤,在AS、高血压、糖尿病、脑血管疾病等疾病的发生发展中起着重要作用,研究显示,AS的形成与RhoA/ROCK信号通路的激活密切相关[15,16]。RhoA/ROCK通路通过调控巨噬细胞功能,诱导炎症的发生,导致AS形成[17]。NF-κB是炎性因子转录调控的主要因子,NF-κB可放大炎症信号、激活凋亡因子、诱导AS的形成,NF-κB p65通路的激活以磷酸化形式存在(p-NF-κB p65),研究显示,丹酚酸B可减轻AS小鼠肝脏炎症反应,可能与抑制MAPKs/NF-κB信号通路、下调炎症因子水平有关[18]。本研究结果显示,益肾活血化痰方治疗后,AS模型小鼠主动脉组织RhoA、ROCK蛋白表达及p-NF-κB p65/NF-κB p65显著降低,表明RhoA/ROCK信号通路及NF-κB p65通路激活受到到抑制。研究显示,RhoA/ROCK可调控NF-κB参与炎症反应,抑制RhoA/ROCK/NF-κB信号通路可减轻晚期糖基化终末产物诱导的足细胞损伤[19]。本研究结果显示,抑制剂组RhoA、ROCK蛋白表达水平及p-NF-κB p65/NF-κB p65也显著减少,提示益肾活血化痰方可能抑制RhoA/ROCK/NF-κB信号通路的激活,且本研究还显示,益肾活血化痰方与ROCK信号通路抑制剂治疗小鼠的效果类似,证实益肾活血化痰方具有抑制RhoA/ROCK/NF-κB通路的作用。
综上所述,益肾活血化痰方可能通过抑制RhoA/ROCK/NF-κB信号通路激活,改善AS小鼠血脂代谢,减轻AS小鼠炎症反应。但本研究尚存在不足之处,后续将通过使用通路抑制剂进一步验证益肾活血化痰方对该通路的具体机制。

