影像引导大分割放疗在转移性甲状腺癌中的应用
沈 晶,乔彩霞, ,胡 克,侯晓荣,张福泉
1.中国医学科学院北京协和医学院北京协和医院放疗科疑难重症及罕见病国家重点实验室,北京 100730;
2.山东省聊城市第三人民医院肿瘤内科,山东 聊城 252000
甲状腺癌是临床上常见的内分泌系统肿瘤,临床治疗需根据患者的分期、病理学类型等因素决定。分化型甲状腺癌通常以外科手术和放射性核素碘治疗为主。外照射放射治疗(external beam radiotherapy,EBRT)主要应用于肿瘤局部残存或转移性病变无法摄碘时[1-2],如骨转移的止痛治疗、转移灶的姑息治疗。在全身治疗的基础上,局部控制良好可对患者生存有获益[3-6]。
随着放射治疗技术的进步,应用图像引导放射治疗(image-guided radiation therapy,IGRT)、立体定向放射治疗(stereotactic radiotherapy,SRT)等技术,可以给予病灶更高的照射剂量,同时保证较低的不良反应发生率,对于肿瘤的局部控制有很强的生物学优势,且在生存上亦有转化获益[7-8],目前,在临床上的应用也日趋广泛。本研究旨在回顾并分析本中心应用图像引导的大分割EBRT转移性甲状腺癌患者的临床疗效及不良反应。
1 资料和方法
1.1 资料
收集2008年1月—2021年1月于北京协和医院放疗科就诊的转移性甲状腺癌患者(图1)。纳入标准:① 病理学检查确诊为甲状腺癌;② 病理学或影像学诊断为转移性病灶;③ 应用IGRT(2.5~8.0 Gy/次),转移病灶不适宜接受其他全身或局部治疗(如多次手术史再次手术风险较大,碘难治病灶等);④ 接受EBRT时,距离末次治疗时间均大于1个月。共纳入63例患者,其中男性25例,女性38例,年龄36~78岁,中位年龄61岁;其中甲状腺乳头状癌(papillary carcinoma of the thyroid,PTC)37例,甲状腺滤泡状癌(follicular carcinoma of the thyroid,FTC)12例,甲状腺髓样癌(medullary carcinoma of the thyroid,MTC)8例,甲状腺未分化癌6例。
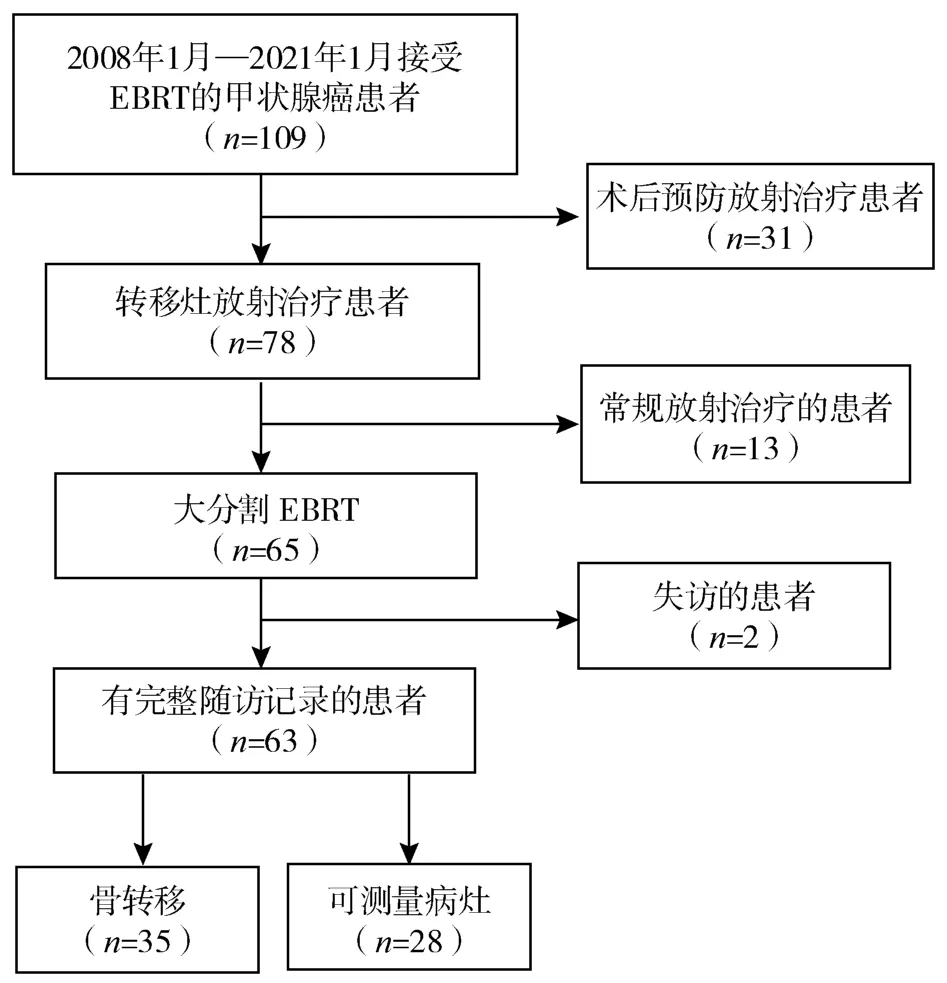
图1 筛选流程图
所有患者的首次治疗均为手术,47例患者既往接受了2次及以上的手术治疗,16例患者接受了1次手术。43例患者既往接受过放射性碘消融治疗(radioactive ablative iodine,RAI),但在治疗过程中出现了碘难治的情况[病灶在131I治疗后全身显像上表现为不摄碘,或原本摄碘的病灶经131I治疗后逐渐丧失摄碘能力,或病灶摄碘但在1年内出现疾病进展,或131I累积用量超过600 mCi(1 Bq=2.70×10-8mCi)但疾病无缓解],17例患者接受过全身化疗,15例接受过靶向治疗,20例接受过唑来膦酸的治疗。患者全身转移病灶情况:21例为单发病灶,42例为多发病灶;骨转移灶患者35例(中轴骨为27例,其他8例),其他可测量转移灶28例(脑部3例,肺部4例,肝部3例,颈部淋巴结8例,其他10例)。具体情况见表1。
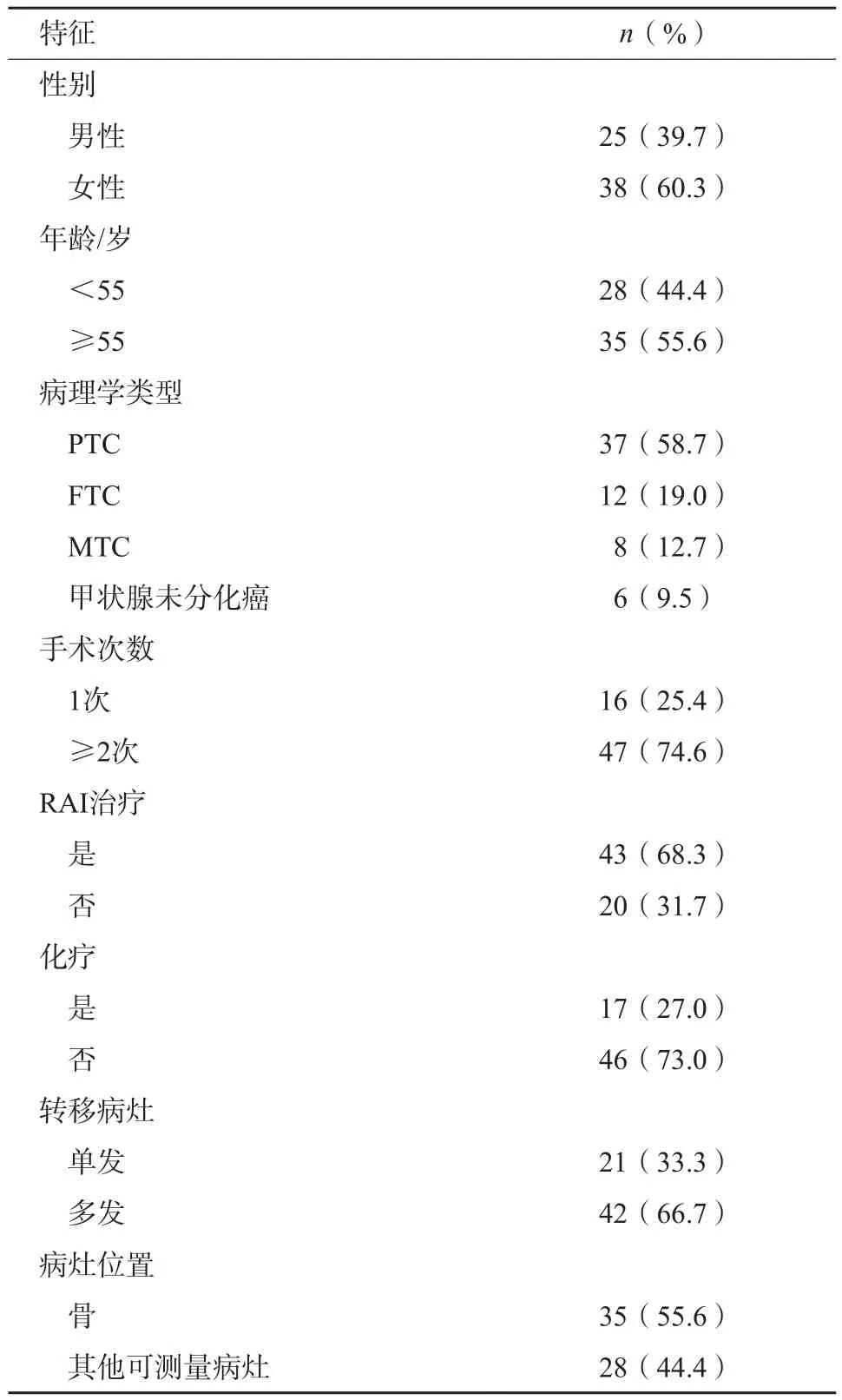
表1 大分割EBRT甲状腺癌患者的临床资料
1.2 放射治疗方法
依据临床症状、查体表现及影像学检查发现,并根据转移病灶的位置,选择合适的EBRT方案。根据病变部位使用合适的固定装置进行计算机体层成像(computed tomography,CT)模拟定位。在定位CT图像上勾画大体肿瘤区(gross target volume,GTV),在GTV上外扩3~5 mm的边缘以获得计划肿瘤靶区(planning gross targetvolume,PGTV)。肿瘤周边高危区域或局部淋巴引流区为临床靶区(clinical target volume,CTV),根据不同病灶的位置在CTV上加5~8 mm的边缘以获得计划临床靶区(planning target volume,PTV),应用Elicpse 13.6版软件进行设计,计算PTV和危及器官的剂量-体积直方图。治疗前均进行锥形束CT图像引导验证。外照射均采用6 MV X线,调强放射治疗(intensity-modulated radiation therapy,IMRT)采用美国VARIAN公司Trilogy加速器进行,外照射剂量分割方案根据照射部位进行(24~66) Gy/(6~25)次,2.5~8.0 Gy/次的大分割EBRT[等效剂量(equivalent dose of 2 Gy per fraction,EQD2)α/β=10为33.6~115.2 Gy]。均应用锥形束CT(cone beam CT,CBCT)影像引导,并在线匹配,误差控制在3 mm内。
1.3 疗效评估方法
对于骨转移患者按照数字分级评分法(numerical rating scale,NRS)进行评估,分为0~10分。其中0分为无痛,1~3分为轻度疼痛,4~6分为中度疼痛,7~10分为重度疼痛。止痛疗效评价标准:0度为疼痛加重或未缓解,Ⅰ度为疼痛缓解25%,Ⅱ度为疼痛缓解50%,Ⅲ度为疼痛缓解75%,Ⅳ度为疼痛完全缓解(complete response,CR)。有效率为止痛药物不增加剂量的前提下,疼痛缓解达到Ⅱ~Ⅳ度。
放疗结束后2~6个月,复查CT、磁共振成像(magnetic resonance imaging,MRI)或正电子发射体层成像(positron emission tomography,PET)/CT和肿瘤标志物,对患者进行评估。对于有可测量的复发及转移性病灶,按照实体瘤临床疗效评价标准(response evaluation criteria in solid tumor,RECIST)1.1版进行疗效评估:即通过测量治疗前、治疗后1个月可测量病灶直径的变化,可分为CR、部分缓解(partial response,PR)、疾病稳定(stable disease,SD)和疾病进展(progressive disease,PD)。CR为所有靶病灶消失,全部病理学淋巴结短径小于1 cm;PR为靶病灶直径之和比基线水平减少至少30%;PD为出现1个或多个新病灶和/或已有的非靶病灶明确进展,直径之和比基线水平增加20%;SD为病灶进展未达到PD且缓解未达PR。疾病控制率(disease control rate,DCR)=CR+PR+SD。客观缓解率(objective response rate,ORR)=CR+PR。
1.4 随访
对63例患者临床资料进行回顾性研究,查阅病历资料并进行电话随访。随访内容:性别、年龄、确诊方式、病理学分型、治疗方式、就诊时的全身状态、治疗前后可测量病灶的直径、血清标志物检查、局部控制情况及全身状态、复发次数、复发时血清标志物检查情况、复发后治疗方式等。不良反应应用不良事件通用术语标准(common terminology criteria for adverse events,CTCAE)4.0版评价。
随访期为自接受手术治疗之日至末次随访日或死亡时间,随访截止时间为2021年12月30日。对于有可测量的病灶,在治疗后1~3个月按照RECIST 1.1版进行疗效评估。生存期(overall survival,OS)定义为从放疗开始至末次随访日或死亡时间,无进展生存期(progression- free survival,PFS)定义为从放疗开始至首次出现病情进展的时间,无局部复发生存(local recurrence-free survival,LPFS)定义为从放疗开始至出现放疗照射野内局部复发的时间。
1.5 统计学处理
采用SPSS 25.0软件进行统计学分析。χ2检验用于分类变量。采用Kolmogorov-Smirnov方法对连续变量进行正态性检验。Studentt检验用于评估正态分布变量,Mann-WhitneyU检验用于非正态分布变量。采用Kaplan-Meier方法评估OS、PFS和LPFS,并采用单变量对数秩检验评价预后因素对生存率的意义。采用Cox比例回归法对单变量分析中选择的协变量进行多变量分析。P<0.05为差异有统计学意义。
2 结 果
2.1 骨转移灶的临床缓解
2.1.1 骨转移灶的部位及照射剂量
骨转移以中轴骨转移居多(62.9%,22/35),具体骨转移部位如下:椎体22例(颈椎7例,胸椎10例,腰椎5例),骨盆5例,胸骨2例,肩胛骨2例,颅骨3例,肱骨1例。
所有患者均接受EBRT治疗,包括IMRT及SRT,根据照射部位及临近周围正常组织器官选择照射单次剂量,总剂量为24~40 Gy,单次剂量为3~6 Gy,5~10次,EQD2 α/β=10为33.6~56.0 Gy(表2)。
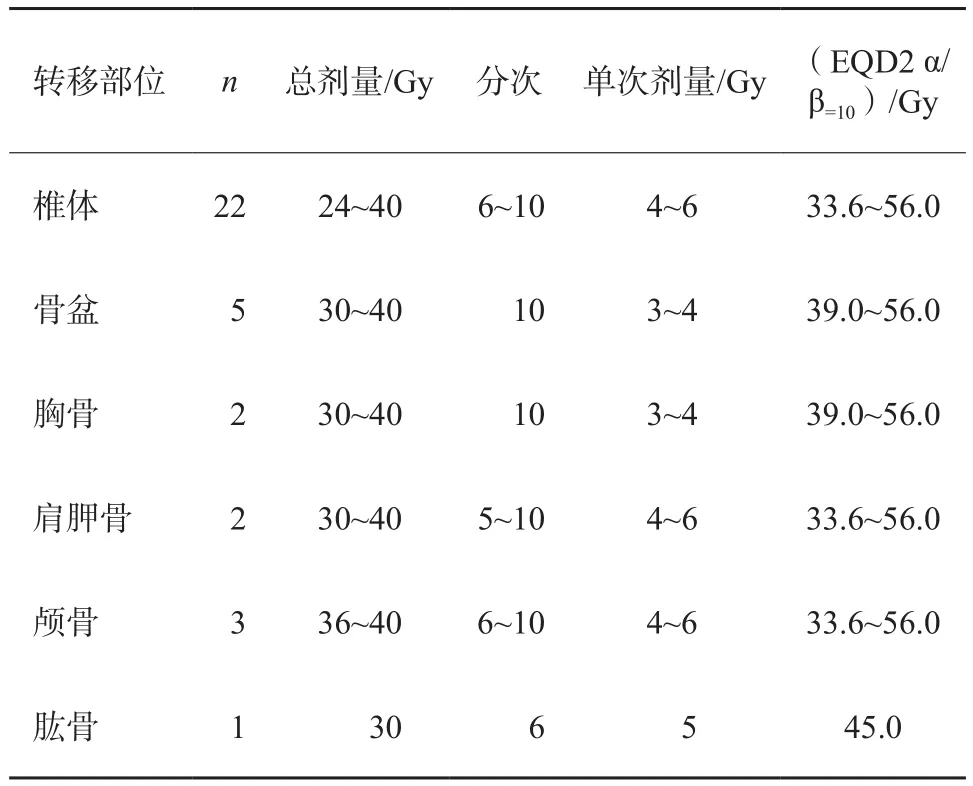
表2 骨转移病灶的部位及EBRT剂量
2.1.2 骨转移灶放疗后症状缓解情况
按NRS判断患者症状改善情况。35例患者,治疗前疼痛评分(7.68±0.66)分,应用EBRT后1个月评估为(4.35±1.19)分,治疗结束后3~6个月评估为(2.25±1.08)分,有效率分别为74.3%(26/35)和88.6%(31/35),与治疗前相比,EBRT的止疼效果明显(P<0.05),部分患者放疗效果略有延迟,治疗结束后3~6个月的有效率高于1个月的有效率。
2.1.3 不良反应
骨转移灶应用EBRT后,急性期反应出现CTCAE血液学毒性常见,10例出现2度骨髓抑制,8例出现3度骨髓抑制,予药物对症治疗后好转。另有11例出现2级消化道反应,7例出现2级皮肤反应。
2.2 可测量病灶的临床疗效
2.2.1 可测量病灶的分布及照射剂量
可测量病灶28例(包括脑转移3例,肺转移4例,肝转移3例,淋巴结转移8例,其他10例)。根据照射部位不同,照射剂量及分割模式为30~66 Gy,单次剂量为2.5~8.0 Gy,6~25次,EQD2 α/β=10为33.6~115.2 Gy(表3)。
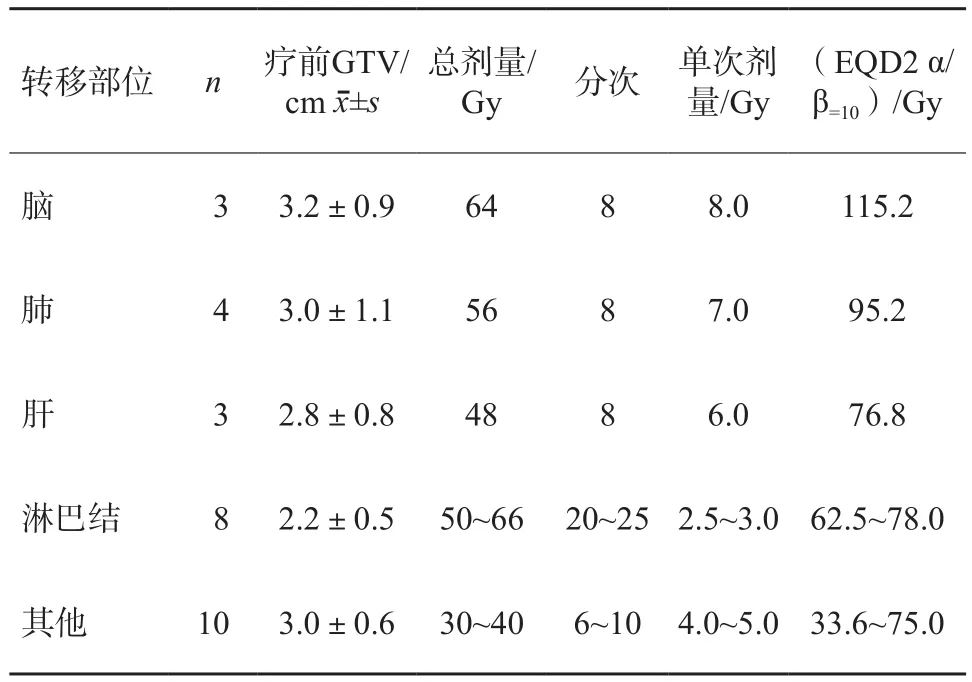
表3 可测量病灶的临床特征及照射剂量
2.2.2 可测量病灶放射治疗的近期疗效分析
治疗后2~6个月评估,达到CR者7例,PR者7例,SD者10例,PD者4例,评估DCR为85.71%,ORR为50.0%。进展4例,均为肿瘤负荷大的患者(治疗前直径>3 cm,表4)。
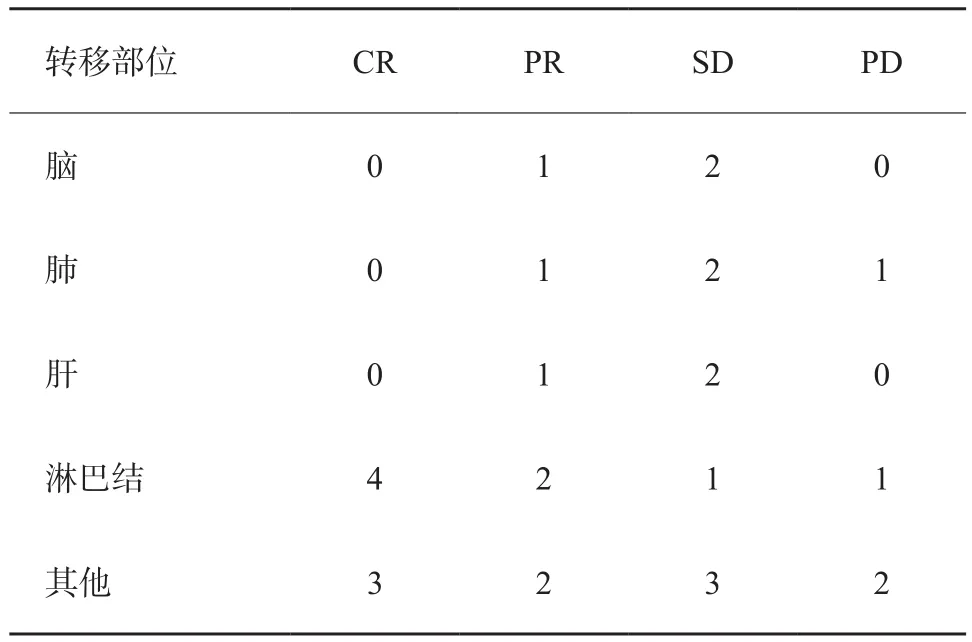
表4 可测量病灶的近期疗效
2.2.3 可测量病灶放射治疗的远期疗效分析
中位随访时间49个月,期间有12例患者接受过全身化疗,14例患者接受过靶向治疗。2、5年的LRFS分别为55.0%和42.5%,2、5年的PFS分别为70.0%和37.5%。
分析性别、年龄、病理学类型、病灶部位、病灶数目、疗前手术次数、是否经过化疗、是否接受131I治疗、疗前病灶直径、放疗技术、放疗的等效生物学剂量、EBRT治疗1个月时的疗效等因素对患者5年PFS的影响,单因素分析结果显示病理学类型、转移灶数目、EQD2 α/β=10≥64 Gy是影响患者5年PFS的因素(P<0.05)。多因素分析显示病理学类型、转移灶数目是影响患者5年PFS的独立因素(表5)。
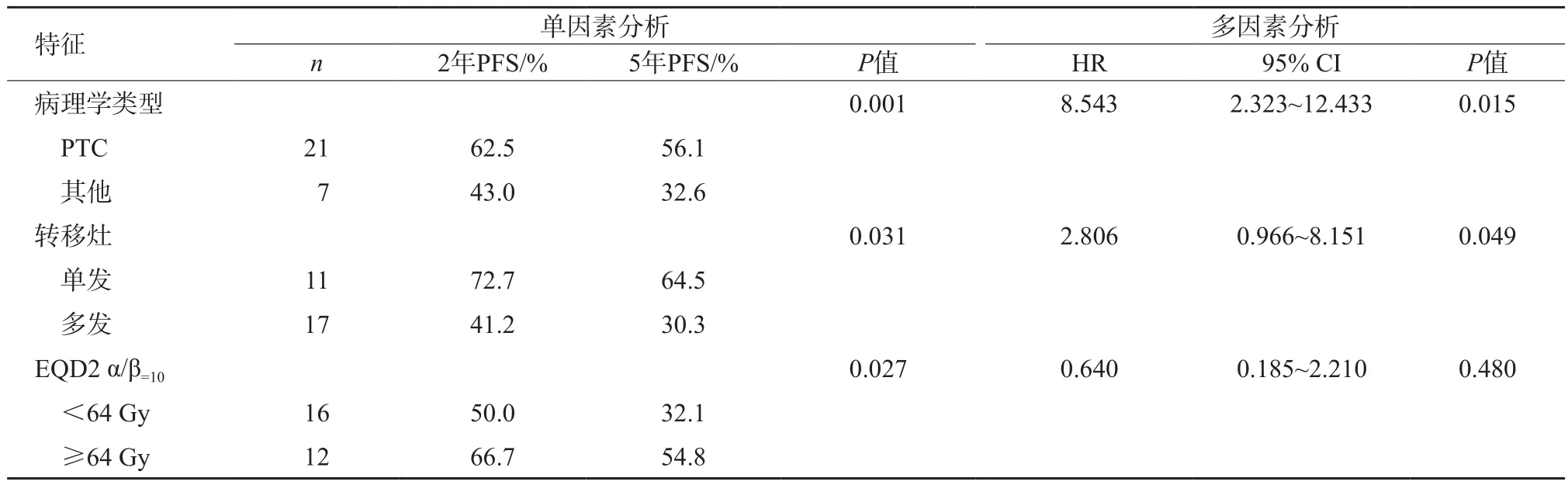
表5 可测量转移性甲状腺癌患者5年PFS的相关因素分析
2.2.4 可测量病灶放射治疗的不良反应
28例可测量病灶患者在治疗中出现CTCAE-2级皮肤反应11例,2级消化道反应10例,2级血液学毒性10例,3级血液学毒性14例,均给予相应的对症支持治疗。在治疗后恢复,未观察到3级以上不良反应。
3 讨 论
甲状腺癌常见的复发部位为甲状腺瘤床区或颈部淋巴结区,常见的远处转移部位为肺(70%)和骨(20%),分化型甲状腺癌即使出现了复发或远处转移,多数仍可长期存活,但复发/转移灶的控制情况会直接影响患者的生存期[9]。文献[9-10]报道,大约9%的分化型甲状腺癌在就诊时已合并远处转移,这是导致分化型甲状腺癌患者死亡的主要原因之一,一旦出现了远处转移,分化型甲状腺癌患者的5年生存率下降为65.0%~83.8%[9],10年生存率下降为72.1%[10]。对甲状腺癌出现复发/转移的患者进行挽救性治疗,可以提高病灶的局部控制率,同时也可以进一步改善生存。EBRT主要应用于局部晚期无法切除的甲状腺癌的治疗,或转移性病变无法摄碘时的治疗,是系统治疗的良好补充[2,11]。随着放疗技术的进步,图像引导技术的广泛应用,大分割放疗对于实体瘤病灶,在保护周围危及器官的前提下可以提高照射剂量,增加局部控制率,缩短治疗时间,降低时间经济成本,且可能转化为生存获益,相关的临床研究[7]已证实了应用图像引导的大分割治疗所带来的临床获益。
甲状腺癌骨转移的发生率为10%~15%[13],常伴随局部疼痛,一旦发生骨折等骨相关事件,会明显影响患者生存质量。治疗骨转移癌性疼痛的方法多样,但多数患者身体条件已不适合接受外科手术+内固定治疗[14],或难以耐受进一步系统治疗,且放射性碘对骨转移患者通常疗效欠佳[15]。EBRT可用于碘难治性、无法切除的、有症状的(或在负重部位的无症状性)骨转移患者[16]。本研究应用CT引导分割EBRT对于治疗甲状腺癌骨转移,疼痛症状缓解显著,起效时间短(1个月有效率为74.3%),维持时间较长(3~6个月有效率为88.6%),且观察中未出现3级以上不良反应,显示了影像引导大分割放疗的良好疗效。
本研究中,对于可测量的转移性病灶,EBRT治疗后2~6个月评估,DCR为85.71%,ORR为50%。出现病情进展的4例,均为肿瘤负荷大的患者(治疗前直径>3 cm)。应用RAI治疗甲状腺癌复发/转移病灶的相关报道较多,Qutbi等[17]分析了75例分化型甲状腺癌肺转移患者,14例患者应用131I进行治疗有效,平均20个月(8~48个月)起效,经历平均2轮(1~7轮)的治疗。Sugino等[18]的研究显示,RAI用于分化型甲状腺癌患者的远处转移病灶,其DCR为55.6%[17]。相比于RAI,影像引导大分割EBRT对复发/转移病灶的局部控制显示出了一定的优势,起效快,反应率高。本研究接受放疗的患者中,有15例既往接受过RAI,提示对于RAI治疗无效的患者应用EBRT仍有很好的治疗作用。
应用影像引导大分割EBRT在复发转移甲状腺癌患者中的远期疗效也不错。本研究中2年LFRS、PFS分别为55%、70%,5年LFRS、PFS分别为42.5%、37.5%,单因素分析,病理学类型、单发/多发病灶数、放疗照射剂量是5年PFS的相关因素。多因素分析,病理学类型、单发/多发病灶数是独立相关因素。分化型甲状腺癌、复发/转移病灶部位少的预后较好[17-18]。且本研究中21例PTC患者在接受EBRT之前,曾接受过RAI的患者有20例,提示对于RAI治疗无效的患者EBRT仍有一定的效果。本研究中脑转移灶的患者有3例,应用了SRT技术,近期疗效2例达到了SD,1例PR,且存活时间达到22~30个月。指南对于脑转移病灶,根据不同的数目,可选择不同的放疗技术。应用全脑放射治疗(whole brain radiation therapy,WBRT)未带来明确的生存获益[19]。目前推荐颅内病灶可应用SRT技术,中位生存时间可达到11.9~52.5个月[20]。RAI对颅内病灶有效率低,报道的中位生存时间为4~33个月[21]。应用大分割EBRT在脑转移治疗方面有很好的应用前景。
本研究仍存在一定的局限性,回顾性分析存在一定的选择偏倚,接受影像引导大分割EBRT的复发/转移性甲状腺癌患者较少,导致可纳入分析的患者较少,期待后续多中心的研究。
综上所述,影像引导大分割EBRT,对于转移性甲状腺癌患者,有很好的临床症状缓解率,局部病灶控制率高,延长PFS可能有长期生存获益转化。

