基于喹啉基的噁二唑酮类荧光探针合成及对Fe3+的识别
徐 衡,杨 萍,桂乃成,余强红,陈太杰,黄荣谊
(安庆师范大学化学化工学院,功能配合物安徽省重点实验室,安徽 安庆 246011)
1 引 言
近年来,很多金属离子参与了生命的进程,尤其是成为生命体不可或缺的微量元素,如铁、锌、锡、铬、铝等低浓度的无机阳离子在细胞水平上参与了重要的生物和化学转化,如酶活性调节等[1-5]。Fe3+离子是环境中普遍存在的金属离子,对所有活细胞的正常功能起着核心作用,在体内血红蛋白质转运氧气过程中扮演着重要角色[6-8]。然而,过量摄入这种离子则会对人体产生危害,特别是体内Fe3+离子浓度长期超值会导致多种疾病的发生,如引发肝功能损害、免疫系统紊乱、心脏病和糖尿病等[9-12]。因此,Fe3+离子是研究生物和环境影响最相关、最重要的金属离子之一。
随着工业化进程的加深,包括Fe3+离子在内的大量重金属离子被释放到环境中,在土壤、水体中积聚,严重威胁了人类的生命。为此,开发简单、有效的检测环境和生物体中Fe3+离子的方法是十分必要的。目前检测Fe3+离子的手段主要有原子吸收光谱、电感耦合等离子体原子发射光谱、电化学和色谱法等[13-17],但普遍存在仪器昂贵/维护复杂、样品准备繁琐,以及需要熟练的操作人员等缺点。相比之下,荧光探针具有高选择性/灵敏度、快速响应、成本低廉、实时检测和仪器设备相对简单等特点,因而引起了人们的关注[18-23]。
荧光材料种类多样,其中有机荧光材料以其良好的可调节性、丰富的颜色、高色纯度、通过改变共轭长度可控制其光电性能等特点得到了广泛研究[24-26]。通常作为荧光材料的有机物可以是含有高度共轭不饱和和扩展的π-电子云结构化合物,或者是具有被电子激发到更高的振动和旋转能量状态的空能级的无序有机物。
在此,我们通过分子设计合成了具有π-共轭体系的新型喹啉基酰肼化合物1~3和喹啉基噁二唑酮类衍生物4~6。荧光光谱测定表明合成的6种化合物均具有较强的固体荧光发射能力。同时制备了化合物4~6的荧光探针,探测其在不同金属离子存在下溶液荧光的发射行为,并观察到该3种化合物探针对Fe3+离子具有高效荧光猝灭效应,是良好的Fe3+离子荧光探针。
2 实 验
2.1 仪器与试剂
测试仪器:Nicolet iS50 FTIR光谱仪(KBr压片);STA-409PC综合热重分析仪;Hitachi 850型荧光分光光度计;AVANCE AV 400核磁共振谱仪;AutoSystem-XL GC/Turbomass MS质谱分析仪。所有合成用试剂均为分析纯,测试所用溶剂为色谱纯,均来自于阿拉丁试剂有限公司,使用前均未提纯。
2.2 实验方法
2.2.1 化合物的合成
化合物1~6的合成路线如图1所示。
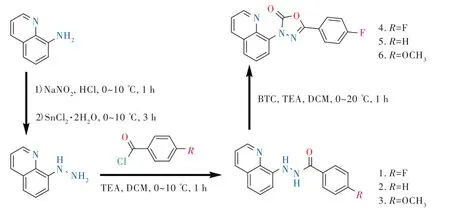
图1 化合物1~6的合成路线Fig.1 Synthesis route of compounds 1-6
2.2.2 8-肼基喹啉中间体的合成
按照文献[27]以8-氨基喹啉为原料通过重氮化、还原反应制备8-肼基喹啉。
2.2.3 喹啉基酰肼化合物1~3的合成
4-氟-N'-(8-喹啉基)苯甲酰肼(1)。将4-氟苯甲酰氯(0.99 g,62.80 mmol)用10 mL二氯甲烷(DCM)稀释。称取干燥后的8-肼基喹啉(10.00 g,62.81 mmol)用20 mL的DCM溶解,加入三乙胺(10.60 g,94.22 mmol),在氮气保护下降温至0~10℃,并在该温度下缓慢滴加4-氟苯甲酰氯的DCM溶液,滴加完毕后继续搅拌半小时。反应完成后将反应液分别用水和NaHCO3水溶液洗涤,用DCM(50 mL)萃取,合并有机层,真空浓缩有机相。浓缩物用乙酸乙酯/石油醚(EA/PE)体积比为1∶2重结晶,得到4-氟-N'-(8-喹啉基)苯甲酰肼固体15.95 g,Yield:90.30%,m.p.:160.4~161.3℃。IR:3 258.98,3 321.41,1 655.83,1 230.23 cm-1。1H NMR(400 MHz,DMSO-d6)δ:10.74(d,J=2.8 Hz,1H),8.85(dd,J=4.2,1.7 Hz,1H),8.44(d,J=2.7 Hz,1H),8.31(dd,J=8.4,1.8 Hz,1H),8.10~8.00(m,2H),7.58(dd,J=8.3,4.2 Hz,1H),7.44(d,J=7.9 Hz,1H),7.41~7.30(m,3H),6.99(dd,J=7.5,1.3 Hz,1H)。13C NMR(101 MHz,DMSO-d6)δ:165.42,165.07,162.94,147.83,144.86,137.16,135.99,130.15,130.06,129.32,129.29,128.07,127.22,121.82,117.12,115.58,115.36,107.59。10-6(ppm)。MS(ESI-):m/z279.95([M-H]-,计算值280.09,100%)。
N'-(8-喹啉基)苯甲酰肼(2)。合成时将对氟苯甲酰氯更换成苯甲酰氯,其他合成步骤与化合物1的合成方法一致。Yield:90.20%,m.p.:154.8~155.6℃。IR:3 300.64,3 331.84,1 637.96 cm-1。1H NMR(400 MHz,DMSO-d6)δ:10.72(s,1H),8.86(dd,J=4.2,1.7 Hz,1H),8.44(s,1H),8.31(dd,J=8.4,1.7 Hz,1H),8.02~7.95(m,2H),7.65~7.54(m,2H),7.58~7.49(m,2H),7.43(t,J=7.9 Hz,1H),7.33(dd,J=8.2,1.3 Hz,1H),7.00(dd,J=7.6,1.3Hz,1H)。13C NMR(101 MHz,DMSO-d6)δ:166.07,147.82,144.90,137.18,135.99,132.83,131.71,128.47,128.06,127.39,127.22,121.81,117.09,107.61.10-6(ppm)。MS(ESI-):m/z261.95([M-H]-,计算值262.10,100%)。
甲氧基-N'-(8-喹啉基)苯甲酰肼(3)。合成时将对氟苯甲酰氯更换成4-甲氧基苯甲酰氯,其他合成步骤与化合物1的合成方法一致。Yield:56.00%,m.p.:180.7~182.2℃。IR:3 257.04,3 342.88,1 644.49,1 259.17,1 022.64 cm-1。1H NMR(400 MHz,DMSO-d6)δ:10.58(d,J=3.0 Hz,1H),8.85(dd,J=4.2,1.7 Hz,1H),8.38(d,J=3.2 Hz,1H),8.31(dd,J=8.4,1.7 Hz,1H),8.00~7.92(m,2H),7.57(dd,J=8.3,4.2 Hz,1H),7.42(t,J=7.8 Hz,1H),7.32(dd,J=8.2,1.3 Hz,1H),7.10~7.02(m,2H),6.97(dd,J=7.6,1.3 Hz,1H),3.84(s,3H)。13C NMR(101 MHz,DMSO-d6)δ:165.59,161.98,147.78,145.08,137.18,135.97,129.26,128.05,127.21,124.96,121.78,117.00,113.71,107.60,55.38。10-6(ppm)。MS(ESI-):m/z292.00([M-H]-,计算值292.11,100%)。
2.2.4 喹啉基噁二唑酮化合物4~6的合成
5-(4-氟苯基)-3-(8-喹啉基)-1,3,4,-噁二唑-2-酮(4)。将三光气(3.59 g,12.09 mmol)用10 mL DCM溶解。称取干燥后的4-氟-N'-(8-喹啉基)苯甲 酰肼(10.00 g,35.55 mmol)用20 mL DCM溶解,加入三乙胺(12.59 g,124.43 mmol),在氮气保护下降温至0~10℃,并在该温度下逐滴滴加三光气的THF溶液,滴加完毕后继续搅拌半小时。反应完成后过滤,滤液在40℃下,真空浓缩至干,加入EA搅拌后过滤继续浓缩至干。加入PE后搅拌,过滤得5-(4-氟苯基)-3-(8-喹啉基)-1,3,4,-噁二唑-2-酮固体10.1 g。Yield:90.20%,m.p.:174.4~176.0℃。IR:1 782.11,1 226.29 cm-1。1H NMR(400 MHz,DMSO-d6)δ:8.98(dd,J=4.3,1.7 Hz,1H),8.56(dd,J=8.4,1.7 Hz,1H),8.25(dd,J=8.3,1.4 Hz,1H),8.13(dd,J=7.3,1.4 Hz,1H),8.09~7.93(m,2H),7.81(dd,J=8.3,7.3 Hz,1H),7.69(dd,J=8.3,4.2 Hz,1H),7.51~7.33(m,2H)。13C NMR(101 MHz,DMSO-d6)δ:165.28,162.79,152.44,151.59,142.99,136.61,131.73,130.66,129.44,128.78,128.15,126.28,122.57,120.01,116.64。10-6(ppm)。MS(ESI+):m/z308.00([M+H]+,计算值308.08,100%)。
5-苯基-3-(8-喹啉基)-1,3,4-噁二唑-2-酮(5)。合成时将N'-(8-喹啉基)苯甲酰肼替换4-氟-N'-(8-喹啉基)苯甲酰肼,其他合成步骤与化合物4的合成方法一致。Yield:78.53%,m.p.:140.5~141.5℃。IR:1 783.25 cm-1。1H NMR(400 MHz,DMSO-d6)δ:8.98(dd,J=4.2,1.7 Hz,1H),8.56(dd,J=8.4,1.7 Hz,1H),8.25(dd,J=8.3,1.4 Hz,1H),8.14(dd,J=7.4,1.4 Hz,1H),7.95~7.88(m,2H),7.81(dd,J=8.3,7.4 Hz,1H),7.73~7.66(m,1H),7.66~7.56(m,3H)。13C NMR(101 MHz,DMSOd6)δ:153.15,152.44,151.59,143.02,136.61,131.93,131.77,130.66,129.46,129.38,128.78,126.29,125.44,123.38,122.57。10-6(ppm)。MS(ESI+):m/z290.10([MH]+,计算值290.09,100%)。
5-(4-甲氧基苯基)-3-(8-喹啉基)-1,3,4-噁二唑-2-酮(6)。合成时用4-甲氧基-N'-(8-喹啉基)苯甲酰肼代替4-氟-N'-(8-喹啉基)苯甲酰肼,其他合成步骤与化合物4的合成方法一致。Yield:67.00%,m.p.:200.7~201.1℃。IR:1 784.17,1 181.1,1 126.32 cm-1。1H NMR(400 MHz,DMSO-d6)δ:8.98(dd,J=4.2,1.7 Hz,1H),8.56(dd,J=8.4,1.7 Hz,1H),8.24(dd,J=8.3,1.4 Hz,1H),8.12(dd,J=7.4,1.4 Hz,1H),7.84(dd,J=8.3,6.2 Hz,2H),7.79(d,J=7.8 Hz,1H),7.68(dd,J=8.3,4.2 Hz,1H),7.19~7.11(m,2H),3.86(s,3H)。13CNM R(101 MHz,DMSO-d6)δ:162.00,153.21,152.48,151.55,143.03,136.60,131.89,130.56,129.46,128.77,127.33,126.29,122.55,115.63,114.87,55.50。10-6(ppm)。MS(ESI+):m/z320.05([MH]+,计算值320.10,100%)。
2.3 荧光检测试验
首先研究了化合物1~6的固态发光性能,其次研究了金属阳离子对化合物4~6溶液荧光性能的影响,最后研究了化合物4~6作为荧光探针对Fe3+的检测能力。
(1)溶液的配制:称取化合物4~6溶于THF中,定容配制0.50 g/L(浓度分别为1.60,1.70,1.60 mmol/L)的探针溶液备用。称取适量的各类金属硝酸盐或水合金属硝酸盐溶于20 mL水溶液,再定容至100 mL,配制0.10 mol/L的金属离子水溶液,备用。
(2)荧光探针检测阳离子:用移液枪吸取2 mL探针溶液置于比色皿中,加入40 μL已配制的待测离子的水溶液,测得其荧光发射光谱,检测14种不 同金属离子(K+、Ca2+、Mg2+、Al3+、Mn2+、Fe3+、Co2+、Zn2+、Cu2+、Ni2+、Cd2+、Cr3+、Pb2+、Hg2+)对化合物溶液荧光性能的影响。同一化合物探针测试条件相同,其中化合物4的激发波长359 nm,化合物5的激发波长347 nm,化合物6的激发波长345 nm。
(3)荧光探针识别Fe3+离子:每种探针溶液均用移液枪吸取2 mL置于比色皿中,逐步加入配制好的0.10 mol/L的Fe3+离子溶液,测得其荧光发射光谱,激发波长均为338 nm。
(4)荧光探针识别Fe3+的离子竞争实验:每种探针溶液均用移液枪吸取2 mL置于比色皿中;先分别加入20 μL除Fe3+以外的其他13种金属离子,测得其荧光发射光谱;再继续加入20 μL Fe3+离子溶液,测得混合离子溶液的发射光谱;激发波长均为338 nm。
3 结果与讨论
3.1 热重分析
为了确定所合成的6个化合物的热稳定性,在氮气氛围下对其进行热分解实验,测定的温度范围为25~500℃,升温速率设置为10℃/min,其热失重曲线如图2所示。对于合成的喹啉基酰肼类化合物1~3,其起始分解温度分别为195,200,210℃,并均经历了两个热失重过程;对于合成的喹啉基噁二唑酮衍生物4~6,其分解温度均高于其相应的喹啉基酰肼化合物,大约在300℃时开始分解,且均经历了一个快速的失重过程。热重分析结果表明,所合成的6种化合物都具有较好的热稳定性。
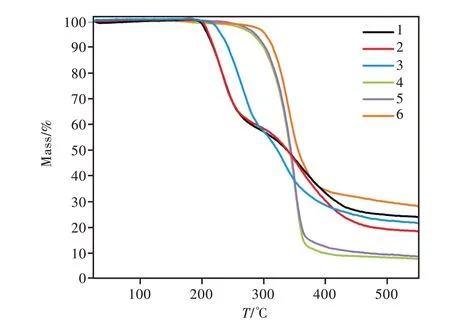
图2 化合物1~6的热重曲线Fig.2 Thermogravimetric curve of compounds 1-6
3.2 固体荧光分析
化合物1~6在320 nm波长激发下,均有很强的荧光发射,其固体粉末荧光光谱如图3所示。化合物1~3的发射峰分别为432,431,429 nm,化合物4~6的发射峰分别为394,390~426,387 nm。相对于8-氨基喹啉(8-aql)459 nm的发射峰[28],化合物1~3发射光谱蓝移了27~20 nm,其主要是由于喹啉的氨基氢被酰胺基团取代导致能隙增大所致。而化合物4~6相比较化合物1~3而言,荧光发射光谱继续蓝移了40 nm左右,且相对于化合物1~3发射光强度明显变弱,这是由于喹啉环和苯环之间成功地引入了噁二唑酮环,破坏了8-氨基喹啉分子的氨基的p-轨道和喹啉环π-轨道共轭性,共轭体系减小,能隙增大,分子的发射光谱继续向短波位移,发射光强度减小。
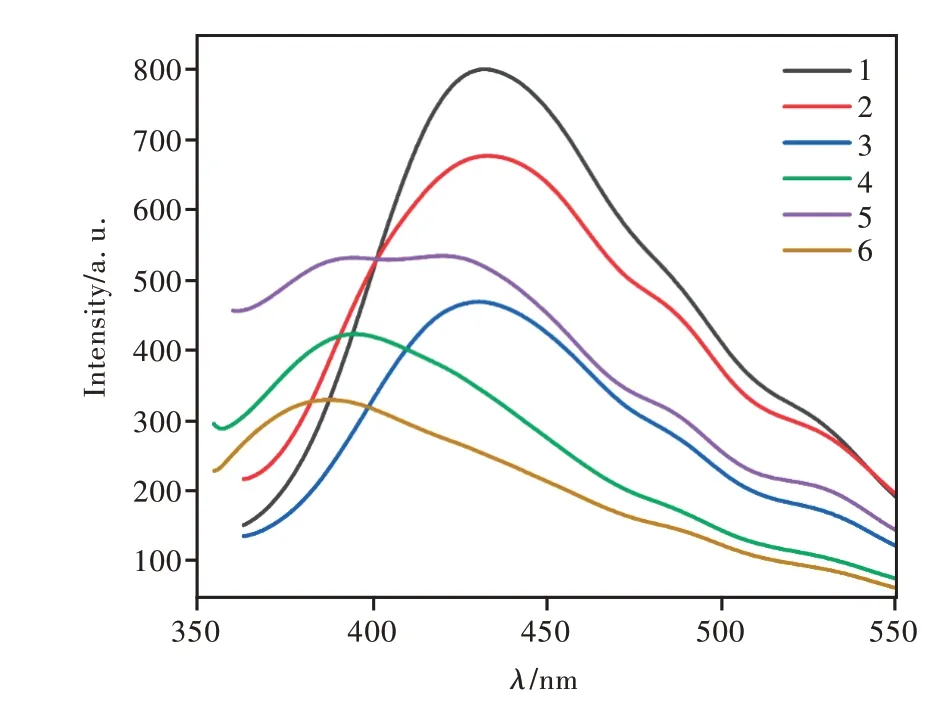
图3 化合物1~6的固体发射光谱Fig.3 The emission spectra of compounds 1-6
为了进一步理解发光和电子跃迁机理,我们利用密度泛函数理论(DFT)和含时密度泛函数理论(TD-DFT)对6个标题化合物进行了理论分析。采用cam-b3lyp密度泛函方法,在6-311g(d,p)基组级别下获得了8-aql和6个化合物的稳定几何构型,其前线分子轨道和能级如图4所示。从图4中可以看出,8-aql和化合物1~3的最低空轨道(LUMO)基本上分布在喹啉环和氨基的氮原子上,而化合物4~6由于存在噁二唑酮环,破坏了氨基氮原子的p-轨道和喹啉环π-轨道的共面性,其LUMO主要分布在喹啉环上,且其LUMO能级降低的幅度比化合物1~3的大。对于最高占有轨道(HOMO),8-aql和化合物1~3较相似,也主要分布在8-aql骨架上,而化合物4~6却分布于整个分子骨架上。相较于8-aql,6个化合物的HOMO的能级也发生了不同程度的降低。从分子轨道分布特征来看,6个标题化合物的HOMO和LUMO均为离域的π-轨道,因此,其具有良好的发光性质,与实验结果一致。从计算的LUMO和HOMO能级差来看,6个标题化合物的能极差大于8-aql,所以其光谱要发生蓝移,这也与上述实验结果一致。另外,在同样方法和基组级别下,计算了S0→S1单电子垂直跃迁,如图4所示。对于8-aql和化合物1~5,S0→S1电子跃迁主要为HOMO→LUMO跃迁,其贡献都在85%以上,而化合物6电子跃迁为HOMO→LUMO(79%)和HOMO-1→LUMO(13%)跃迁。从分子轨道分布来看,化合物1~3的电子跃迁过程为本体跃迁,而化合物4~6为本体跃迁和电荷转移的复合跃迁。从计算的化合物的光学能隙(Eg)14(2),4.13(3),4.37(4),4.36(5),4.27(6)eV)来看,化合物1~6的Eg值均大于8-aql,所以其光谱峰均发生了蓝移,且化合物4~6的Eg大于化合物1~3,所以化合物4~6发射峰蓝移程度更大,计算结果和实验结果一致。

图4 化合物1~6的单电子跃迁图Fig.4 The computed excitation of compounds 1-6
3.3 3种荧光探针分析
3.3.1 对金属离子的选择性识别
基于化合物4~6具有良好的热稳定性和固体荧光性能,我们将其作为荧光探针来检测金属离子。将40 μL 14种常见的无机金属离子水溶液(K+、Ca2+、Mg2+、Al3+、Mn2+、Fe3+、Cu2+、Ni2+、Co2+、Zn2+、Cd2+、Cr3+、Pb2+、Hg2+)分别移入到2 mL含化合物4~6探针的THF溶液中进行荧光识别性能的研究,实验结果如图5所示。
由图5可以看出,除了Fe3+离子,其他金属离子加入时,3种荧光探针的发射波长及强度改变较小;当加入Fe3+时,3种荧光探针均发生荧光猝灭,且发射峰发生红移。这一特征表明,制备的化合物4~6均可以作为检测Fe3+离子的选择性荧光探针。该类型的荧光猝灭可能是由于化合物4~6均属于含芳香环的富电子底物,可以通过供体-受体相互作用很容易地与顺磁性的Fe3+离子结合,共轭体增大,发射峰向长波位移,同时猝灭富电子底物的发光[29-30]。当这种相互作用发生在荧光材料与特定的离子之间时,就会表现出荧光材料对所选离子的检测能力。
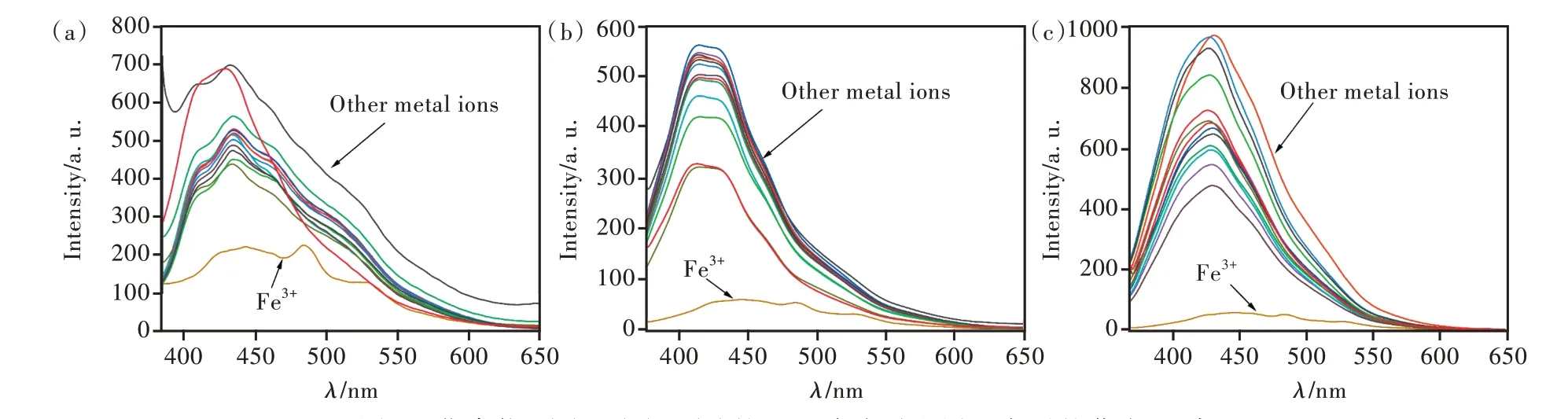
图5 化合物4(a)、5(b)、6(c)的THF溶液对金属阳离子的荧光识别。Fig.5 The metal cation recognition of compounds 4(a),5(b),6(c)in THF.
3.3.2 对Fe3+的滴定实验
上述实验表明,化合物4~6对Fe3+具有非常强的荧光识别能力,为此我们通过改变滴加的Fe3+的量,研究Fe3+浓度对化合物荧光猝灭的影响。如图6所示,随着离子浓度的增加,3种化合物的相对荧光强度快速减弱。由表1可见,当Fe3+浓 度 在2.0×10-5~5.2×10-4mol/L范 围 内时,化合物4的相对荧光强度与离子浓度呈线性 关 系;当Fe3+浓 度 在1.0×10-5~7.6×10-4mol/L范围内时,化合物5的相对荧光强度与离子浓度 呈 线 性 关 系;当Fe3+浓 度 在1.0×10-5~4.0×10-4mol/L范围内时,化合物6的相对荧光强度与离子浓度呈线性关系。同时通过计算还得出了化合物4~6的检出限(LOD)D分别为8.70×10-6,1.64×10-6,1.01×10-6mol/L(D=3S/σ,S为空白标准偏差,σ=Ksv)。
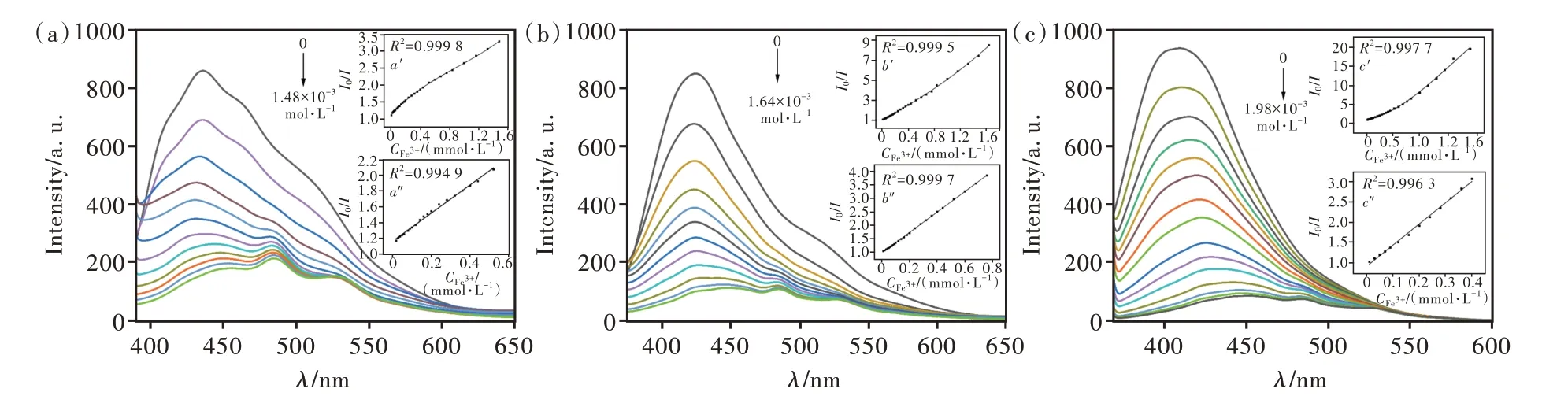
图6 化合物4(a)、5(b)、6(c)随Fe3+浓度增加荧光强度的变化曲线。Fig.6 The fluorescence intensity curve of compounds 4(a),5(b),6(c)with the increase of Fe3+concentration.

表1 化合物4~6的I0/I值与Fe3+浓度的关系Tab.1 The relationship between the I0/I value of the compounds 4-6 and the concentration of Fe3+
3.3.3 共存离子对Fe3+荧光识别的影响
在实际的生物和环境系统中,被检测样品常常是多离子共存,所以探针的高选择性是评价其性能的一个非常重要的特征,为此我们研究了一些常见离子(K+、Ca2+、Mg2+、Al3+、Mn2+、Co2+、Zn2+、Cu2+、Ni2+、Cd2+、Cr3+、Pb2+、Hg2+)的存在对化合物4~6检测Fe3+的影响(图7)。如图7所示,加入等量的Fe3+和其他金属离子的化合物的溶液,与未加Fe3+的相比,其荧光强度显著下降。这表明,该3种探针在共存离子存在下对Fe3+均具有较高的选择性,为其进一步应用提供了可能。

图7 化合物4~6对Fe3+的离子干扰柱状图Fig.7 Ionic interference histograms of compounds 4-6 with Fe3+ion
4 结 论
本文以8-氨基喹啉为起始原料设计合成了喹啉基酰肼、喹啉基噁二唑酮等6种新的化合物;通过红外光谱、核磁共振谱和质谱对结构进行表征;通过热重和荧光光谱对性质进行了分析;通过理论计算对目标化合物发光原理进行了探讨。6种化合物均具有良好的热稳定性和固体荧光性能,可作为潜在的荧光材料。其中利用3种噁二唑酮类化合物作为荧光探针对14种常见金属离子进行了识别,结果表明,3种探针对Fe3+均具有较强的荧光识别性能和良好的灵敏度;且离子干扰实验结果表明,探针抗金属离子干扰能力较强,可快速、高效地检测环境中的微量Fe3+。
本文专家审稿意见及作者回复内容的下载地址:http://cjl.lightpublishing.cn/thesisDetails#10.37188/CJL.20220145.

