川芎嗪通过调控NRF2/HO-1途径抑制高糖诱导的中性粒细胞外捕获网形成
陈金泉,赵 龙,丁渲恒,王令达,文 艳,谢 昊,彭 惠
400016 重庆,重庆医科大学附属第一医院眼科,眼科学重庆市市级重点实验室,重庆市眼科研究所
糖尿病性视网膜病(diabetic retinopathy,DR)是糖尿病患者眼部的并发症,同时也是导致患者失明的主要原因[1-2]。研究表明,血糖升高会导致视网膜微血管损伤,从而使得血视网膜屏障(blood-retinal barrier, BRB)破裂、视网膜内出血[3-4]。
中性粒细胞是血液中最丰富的免疫细胞,在先天免疫系统中发挥着重要作用,是细胞防御第一道防线[5]。中性粒细胞受到刺激后,会释放中性粒细胞外捕获网(neutrophil extracellular traps, NETs)来清除病原体。释放NETs的过程被称为NETosis[6-7]。NETosis是中性粒细胞特有的细胞死亡形式,其形态学特征是核膜与胞质颗粒膜溶解,染色质与胞质内颗粒组合,核膜破裂,随后释放至细胞外的网状结构,这个结构称为NETs[8]。NETs是由解旋染色质和多种蛋白组成,其中包括髓过氧化物酶(myeloperoxidase, MPO)、中性粒细胞弹性蛋白酶(neutrophil elastase, NE)、蛋白酶3 (proteinase 3, PR3)、LL37和4种组蛋白[9]。目前缺乏对NETs直接定量的方法。既往研究中使用免疫荧光观察NETs的形态,然后检测培养基中NETs的标志性蛋白和dsDNA来间接评估NETs的含量[10]。虽然NETs的产生有利于应对病原体的入侵,但过量的NETs会导致一系列的自身免疫性疾病[11]。研究表明,NETs会导致新生血管形成,并且NETs还参与了干眼症、葡萄膜炎等疾病[12]。DR患者在使用anti-VEGF治疗后,玻璃体中的NETs含量下降。提示NETs参与了DR的发病[13]。
研究表明,传统中草药川芎的有效成分川芎嗪(tetramethylpyrazine, TMP)具有较强的抗炎能力[14]。TMP因具有抗氧化、抗炎作用,被推荐用于治疗各种视网膜病[15]。TMP可以通过MAPK通路改善IL-1β诱导的血视网膜屏障破坏[16]。然而TMP对DR患者视网膜保护作用的分子机制尚不清楚。本研究进一步探讨TMP对中性粒细胞产生NETs的影响,为阐述TMP对DR患者的保护作用提供理论依据。
1 材料与方法
1.1 实验材料
1.1.1 实验细胞 2021年3月至2022年3月,从本院眼科实验室选取5位健康受试者,各抽取10 mL外周血用以提取中性粒细胞。本研究获得患者知情同意,并获得重庆医科大学附属第一医院伦理委员会审批(审查批号:2021-711)。
1.1.2 主要试剂与仪器 中性粒细胞分离试剂盒购于中国TBD公司;高糖培养基、低糖培养基购于美国Gibco公司;CCK-8试剂购于美国Bryotime公司;细胞计数板购于上海睿钰生物科技有限公司;Pico-Green Kit购于美国Sigma公司;人MPO-DNA复合物酶联反应试剂盒购于中国酶科公司;TMP、ML385购于美国陶素生物公司;特性抗体HO-1、NRF2、β-actin购于中国Affinity公司;特异性抗体H3-cit购于美国Abcam公司;DHE和DCFH-DA试剂购于中国碧云天公司;DPI购于美国MCE公司。
1.2 方法
1.2.1 分离人中性粒细胞 取中性粒细胞分离液4 mL于离心管中,然后使用滴管将人外周血小心加入离心管中离心(600×g,25 min,21 ℃)。离心结束后,小心吸取试管中的中性粒细胞于另一支试管。使用PBS洗涤细胞,21 ℃,1 050 r/min,离心5 min。使用红细胞裂解液去除残余的红细胞。使用低糖培养基1 mL重悬,台盼蓝检测活细胞比例。
1.2.2 CCK-8测定中性粒细胞活性 将中性粒细胞(104/孔)接种在96孔板中,加入低糖培养液置于37 ℃孵箱。培养30 min后,加入CCK-8试剂10 μL,随后加入0、5、10、20、40、80 μmol/L的TMP处理中性粒细胞4 h,使用多功能酶标仪测量波长450 nm处光密度值[D(450)],实验重复3~4次。
1.2.3 主要试剂及细胞处理方法 TMP处理方法:取1 mg的TMP粉末溶解于730 μL的DMSO中,配置为10 mmol/L终浓度的TMP原液,培养基稀释至所需浓度。NADPH氧化酶(NOX)抑制剂DPI处理方法:取1 mg的DPI粉末溶解于317 μL的DMSO中,配置为10 mmol/L终浓度的DPI原液,届时使用培养基稀释至所需浓度。NRF2抑制剂ML385处理方法:取1 mg的ML385粉末溶解于100 μL的DMSO中,配置为20 mmol/L终浓度的ML385原液,届时使用培养基稀释至所需浓度。TMP、DPI与高糖(high glucose,HG)同时处理中性粒细胞。ML385预先处理中性粒细胞30 min后,再加入TMP与HG。
1.2.4 中性粒细胞分组 将中性粒细胞分为: Control组(1.5 g/L葡萄糖),TMP组(40 μmol/L TMP), HG组(4.5 g/L葡萄糖),HG+TMP组(40 μmol/L TMP+4.5 g/L葡萄糖),HG+TMP+ML385组(4.5 g/L葡萄糖+40 μmol/L TMP+10 μmol/L ML385),HG+ML385组(4.5 g/L葡萄糖+10 μmol/L ML385),HG+DPI组(4.5 g/L葡萄糖+10 μmol/L DPI)。
1.2.5 Western blot检测 中性粒细胞总蛋白使用蛋白提取液(RIPA∶PMSF=100∶1)提取,离心12 000 r/min,15 min,4 ℃。吸取上清液,随后向上清液中加入蛋白上样缓冲液。最后将EP管放入沸水中5 min, -20 ℃保存。电泳时,每个样品的蛋白量保持一致(30~50 μg),使用12%、15% SDS-PAGE凝胶分离蛋白,电转至PVDF膜上。随后将PVDF膜用5%脱脂牛奶封闭1 h,加入H3-cit (1∶1 000)、HO-1 (1∶1 000)、NRF2(1∶1 000)、β-actin (1∶1 000)、NOX2 (1∶1 000)的特异性一抗,4 ℃孵育12~16 h。然后将条带洗涤3次,加入相应的二抗(1∶10 000),37 ℃孵育2 h。条带蛋白信号使用ECL试剂盒检测,Image J分析条带密度。使用内源对照β-actin将数据标准化,重复实验3次。
1.2.6 细胞内ROS和超氧化物阴离子检测 将分离出来的人中性粒细胞重悬在1 mL低糖培养基中,向培养基中分别加入DCFH-DA、DHE试剂1 μL,将试管放入孵箱中,孵育30 min后,使用低糖培养基洗去残余的探针并计数,向96孔板中加入中性粒细胞(105/孔)。设置相应培养基作为空白孔,于孵箱中培养4 h。DCFH-DA以488 nm激发波长,525 nm发射波长,使用多功能酶标仪检测荧光强度。DHE以535 nm激发波长,以610 nm发射波长,使用多功能酶标仪检测荧光强度。
1.2.7 免疫荧光检测H3-cit的表达 将中性粒细胞接种在多聚赖氨酸处理过的细胞爬片上,按照分组处理,并于孵箱中孵育4 h,然后取出细胞爬片,使用4%的多聚甲醛固定细胞15 min。PBS洗涤3次,使用0.1% Triton X-100作用5 min穿透细胞膜,再次洗涤3次,使用5%山羊血清封闭细胞爬片1 h,随后加入H3-cit(1∶100) 特异性一抗混合液在4 ℃孵育过夜。PBS洗涤3次后,将细胞用DAPI染色15 min,并洗涤3次。使用荧光显微镜观察所有荧光图像,照相并保存。
1.2.8 Pico-Green试剂盒检测培养基中的dsDNA含量 将中性粒细胞(1×106)接种在24孔板中,按照细胞分组,处理4 h后,收集24孔板中的培养基于EP管中,保存在-80 ℃。然后将DNA标准品加入黑色酶标板中,并设置复孔和空白孔。加入待测培养基50 μL于黑色酶标板中,将Pico-green探针试剂以1∶200稀释后,50 μL加入到每孔中,室温静置5 min。多功能酶标仪检测在485 nm激发波长、535 nm发射波长检测荧光强度,并带入标准曲线计算。
1.2.9 MPO-DNA复合物酶联反应试剂盒 将中性粒细胞(1×106)接种在24孔板中,按照细胞分组,处理4 h后,收集24孔板中的培养基于EP管中,保存在-80 ℃。然后使用双蒸水配置洗涤液(1∶20),配置MPO-DNA标准品,浓度分别为1 000、500、250、125、62.5、31.25 pg/mL,每个浓度设置1个复孔,并设置空白孔。加入标准品和待测样本,100 μL/孔。室温孵育2 h。弃去孔中液体,洗涤液洗板3次,拍干酶标板。加入预先配置好的工作液,室温孵育1 h,洗涤液洗板3次,拍干酶标板。加入预先配置的显色剂100 μL/孔,避光室温孵育30 min,加入终止液100 μL/孔,混匀后,测量D(450)值,带入标准曲线计算浓度。
1.3 统计学分析
使用GraphPad Prism 5.0分析,多组数据采用单因素方差分析,单组数据采用独立样本t检验分析。检验水准: α=0.05。
2 结果
2.1 TMP诱导中性粒细胞NRF2/HO-1通路激活
CCK-8检测结果显示,中性粒细胞在不同浓度TMP处理后,40 μmol/L TMP处理后的中性粒细胞活性与Control组无明显差异; 80 μmol/L TMP处理后,中性粒细胞活性下降(P<0.01,图1A)。Western blot检测结果显示,TMP(40 μmol/L)组细胞内NRF2、HO-1蛋白表达量显著升高(P<0.01,图1B)。以上结果说明TMP可以诱导中性粒细胞内NRF2和HO-1升高。
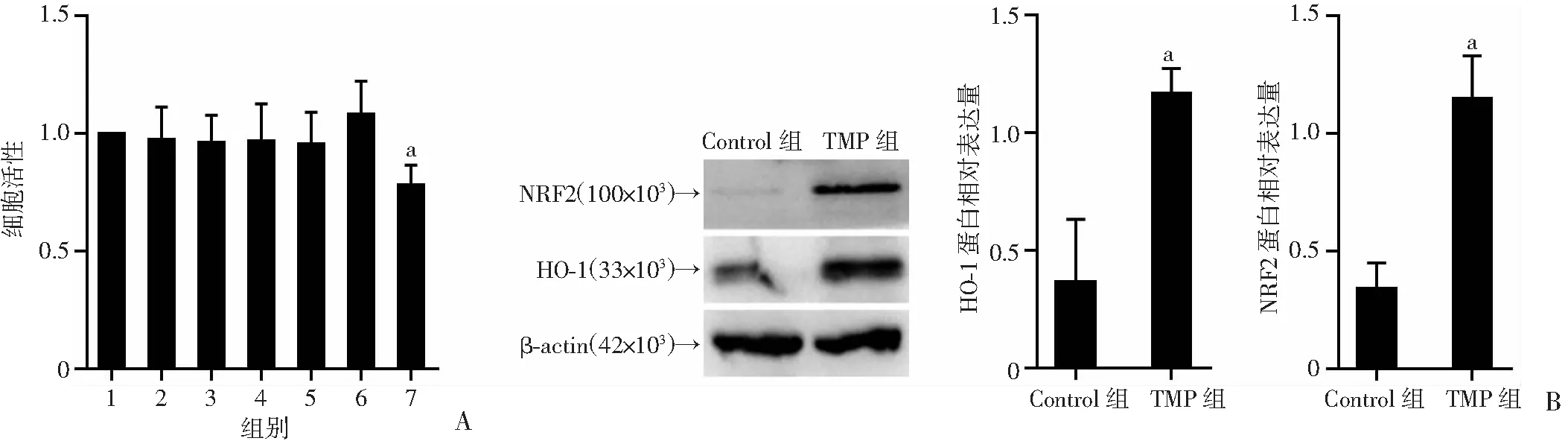
a:P<0.01,与Control组比较
2.2 TMP抑制高糖诱导的NETs形成
Pico-Green检测结果显示,HG组中性粒细胞培养基中dsDNA的表达升高,5、10 μmol/L TMP无法逆转其升高;而20 μmol/L可逆转其升高(P<0.05),40 μmol/L TMP可显著逆转其升高(P<0.01,图2A)。免疫荧光结果显示,HG组可以观察到DNA网状结构及其上附着的H3-cit, 而TMP(40 μmol/L)组和HG+TMP组均未观察到NETs的形成(图2B)。Western blot检测结果显示,与Control组相比,HG组中性粒细胞 H3-cit表达显著升高,TMP组差异无统计学意义;与HG组相比,HG+TMP组H3-cit表达下降(P<0.05,图2C)。ELISA和Pico-Green检测结果显示,与Control组相比,HG组MPO-DNA和dsDNA含量显著升高(P<0.01),TMP组无显著差异;与HG组相比,HG+TMP组MPO-DNA和dsDNA含量显著下降 (P<0.01,图2D、E)。结果表明TMP可以抑制高糖诱导中性粒细胞形成NETs。
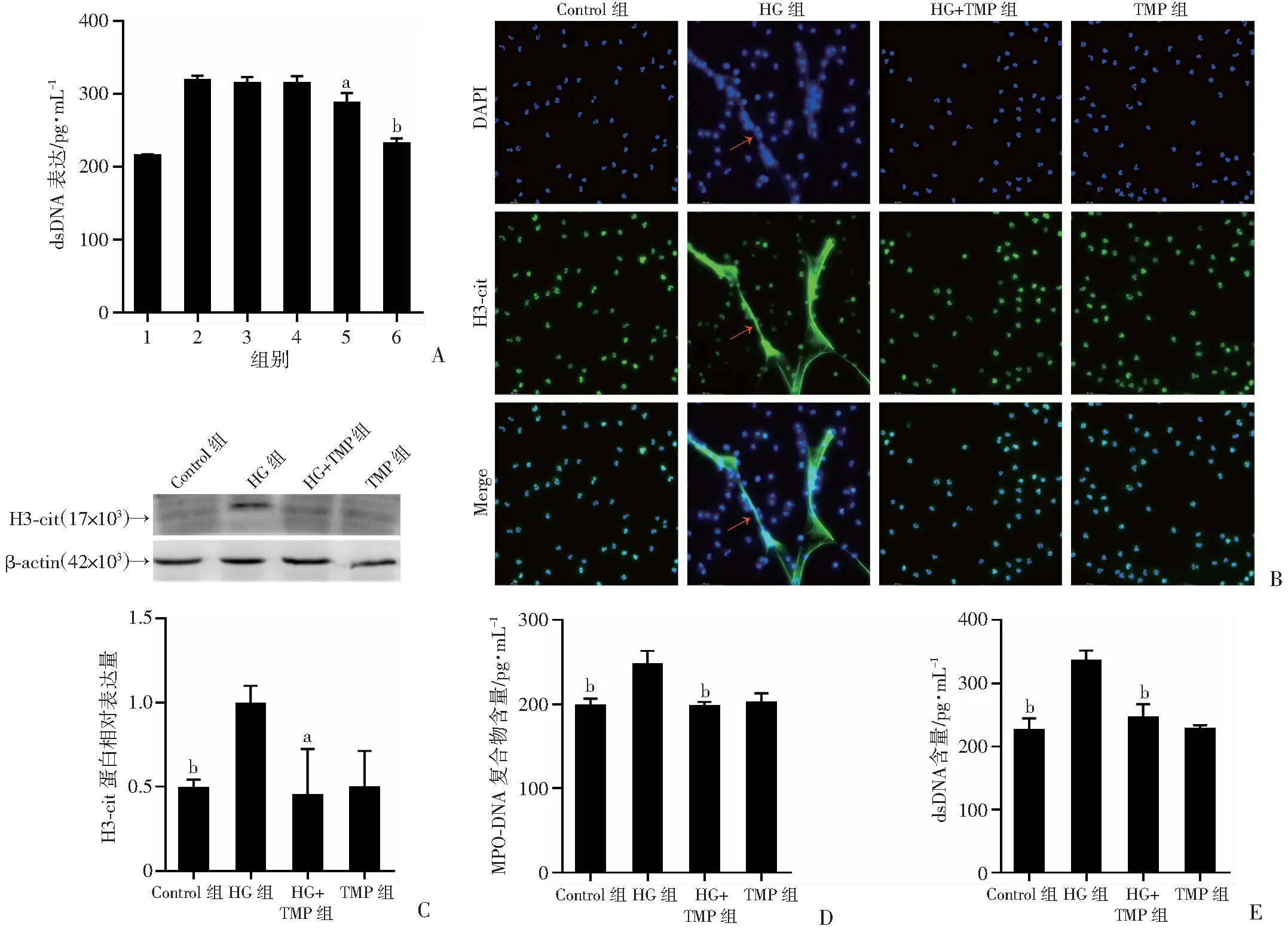
a: P<0.05, b: P<0.01,与HG组比较
2.3 TMP对中性粒细胞内活性氧和超氧化物阴离子的影响
Western blot结果显示,与HG组相比,HG+TMP组、HG+DPI组NOX2蛋白表达明显下降(P<0.05,图3A)。免疫荧光显示,HG组可观察到DNA网状结构及其上附着的H3-cit,HG+TMP组和HG+DPI组未观察到DNA网状结构(图3B)。DHE和DCFH-DA结果显示,与Control组相比,HG组细胞内超氧化物阴离子和ROS显著升高(P<0.01);与HG组相比,HG+TMP组、HG+DPI组超氧化物阴离子和ROS显著下降(P<0.01,图3C、D)。上述结果表明,TMP可通过抑制NADPH氧化酶从而抑制NETs的形成。

a: P<0.05,b: P<0.01,与HG组比较
2.4 TMP通过升高NRF2和HO-1抑制NETs生成
Western blot结果显示,与HG+TMP组相比,HG组、HG+TMP+ML385组、HG+ML385组中性粒细胞H3-cit表达显著升高(P<0.01),NRF2、HO-1表达量显著降低(P<0.01,图4A)。免疫荧光观察显示,HG组、HG+TMP+ML385组、HG+ML385组可观察到DNA网状结构及其上附着的H3-cit,HG+TMP组未观察到DNA网状结构(图4B)。ELISA和Pico-Green结果显示: 与HG+TMP组相比,HG组、HG+TMP+ML385组、HG+ML385组MPO-DNA和dsDNA含量升高(P<0.01,图4C、D)。DHE和DCFH-DA检测显示:与HG+TMP组相比,HG组、HG+TMP+ML385组、HG+ML385组中性粒细胞内超氧化物阴离子和ROS的表达显著升高(P<0.01,图4E、F)。以上结果表明TMP可能通过升高NRF2和HO-1的表达来抑制高糖诱导的中性粒细胞产生NETs。
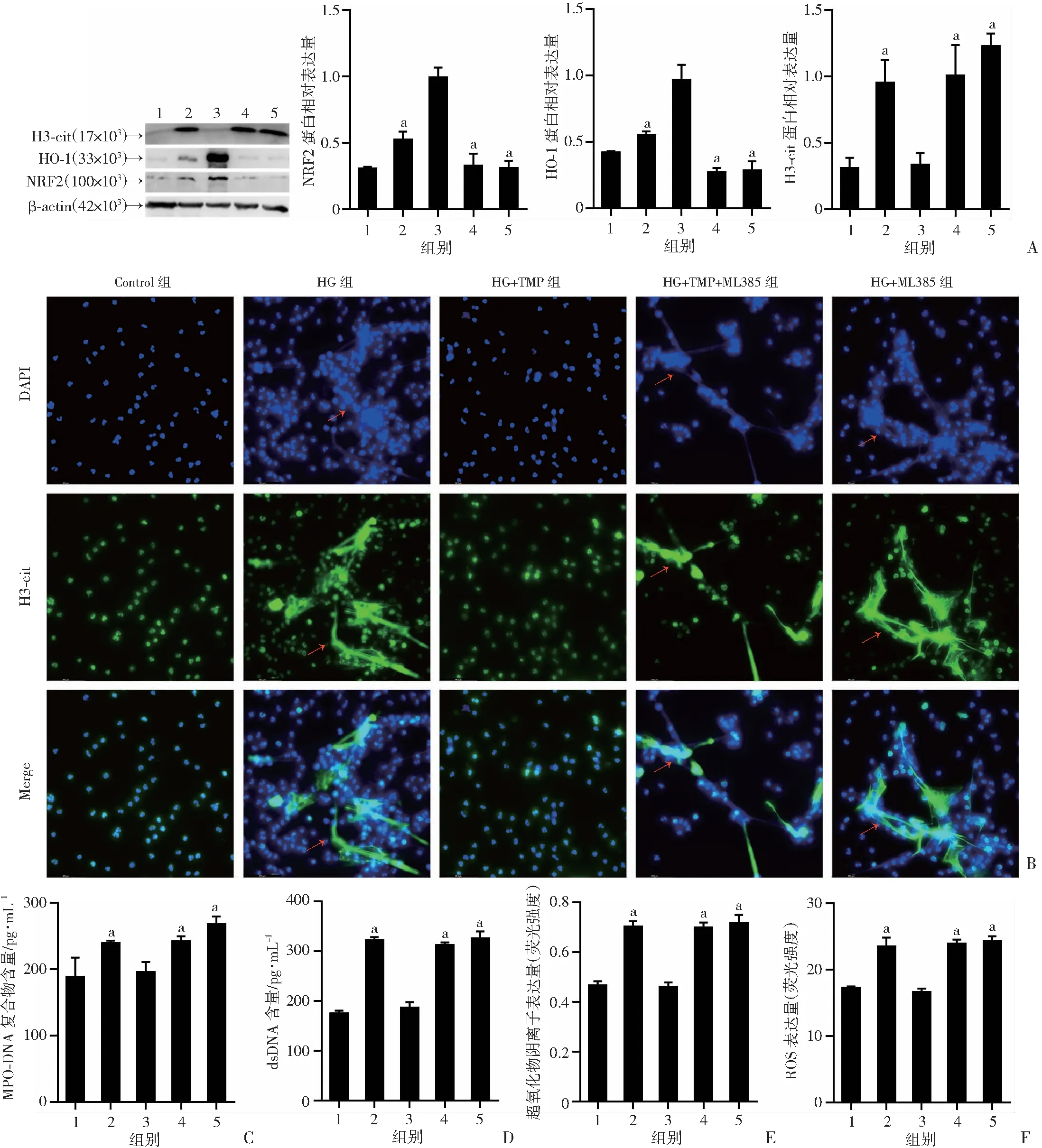
1:Control组;2:HG组;3:HG+TMP组;4:HG+TMP+ML385组;5:HG+ML385组;a: P<0.01,与HG+TMP组比较
3 讨论
糖尿病患病率在我国逐年升高,糖尿病患者体内持续高糖是诱导糖尿病视网膜病变的重要原因之一,而氧化应激、细胞凋亡等因素可以促进糖尿病性视网膜病的发生、发展[17]。目前的治疗方案是以激光光凝和玻璃体腔注射抗VEGF药物为主,但取得的治疗效果欠佳,所以亟需一种新的治疗方法和靶点。
NETs的形成是中性粒细胞应对病原体入侵的手段之一[18]。NETs的形成主要依赖于Raf/Merk/ERK信号通路和NOX依赖途径[19]。以往的研究报道发现NETs结构上所附着的抗菌组蛋白、MPO、蛋白酶可导致内皮细胞功能失调,从而诱发一系列的自身免疫和血管炎症并伴随中性粒细胞胞浆抗体产生(ANCAs)[20]。因此,合理应对NETs的形成可能成为慢性炎症潜在的治疗靶点。以往研究发现在糖尿病视网膜病患者血清及糖尿病视网膜病大鼠模型血清中发现NETs的表达升高,并且通过玻璃体腔抗VEGF处理后,发现大鼠模型玻璃体中NETs的含量下降。这些结果说明NETs参与了糖尿病性视网膜病的发生、发展[13]。
TMP是川芎的有效成分,其具有广泛的药理学活性,在临床上应用广泛。以往的研究表明TMP对IL-1β诱导视网膜神经节细胞损伤具有保护作用[21]。并且有研究发现,TMP可以抑制肝移植大鼠血清中NETs的形成从而减轻肝移植后的氧化应激损伤[22]。因此探讨TMP对高糖诱导的NETs的影响,来探究TMP是否有潜力作为糖尿病视网膜病辅助治疗的药物。
研究报道,HO-1参与iNOS和NO的调控,正常生理条件下,HO-1表达相对较低,而在受到外来刺激时表达量升高[14]。HO-1可以保护细胞免受ROS的影响。而HO-1主要受到E2相关因子2 (NRF2)的调控,所以NRF2/HO-1可以抑制炎症和抗氧化应激反应[23]。本研究结果发现适宜浓度的TMP处理可以上调中性粒细胞内NRF2/HO-1的表达,并且使用TMP处理的中性粒细胞在受到高糖刺激下无法形成NETs。同时发现在高糖诱导下,中性粒细胞内ROS升高,而使用TMP处理后中性粒细胞内ROS下降。
超过细胞调节能力的ROS升高和调节细胞ROS水平的酶活性会导致细胞氧化应激。过量的ROS诱导中性粒细胞内线粒体膜电位的变化从而诱导中性粒细胞释放NETs。当ROS超载时,NRF2作为主要的抗氧化控制器,可以通过调节多种抗氧化酶的表达从而发挥抗氧化保护作用[24]。本研究表明在高糖刺激下,中性粒细胞内NRF2和HO-1表达升高,但高糖刺激下的ROS产生超过细胞自我调节能力,无法抑制NETs产生。使用TMP处理后,中性粒细胞内NRF2和HO-1表达升高,并且能够有效抑制NETs的形成。使用NRF2抑制剂可以有效抑制TMP对中性粒细胞的保护作用。由此我们推断TMP可能通过NRF2/HO-1途径产生抗氧化应激的作用。
综上所述,本研究结果表明,高糖可诱发中性粒细胞氧化应激,并诱导NETs的形成,适宜浓度的TMP处理可以通过上调NRF2/HO-1通路抑制中性粒细胞形成NETs。推测TMP可能激活NRF2/HO-1途径参与到高糖诱导的氧化应激反应,从而对糖尿病性视网膜病的发生、发展提供保护作用。然而,以上结果仍需要体内实验进一步论证。本研究有助于了解TMP在中性粒细胞氧化应激损伤中的保护作用,为糖尿病性视网膜病的治疗提供潜在靶点。