PCA-TTC显色法测定工业循环水中异养菌的实验研究
娄红杰
(国能榆林化工有限公司,陕西 神木 719300)
异养菌是一种利用环境中的有机物进行氧化发酵得到细胞所需的营养物质的菌种[1]。在工业循环冷却水中,以异养菌的生长繁殖最快,数量也最多,它基本上代表了水中全部细菌的数量[2]。可以说是在循环冷却水中具有指示性和代表性的细菌种类,这类细菌能产生致密的黏液,粘附水中细小的悬浮物及其他丝状菌、霉菌、藻类和原生动物等,从而形成黏泥,堵塞管道、腐蚀设备、影响换热效率[3-4]。因此,准确测定循环水中异养菌含量对于控制微生物危害具有重要意义。我国工业循环冷却水处理设计规范[5]要求异养菌监控指标小于等于1×105CFU/mL,通过对其监测可以了解微生物危害的总趋势。
目前,国内循环冷却水系统中异养菌的检测方法,多采用标准平皿计数法[6-7],即将待测水样用10倍稀释法稀释至需要的稀释度,用吸量管将不同稀释度试样1 mL分别接种到无菌培养皿中,将冷却至(45±1)℃灭菌后的营养琼脂培养基(以下简称NA,基本组成为蛋白胨1%,牛肉膏0.3%,氯化钠0.5%,琼脂1.5%~2.0%)10~15 mL灌入培养皿内,混合均匀;待固化后置于(29±1)℃生化培养箱中培养72 h,培养期满后按照计数方法进行计数。但此方法主要存在两方面问题[8],一是由于有些菌落微小或菌落蔓延,菌落与NA的反差不明显(都呈现黄色),培养皿内出现气泡,肉眼或放大镜难于识别和计数的情况,易导致人为读数误差。二是此法所得的菌落数可能要低于其正常存活的活细胞的数目,检出率低,检测准确度有待提高。
平板计数培养基(以下简称PCA,基本组成为胰蛋白胨0.5%,酵母浸粉0.25%,葡萄糖0.1%,琼脂1.5%)是国际公认的菌落计数培养基,此种培养基不但不会损害水中的微生物细胞,还能够修复受损细胞并在不影响细菌本身的情况下促进其生长繁殖。笔者通过用PCA替代NA,并在PCA中加入2,3,5-氯化三苯基四氮唑(又名红四氮唑,以下简称TTC),使细菌菌落长成红颜色,易于辨别,建立PCA-TTC显色法测定水中异养菌含量,为循环冷却水水质监控提供可靠依据。
1 实验部分
1.1 主要仪器与试剂
密里博纯水机:Milli-Q Advantage A10型,法国密理博公司。
超净工作台:含紫外灯,GAT-2DC型,济南格艾特公司。
高压蒸汽灭菌器;WAC-47型,韩国大韩公司。
生化培养箱:(0~50)℃±1℃,LRH-150F型,上海天呈有限公司。
电热鼓风干燥箱:温度可控制在(60~280)℃±2℃,上海博迅医疗生物仪器股份有限公司。
自动菌落计数器:icount 30型,杭州迅数有限公司。
电子分析天平:MSA224S-1CE-DU型,感量0.1 mg,德国赛多利斯公司。
2,3,5 -氯化三苯基四氮唑(TTC):又名红四氮唑,分析纯,上海麦瑞尔化学技术有限公司。
市售平板计数琼脂(PCA):生化试剂,北京奥博星生物技术有限责任公司。
浓盐酸:分析纯,ρ=1.19 g/mL,北京化工厂。
氯化钠:分析纯,天津北联精细化学品开发有限公司。
硫代硫酸钠:分析纯,天津北联精细化学品开发有限公司。将适量的硫代硫酸钠放入超净工作台内,并均匀地摊在离紫外灯30 cm处,灭菌30 min。脱除水样中的余氯用。
医用乙醇:75%(体积分数),天津风船化学试剂科技有限公司。
牛皮纸:衡水凯盛源医疗器械有限公司。
医用脱脂棉:衡水凯盛源医疗器械有限公司。
医用脱脂纱布:衡水凯盛源医疗器械有限公司。
玻璃培养皿:d 90 mm,(160±2)℃灭菌2 h,四川蜀玻(集团)有限责任公司。
刻度吸管:1 mL,5 mL,10 mL。(160±2)℃灭菌2 h。天津市天玻玻璃仪器有限公司。
试管:做盐水管用,d 20 mm×200 mm,四川蜀玻(集团)有限责任公司。
磨口试剂瓶:500 mL,天津市天玻玻璃仪器有限公司。做采样瓶用,将洗净并烘干后的500 mL磨口试剂瓶瓶口和瓶颈用牛皮纸包好,扎紧,置电热干燥箱中,于(160±2)℃灭菌2 h。
搪瓷量杯:1 000 mL,广西南宁融仪实验仪器有限公司。
锥形瓶:250 mL,500 mL,1 000 mL。天津市天玻玻璃仪器有限公司。
试验用水为超纯水,由纯水机直接制备。
1.2 溶液配制
TTC水溶液(质量分数):0.5%,1.0%,2.0%。分别称取0.5、1.0、2.0 gTTC,溶解于100 mL无菌水中,放于无菌棕色试剂瓶中,置于冰箱备用;
PCA-TTC培养基:称取PCA琼脂23.5 g,加入纯水约950 mL,搅拌加热煮沸至完全溶解,趁热用医用脱脂棉和脱脂纱布过滤于搪瓷量杯中,用热水补充至1 000 mL,用氢氧化钠溶液调节pH 7.2~7.4,然后加入一定浓度的TTC水溶液1 mL,混匀,(121±1)℃高压灭菌15 min,备用。
生理盐水:0.85%,称取8.5 g氯化钠,溶解在1 000 mL水中。
无菌稀释水:将生理盐水分装在试管中,每管9 mL,塞上棉塞,用牛皮纸把试管口包好,(121±1)℃高压灭菌15 min,备用。
氢氧化钠溶液:40 g/L,称取40 g氢氧化钠,溶于1 000 mL水中。
1.3 实验方法
1.3.1 不同TTC浓度下PCA培养基的制备
配制5 000 mL的PCA琼脂,并分成9份(3×100 mL、3×500 mL、3×1 000 mL),然后按照正交试验表分别对应加入0.5%、1.0%、2.0%的TTC水溶液各1 mL,混匀,制备成不同TTC浓度下的PCA-TTC培养基,并分装在不同锥形瓶中,塞上棉塞,用牛皮纸把瓶口包好,(121±1)℃高压灭菌15 min,备用。
1.3.2 样品选取
某煤制烯烃企业循环冷却水系统一循氧化型杀生剂连续投加的是三氯异氰尿酸+次氯酸钠,非氧化型杀生剂冲击投加的是异噻唑啉酮CW-8803。二循氧化型杀生剂连续投加的是活性溴(JH-714),非氧化型杀生剂冲击投加的是异噻唑啉酮CW-8803和有机胍类,交替投加。选取一循和二循水样进行试验。
1.3.3 样品测试
将待测试样(硫代硫酸钠脱氯后的)放入超净工作台中,无菌操作,用10倍稀释法稀释至需要的稀释度,用无菌吸量管将不同稀释度试样分别接种到无菌培养皿中,每个稀释度重复接种2个皿,每皿接种1 mL,每接种一个稀释度更换一支无菌吸管。将冷却至(45±1)℃灭菌后的PCA-TTC培养基10~15 mL灌入培养皿内,混合均匀。待固化后置于(29±1)℃生化培养箱中培养相应的时间,培养期满后按照计数方法进行计数,同时做空白对照。
2 结果与讨论
2.1 TTC最适浓度的选择
TTC是一种化学试剂,无色的TTC作为氢的受体,在细菌脱氢酶作用下,还原后成为红色的三苯基甲月替,使菌落呈红色[9],培养基与菌落颜色反差明显,能有效去除本底颗粒物、气泡等干扰。因此常用于食品[10-11]、化妆品[12]、水[13]中等菌落显色中。其不耐热,一般与培养基使用时,都是用“过滤除菌”的方法来灭菌。TTC同时也具有抑菌性[14],笔者利用其不耐热的性质,采用高温高压灭菌,并结合TTC水溶液适宜浓度,达到既能降低TTC抑菌性能又能显色的目的。
考察因素A PCA用量(L)、因素B TTC水溶液浓度(%)、因素C培养时间(d)三个主要因素,根据3因素3水平,设计不交互正交试验[15]L9(34),结果见表1。
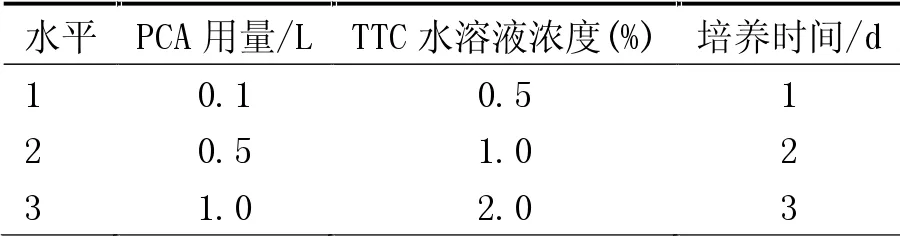
表1 正交试验因素水平
按1.3实验方法分别对表1中各因素水平进行测定,正交试验显色和计数结果见表2。其中试样为一循+二循的混合水样,每个稀释度分别接种2个皿,培养基为经过(121±1)℃高压灭菌后的PCA-TTC培养基。混合水样于NA平皿计数法异养菌测定结果为9.6×103CFU/mL。
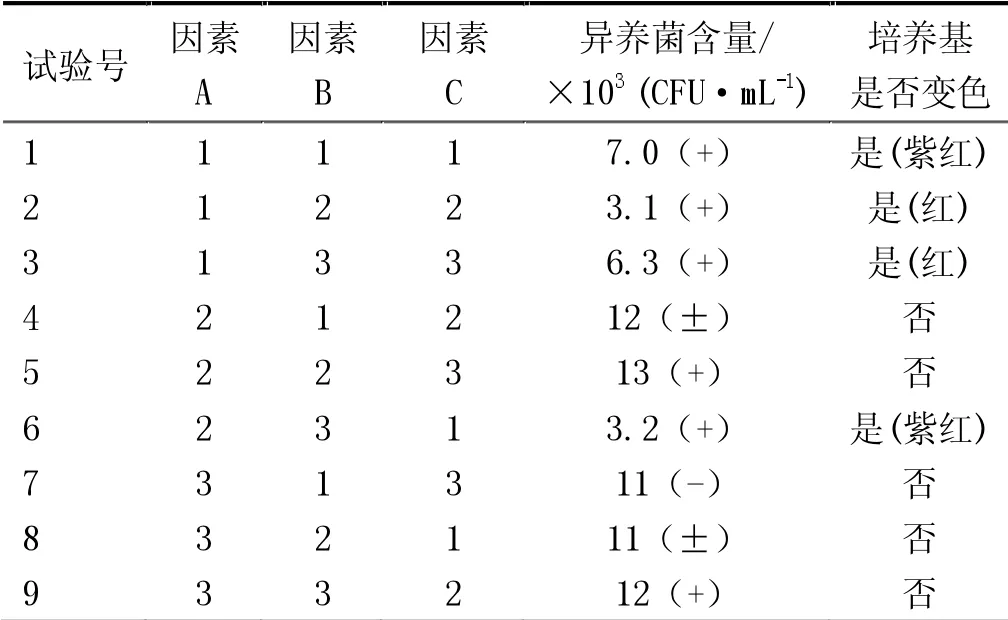
表2 正交试验显色和计数结果
正交试验结果采用数据直观分析[16],并结合菌落生长颜色和PCA-TTC培养基经过高温高压灭菌后是否变色,寻找最佳因子组合,确定优方案,选择TTC最适浓度。
从表2可以看出,各因素极差RA>RC>RB,所以各因素的从主到次的顺序为A,C,B。不同浓度的TTC水溶液1 mL加入到PCA琼脂中,制备的PCA-TTC培养基经高温高压灭菌后,有4种培养基变成紫红或红色,培养基变色不可取。首选不变色的培养基,在其余5种不变色的培养基中,再优选生长成红色菌落所对应的培养基,易于识别。二次筛选后,只有A2B2C3和A3B3C2两种方案菌落颜色为红色。2种方案对应的培养基中的B/A值均为0.002%(相当于2%的TTC水溶液1 mL加入到1 000 mL培养基中或1%的TTC水溶液1 mL加入到500 mL培养基中)。A2B2C3和A3B3C2 2种方案的PCA-TTC显色法,异养菌总数测定结果分别为1.3×104CFU/mL(3 d)和1.2×104CFU/mL(2 d),经t值检验,虽然都与传统NA平皿计数法测定结果9.6×103CFU/mL(3 d)无显著差异,但均高于NA平皿计数法测定结果,说明PCA-TTC显色法能对受损细菌恢复并进行有效促进,便于菌落生长、识别和计数。
考虑到不同因素对异养菌含量的影响程度,通过综合平衡法确定优方案,具体平衡过程如下。
因素A和B:对异养菌含量来说,B/A值(TTC显色剂在培养基中的浓度)不可过小也不可过大。结合颜色,本着提高工效原则,所以取B2/A2或B3/A3为最佳水平。
因素C:对异养菌含量来说,培养时间(d)水平越大越好。所以取C3为最佳水平。
综合上述分析,确定优方案为A2B2C3或A3B3C3,且B2/A2=B3/A3=0.002%,其中A2B2C3方案正好是正交表中的第5号试验,其是已作过的9个试验中异养菌菌落长成红颜色、异养菌含量最多的试验方案,因此也是最优方案,即TTC在培养基中的最适浓度为0.002%(质量分数),培养时间为3 d。
2.2 精密度试验
分别取不同时段的一循和二循循环水水样,按照PCA-TTC显色法进行试验,每个样品/稀释度,使用2个平行皿,同时做空白对照,根据计数方法进行报告,报告结果见表3。

表3 精密度试验结果
由表3可知,用PCA-TTC显色法检测循环水样品中异养菌,每个样品/稀释度下的平行皿菌落数,置信度达到95%时,经t值检验,测定结果彼此间均无显著差异,满足原标准分析质控要求。
其中例次1和2,按照HG/T 4207—2011《工业循环冷却水异养菌菌数测定平皿计数法》中的选择平均菌落数在30~300之间的稀释度,立即进行计数,求得平均菌落数,并修约成两位有效数字,报告结果分别为一循1.3×105CFU/mL和二循8.9×104CFU/mL。例次3和4,按照HG/T 4207—2011《工业循环冷却水异养菌菌数测定平皿计数法》计数方法中的若有2个稀释度,其生长菌落数均在30~300之间,则视二者之比值来决定,若其比值小于2,应报告其平均数;若大于2则报告其中较小的数字。例次3和4均属于比值大于2则报告其中较小的数字情况,因此报告结果分别为一循2.7×103CFU/mL和二循2.6×105CFU/mL。
2.3 对比和验证试验
在TTC最适浓度(0.002%)下,将一循和二循水样各30份,分别用PCA-TTC显色法与NA平皿计数法培养3 d,每个稀释度分别接种2个平行皿,测定异养菌含量,根据计数方法进行报告,并按照监控指标(小于等于1×105CFU/mL)进行判定是否合格。一循2种方法测定结果见表4,二循2种方法测定结果见表5,归纳总结表4和表5数据,2种测定方法的结果比较见表6。
从表4、表5和表6可知,一循PCA-TTC显色法合格异养菌数份数28例,取得93.33%的合格率;NA平皿计数法合格异养菌数份数29例,取得96.67%的合格率。二循PCA-TTC显色法合格异养菌数份数27例,取得90.00%的合格率;NA平皿计数法合格异养菌数份数29例,取得96.67%的合格率。2种检测方法测定异养菌,经卡方检验[17],P>0.05,2种方法虽均无显著差异,但PCA-TTC显色法检出率高于NA平皿计数法,说明PCA-TTC显色法更适合循环水异养菌生长,准确度更高,可以替代NA平皿计数法测定异养菌。

表4 一循2种方法测定结果

表5 二循2种方法测定结果

表6 2种测定方法的结果比较
2.4 培养时间对异养菌结果的影响
异养菌的培养时间规定为72 h,由于PCA琼脂具有修复和促进细菌生长作用,因此可以缩短培养时间。用PCA-TTC显色法分别测定一循[8.0×103CFU/mL(72 h)]和二循[2.2×104CFU/mL(72 h)]水样中异养菌含量。培养48 h后,每隔3 h/次计数,观察异养菌的增长情况,结果如图1所示。
从图1可以看出,在培养66 h的时候一循和二循都达到了平台期,而72 h时异养菌总数已经很稳定,所以选择66 h作为培养时间就可以得到比较准确的结果。
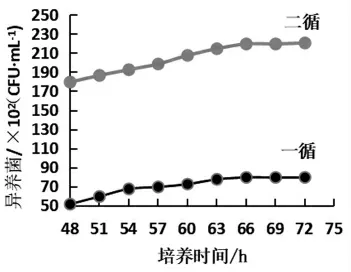
图1 培养时间对异养菌测定结果的影响
3 结论
(1)建立PCA-TTC显色法测定异养菌,不仅对受损细菌恢复并进行有效促进,还能加快计数速度,并缩短培养时间,由原来的72 h缩短至66 h,省时省力,提高工效。
(2)与标准NA平皿计数法对比,2种方法虽无显著差异,但PCA-TTC显色法检出率高,数据准确性和可靠性有效提升,可以替代标准平皿计数法测定异养菌。满足工业循环冷却水水质检测、水质控制和杀菌剂评定性能等方面的实际工作需求,可适用于工业循环冷却水、原水、生活用水及其他水中异养菌菌数的测定。
(3)在普遍认为TTC不适合高温高压灭菌的前提下,笔者通过控制TTC溶液浓度(0.002%),配合高温高压灭菌,降低了TTC灭菌操作难度和抑菌性,取得了良好的技术效果,具有一定的应用前景。

