干旱胁迫对落羽杉幼苗生理特性的影响
梁炜文,周红英,杨景竣,覃 奎,刘 秀
(1.广西壮族自治区国有高峰林场,广西南宁 530001;2.广西壮族自治区林业科学研究院,广西南宁 530002;3.广西大学,广西南宁 530004)
随着全球气候变暖加剧,干旱这一极端现象变得越来越频繁,在非干旱地区也存在季节性干旱现象[1]。干旱是限制植物正常生长和发育的主要因素,干旱导致的植物减产已超过其他非生物因素造成减产的总和[2]。研究表明,干旱作为一种多维胁迫,可引起植物表型、生理学、生物化学和分子水平的变化[3]。干旱会影响植物的生命活动(如呼吸作用和光合作用),进而影响植物的生理代谢和生长发育,严重时会导致植物死亡,影响整个生态环境系统的结构和功能。植物可通过调整形态结构、光合作用、渗透物质含量和抗氧化酶活性等机制来适应干旱逆境[4-8]。了解植物对干旱胁迫的响应机制,选育抗旱能力强的树种是当今研究的热点。
落羽杉(Taxodium distichum)为杉科(Taxodiaceae)落羽杉属植物,原产北美东南部,20 世纪初引种到我国,具有适应性强,耐低温、干旱、涝渍和土壤瘠薄,耐水湿,抗污染,病虫害少,生长快等优点,是我国平原湖区和丘陵山地重要的造林树种和园林绿化植物。目前,对落羽杉的研究主要集中在栽培育种[9-10]、生态化学计量[11-12]、解剖结构[13]、化学成分[14]和耐淹性[15-16]等方面。落羽杉作为构建消落带植被的优良适生乔木,干旱是威胁其生存的生境胁迫之一,但对其耐旱性的研究较少,对其干旱耐受机制缺乏认识。因此,本研究以2年生落羽杉幼苗为研究对象,采用聚乙烯二醇(PEG)模拟干旱胁迫,探究落羽杉在干旱胁迫下的生理机制,以期为落羽杉耐旱性的理论研究及消落带植被选择提供参考。
1 材料与方法
1.1 试验地概况
本试验在广西壮族自治区林业科学研究院苗圃基地(108°35′E,22°92′N)进行。该地属亚热带季风气候,年均气温21.6 ℃,极端高温40.4 ℃,极端低温-2.1 ℃,年均降水量1 304.2 mm,降水主要集中在夏季;年均相对湿度80%,夏季潮湿,冬季干燥;全年日照时间较长。
1.2 试验材料
试验材料为2年生落羽杉幼苗。2019年11月,在浙江安吉县龙山林场采集种子,带回广西林科院苗圃干藏;2020年3月,在沙床中播种,待种子萌发、幼苗长势良好后,移入12 cm × 10 cm 的育苗杯中,每盆1株,基质为纯椰糠。露天培育幼苗,定时定量浇水。2021年6月,待苗高生长至40 cm 左右时,选取生长一致的幼苗进行试验。供试药品为PEG-6000(无锡市亚泰联合化工有限公司),培养基为霍格兰完全营养液(Hoagland)(青岛高科技工业区海博生物技术有限公司)。
1.3 试验方法
设置6 个PEG-6000 浓度梯度:0%(CK)、5%(T1)、10%(T2)、15%(T3)、20%(T4)和25%(T5),将不同浓度的PEG-6000 添加至Hoagland 完全营养液,每处理15 株幼苗,共90 株。将幼苗从育苗杯中取出,用清水洗去根系的土和杂质后,立即将其放入Hoagland 完全营养液中平衡3 天,之后将幼苗根部完全浸入装有不同浓度PEG-6000 和Hoagland 完全营养液混合液的烧杯中,模拟干旱胁迫处理2天。处理完成后,分别对各处理的叶片进行采样,测定各项生理指标。
1.4 指标测定
选取不同处理中长势相近的植株,采摘足量完整的成熟功能叶,剪去主脉,放入自封袋中保存,每处理重复3 次。采用丙酮-乙醇混合浸提法测定叶绿素含量;采用硫代巴比妥酸法测定MDA 含量;采用蒽酮比色法测定可溶性糖含量;采用考马斯亮蓝法测定可溶性蛋白含量;采用氮蓝四唑光还原法测定SOD 活性;采用愈创木酚法测定POD 活性,采用紫外分光光度法测定APX活性[17]。
1.5 数据处理
采用Word 2016 和Excel 2016 软件进行数据处理及图表绘制,采用SPSS 19.0进行方差分析并通过多重比较(Waller-Duncan法)分析各项生理指标在不同干旱处理下的差异。
2 结果与分析
2.1 干旱胁迫对落羽杉幼苗叶绿素含量的影响
随干旱胁迫程度增加,叶绿素a、叶绿素b 和总叶绿素含量均呈先降后升的趋势(图1)。干旱胁迫对各处理幼苗的叶绿素含量影响显著(P<0.05)。T1 处理下,叶绿素a、叶绿素b 和总叶绿素含量均最低,分别为0.44、0.30 和0.74 mg/g,分别比CK 减少27.87%、18.92%和24.49%,显著低于CK 和其他处理(P<0.05);T5 处理下,叶绿素a、叶绿素b 和总叶绿素含量均最高,分别为1.27、0.65 和1.92 mg/g,分别比CK 高出108.20%、75.68%和95.92%,显著高于CK和其他处理(P<0.05)。
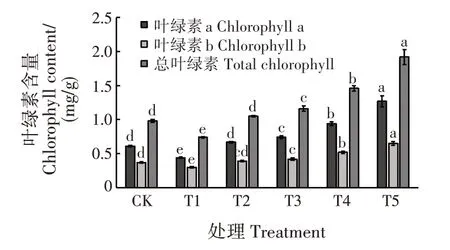
图1 干旱胁迫对落羽杉幼苗叶绿素含量的影响Fig.1 Effects of drought stress on chlorophyll contents of T.distichum seedlings
2.2 干旱胁迫对落羽杉幼苗MDA含量的影响
随干旱胁迫程度增加,MDA 含量呈逐渐升高的趋势(图2)。干旱胁迫对幼苗MDA 含量影响显著(P<0.05)。T1 处理下,MDA 含量最低,比CK 高出14.89%,与CK 差异不显著;T5 处理下,MDA 含量最高,比CK 高出279.79%,显著高于CK 和其他处理(P<0.05)。

图2 干旱胁迫对落羽杉幼苗MDA含量的影响Fig.2 Effects of drought stress on MDA contents of T.distichum seedlings
2.3 干旱胁迫对落羽杉幼苗渗透调节物质含量的影响
随干旱胁迫程度增加,可溶性糖含量呈逐渐升高的趋势(图3a)。干旱胁迫对幼苗的可溶性糖含量影响显著(P<0.05)。T1 处理下,可溶性糖含量最低,比CK高出19.33%,与CK差异不显著;T5处理下,可溶性糖含量最高,比CK 高出121.33%,显著高于CK和其他处理(P<0.05)。
随干旱胁迫程度增加,可溶性蛋白含量呈逐渐升高的趋势(图3b)。干旱胁迫对幼苗的可溶性蛋白含量影响显著(P<0.05)。T1 处理下,可溶性蛋白含量最低,比CK 高出3.68%,与CK 差异不显著;T5 处理下,可溶性蛋白含量最高,比CK 高出49.85%,显著高于CK和其他处理(P<0.05)。
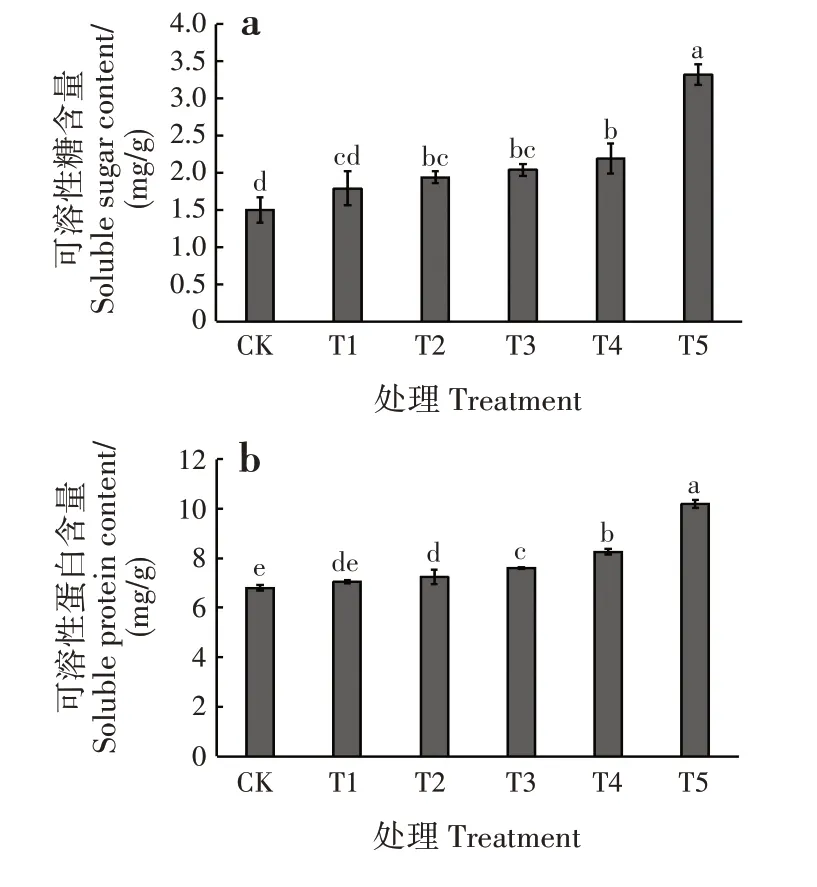
图3 干旱胁迫对落羽杉幼苗可溶性糖和可溶性蛋白含量的影响Fig.3 Effects of drought stress on contents of soluble sugar and soluble protein of T.distichum seedlings
2.4 干旱胁迫对落羽杉幼苗抗氧化酶活性的影响
随干旱胁迫程度增加,SOD 活性呈逐渐升高的趋势(图4a)。干旱胁迫对幼苗SOD 活性影响显著(P<0.05)。各胁迫处理的SOD活性均显著高于CK(P<0.05)。T1 处理下,SOD 活性最小,比CK 高出21.94%;T5 处理下,SOD 活性最大,比CK 高出110.18%,显著高于CK和其他处理(P<0.05)。
随干旱胁迫程度增加,POD 活性呈逐渐升高的趋势(图4b)。干旱胁迫对幼苗POD 活性影响显著(P<0.05)。T1 处理下,POD 活性最小,比CK 高出59.53%,与CK 差异不显著;T5 处理下,POD 活性最大,比CK高出381.18%,显著高于CK(P<0.05)。
随干旱胁迫程度增加,APX 活性呈先升后降的趋势(图4c)。干旱胁迫对幼苗APX 活性影响显著(P<0.05)。T4 处理下,APX 活性最大,比CK 高出81.59%,显著高于CK 和其他处理(P<0.05);T5 处理下,APX 活性最小,比CK 高出20.80%,与CK 差异不显著。

图4 干旱胁迫对落羽杉幼苗SOD,POD和APX活性的影响Fig.4 Effects of drought stress on SOD,POD and APX activities of T.distichum seedlings
3 讨论与结论
叶绿素是一种重要的光合色素,在植物光合作用中起重要作用。其含量能在一定程度上衡量植株的抗逆性[18]。研究表明,适度干旱胁迫,能使叶绿素含量升高;过度的干旱胁迫会造成叶片中叶绿素含量大幅降解[19]。不同植物在应对干旱胁迫时,叶绿素的变化规律不同。本研究中,落羽杉幼苗的叶绿素含量随干旱胁迫程度增加呈先降后升的趋势,这可能是轻度干旱胁迫抑制叶绿素合成,但随干旱胁迫增加,落羽杉幼苗通过合成大量叶绿素来促进光合作用,促进有机物积累及渗透调节物质合成,以此来适应干旱逆境。这与吴玲等[20]对青冈栎(Cyclobalanopsis glauca)及区智等[21]对灯台树(Alstonia scholaris)的干旱胁迫研究结果相似。
MDA 是细胞膜质过氧化作用的最终分解产物,对细胞具有毒害作用,其含量反映膜系统的受伤害程度[22]。研究发现,植物在应对干旱逆境时,膜脂过氧化程度会随干旱胁迫增加而逐渐增大,MDA 含量逐渐升高[23]。本研究中,落羽杉幼苗的MDA 含量随干旱胁迫程度增加而逐渐升高,说明干旱胁迫会对落羽杉幼苗造成一定的损害,且干旱胁迫程度越大,叶片受到的损害越严重。
在干旱胁迫下,植物体内会自动积累各种有机或无机物质来提高细胞液浓度,降低渗透势,维持细胞膨压以减少水分流失,可溶性糖和可溶性蛋白是植物叶片渗透调节的重要物质[24]。本研究中,落羽杉幼苗的可溶性糖与可溶性蛋白含量均随干旱胁迫程度增加而逐渐升高,说明落羽杉具有较强的渗透调节能力,通过合成大量的渗透调节物质使其更好地适应干旱逆境,这与何凤[25]等对杜仲(Eucommia ulmoides)干旱胁迫的研究结果相似。
应对干旱胁迫的另一个重要机制是抗氧化酶防御系统,SOD、POD 和APX 是植物体内重要的抗氧化酶,可有效清除活性氧,减轻胁迫诱导的氧化伤害[26-27]。本研究中,落羽杉幼苗的SOD 和POD 活性均随干旱胁迫程度增加而逐渐升高,说明落羽杉幼苗可以通过增强保护酶的活性来清除活性氧,抵御干旱逆境造成的伤害,这与姜露露[28]等对无花果(Ficus carica)干旱胁迫的研究结果相似。APX 活性随干旱胁迫增加呈先升后降的趋势,这可能是在重度胁迫下,落羽杉幼苗的活性氧清除系统遭到破坏,酶活性下降,也说明抗氧化酶防御系统对植物的保护具有一定局限性。
落羽杉具有较好应对干旱胁迫的调节能力,对干旱逆境具有较强的耐受性,其幼苗可以通过提升自身叶绿素含量、渗透调节物质含量及抗氧化酶活性来适应干旱逆境,但在重度干旱下,其膜脂过氧化程度显著升高,细胞受损严重,APX 活性降低,抑制其生长。本研究较为系统地探究了落羽杉幼苗在干旱胁迫下的生理应答机制,可为落羽杉耐旱性的理论研究提供重要参考。虽然本研究仅选择2年生幼苗作为试验材料,不能完全代表其各生长阶段的抗旱性,但幼苗是植物生长的最脆弱阶段,其表现出较强的耐旱性,说明落羽杉是适用于消落带景观改良和绿化的重要树种。

