基于IRS2/PI3K/FOXO4信号通路研究复方仙草颗粒抑制糖尿病肾病足细胞上皮-间充质转化的作用机制
刘丹宁,黄国东,杨鑫勇,周嫦艳,王亚南
基于IRS2/PI3K/FOXO4信号通路研究复方仙草颗粒抑制糖尿病肾病足细胞上皮-间充质转化的作用机制
刘丹宁1,黄国东2*,杨鑫勇1,周嫦艳1,王亚南1
1. 广西中医药大学,广西 南宁 530000 2. 广西中医药大学附属国际壮医医院,广西 南宁 530000
基于胰岛素受体底物2(insulin receptor substrate 2,IRS2)/磷脂酰肌醇-3-激酶(phosphatidylinositol-3-kinase,PI3K)/叉头框蛋白O4(forkhead box O4,FOXO4)信号通路探讨复方仙草颗粒抑制糖尿病肾病(diabetic nephropathy,DN)大鼠肾足细胞上皮-间充质转化(epithelial-mesenchymal transition,EMT)的作用机制。采用单侧肾切除、高糖高脂饲料喂养及一次性ip链脲佐菌素制备DN模型大鼠,另设置对照组和假手术组,将造模成功的大鼠随机分为模型组、厄贝沙坦(15.75 mg/kg)组和复方仙草颗粒组低、中、高剂量(315.0、472.5、945.0 mg/kg)组,各给药组ig相应药物,连续6周。检测各组大鼠空腹血糖、肾脏指数(kidney index,KI)、尿微量白蛋白/肌酐比值(urinary albumin-to-creatinine ratio,UACR)、尿素氮(blood urea nitrogen,BUN)水平;采用苏木素-伊红(HE)染色法观察肾组织病理变化;采用透射电镜(TEM)观察肾足细胞超微结构变化;采用qRT-PCR和Western blotting检测大鼠肾组织足细胞裂孔膜蛋白()、P-钙黏蛋白()、α-平滑肌肌动蛋白(α-smooth muscle actin,)、、成纤维细胞特异蛋白-1(fibroblast specific protein-1,)及IRS2/PI3K/FOXO4信号通路相关因子mRNA和蛋白表达。与对照组比较,模型组大鼠KI、UACR、BUN水平均显著升高(<0.05),肾小球肥大,肾小管广泛扩张,上皮细胞变性脱落,足突融合或丢失;肾组织nephrin、P-cadherin表达显著降低(<0.05),α-SMA、Desmin、FSP-1表达显著升高(<0.05),IRS2/PI3K/FOXO4信号通路相关因子mRNA和蛋白表达均显著降低(<0.05)。与模型组比较,复方仙草颗粒组大鼠KI、UACR、BUN水平显著降低(<0.05),肾脏病理结构和足细胞超微结构明显改善;肾组织nephrin、P-cadherin表达显著升高(<0.05),α-SMA、Desmin、FSP-1表达显著降低(<0.05),IRS2/PI3K/FOXO4信号通路相关因子mRNA和蛋白表达均显著升高(<0.05)。复方仙草颗粒能够通过调节IRS2/PI3K/FOXO4信号通路改善DN大鼠肾功能,抑制DN大鼠足细胞EMT,减轻足细胞损伤。
复方仙草颗粒;糖尿病肾病;足细胞;上皮-间充质转化;胰岛素受体底物2/磷脂酰肌醇-3-激酶/叉头框蛋白O4信号通路
糖尿病肾病(diabetic nephropathy,DN)作为糖尿病的严重并发症之一,已成为一个日趋严重的全球性健康问题,目前我国糖尿病患者大约为9500万,还有约1.5亿患者处于糖尿病前期阶段[1]。1型和2型糖尿病均可发展为DN,DN主要由微血管病变引起,是导致糖尿病患者终末期肾功能衰竭甚至死亡的重要因素,但现代医学针对DN缺乏特异性有效的治疗方法[2]。因此,寻找预防和治疗的新靶点已成为治疗DN急需解决的问题。
高糖诱导的氧化应激、线粒体损伤等导致肾足细胞凋亡和功能损伤,是推进DN发生发展的重要因素。足细胞是肾小球滤过膜的最后一道屏障,蛋白尿是肾小球滤过屏障受损的标志,DN的进展与足细胞功能障碍密切相关,但其作用机制尚未明确[3-4]。上皮-间充质转化(epithelial-mesenchymal transition,EMT)是DN中足细胞功能障碍和足细胞减少的潜在机制,当受到损伤时,足细胞会发生一系列的表型改变,其高度特化的足细胞标志物如足细胞裂孔膜蛋白(nephrin)、P-钙黏蛋白(P-cadherin)停止表达,而纤维细胞特异蛋白-1(fibroblast specific protein-1,FSP-1)、Desmin、α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)等开始表达[5]。
复方仙草颗粒由八仙草、三七、黄芪、(制)大黄、薏苡仁、甘草组成,有健脾益肾、清热利湿、活血解毒之功效,是壮医有效验方,临床应用证实该方能够改善早期DN患者的肾功能、内皮功能、血液流变学及免疫功能[6],并对IgA肾病起到有效的治疗作用[7];能够影响肾脏线粒体自噬从而保护肾功能,抑制肾损伤[8]。毒理研究显示该方安全无毒[9],并制定了行业质量标准(以人参皂苷Rb1计)[10]。本研究拟从分子细胞水平、基因水平阐述复方仙草颗粒对DN大鼠与EMT相关指标的影响,为复方仙草颗粒的临床应用提供科学依据。
1 材料
1.1 动物
SPF级雄性SD大鼠60只,6周龄,体质量(180±20)g,购自湖南斯莱克景达实验动物有限公司,合格证号No.430727211100630627。动物饲养于广西中医药大学SPF级屏障环境内,相对湿度50%~70%,温度23~26 ℃,自然昼夜节律。动物实验经广西中医药大学动物伦理委员会批准(批准号DW20210321-056)。
1.2 药品与试剂
复方仙草颗粒(批号201202,人参皂苷Rb1质量分数为5.89 mg/g,10 g/包)由广西国际壮医医院壮瑶药研发中心生产;厄贝沙坦(150 mg/片,批号210329JT)购自江苏恒瑞医药股份有限公司;链脲佐菌素(streptozocin,STZ,批号S8050)购自北京索莱宝科技有限公司;大鼠尿微量白蛋白ELISA试剂盒(批号RR7B2Q48AG)、胰岛素ELISA试剂盒(批号FTNR2NC6Z9)购自武汉伊莱瑞特生物科技股份有限公司;尿素氮(blood urea nitrogen,BUN)试剂盒(批号C013-2-1)、肌酐试剂盒(批号C011-2-1)购自南京建成生物工程研究所;叉头框蛋白O4(forkhead box O4,FOXO4)抗体(批号BC106761)、P-cadherin抗体(批号BC041846)、α-SMA抗体(批号BC017554)、Desmin抗体(批号BC032116)、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体(批号BC00100134)、磷脂酰肌醇-3-激酶(phosphatidylinositol-3-kinase,PI3K)抗体(批号BC030815)、FSP-1抗体(批号BC016300)购自武汉Proteintech公司;胰岛素受体底物2(insulin receptor substrate 2,IRS2)抗体(批号ab134101)购自英国Abcam公司;提取总RNA试剂盒(批号A6010)购自普洛麦格生物技术有限公司;HRP标记的山羊抗兔IgG抗体(批号C31430100)、HRP标记的山羊抗鼠IgG抗体(批号C31430101)、nephrin抗体(批号AB-11153994)购自美国Thermo Fisher Scientific公司;磷酸化PI3K(phosphorylated PI3K,p-PI3K)抗体(批号bs-3332R)、磷酸化IRS2(phosphorylated IRS2,p-IRS2)抗体(批号bs-5397R)购自北京博奥森生物有限公司。
1.3 仪器
HT7700型透射电子显微镜(TEM,日本HITACHI公司);GA-3型血糖仪(三诺生物传感股份有限公司);732BR2019型化学发光成像仪、4100624型高通量酶标仪筛选系统(美国Bio Rad公司);2809152型PCR仪(Biometer公司);UC7型超薄切片机(德国Leica公司);58595型超微量紫外分光光度计(美国Thermo Fisher Scientific公司);05815916001型qRT-PCR仪(瑞士Roche公司)。
2 方法
2.1 DN模型的制备
SD雄性大鼠适应性喂养5 d后,取40只大鼠制备DN模型[11-14]。大鼠喂食高糖高脂饲料,以右侧卧位固定于鼠板上,在大鼠耳尖与尾巴连线和右肋弓下缘交点处做1 cm左右的横行切口,切口后将右肾从切口中推挤出体外,充分暴露右肾,切除右肾,缝合后消毒切口;术后1个月,大鼠禁食不禁水12 h,一次性ip STZ(40 mg/kg),3 d后,连续3 d尾静脉采血测得血糖≥16.7 mmol/L为DN大鼠。同时连续2次留取24 h尿,测尿微量白蛋白、24 h尿蛋白定量。当24 h尿蛋白定量≥30 mg或尿微量白蛋白与肌酐比值(urinary albumin-to-creatinine ratio,UACR)>30 mg/g,则认定DN模型成立。另取10只大鼠作为对照组,10只大鼠作为假手术组,对照组不做任何处理,自由进食饮水,用普通饲料喂养;假手术组切口后行暴露左肾缝合切口,并ip 0.1 mmol/L柠檬酸钠-柠檬酸缓冲液。实验过程中,2只大鼠因术中失血过多死亡,4只大鼠因无法耐受STZ毒性死亡,4只未达DN成模标准予以剔除。
2.2 分组及给药
根据随机数表法,将DN大鼠分为模型组、厄贝沙坦(15.75 mg/kg)组和复方仙草颗粒低、中、高剂量(315、472.5、945 mg/kg)组,每组6只。各给药组ig相应药物,对照组和模型组ig等体积的蒸馏水,1次/d,连续6周。每周测定1次空腹血糖(fasting blood glucose,FBG),给药结束后,留取24 h尿,禁食不禁水12 h,腹主动脉取血;取肾脏,称定质量,随后立刻取肾皮质(2 mm×2 mm),置于电镜固定液中常温固定2 h后,4 ℃固定24 h;沿肾脏纵轴切开,一半置于4%多聚甲醛溶液中,另一半取肾皮质部分于−80 ℃保存备用。
2.3 大鼠一般情况、肾脏指数(kidney index,KI)及肾功能指标的检测
观察给药前后大鼠的精神状态、饮食、饮水以及皮毛色泽变化等情况,计算KI;按试剂盒说明书测定血清中BUN和肌酐含量,按ELISA试剂盒说明书测定尿微量白蛋白含量。
KI=肾脏质量/体质量
2.4 FBG、FINS及HOMA-IR的检测
末次给药后,于大鼠进食6~8 h后测量大鼠FBG;按ELISA试剂盒说明书测定空腹胰岛素(fasting insulin,FINS)后,计算胰岛素抵抗指数(homeostasis model assessment,HOMA-IR)。
HOMA-IR=FINS×FBG/22.5
2.5 肾组织病理及足细胞超微结构的检测
将固定于4%多聚甲醛溶液的肾组织修剪至合适大小,梯度脱水,石蜡包埋,将蜡块切成4 μm厚度,置于载玻片上,烤片,进行苏木素-伊红(HE)染色观察肾组织病理形态结构。
将固定于电镜固定液的组织进行梯度脱水,使用丙酮-812包埋剂(1∶1)包埋,丙酮-812包埋剂(1∶2)渗透过夜,37 ℃烤箱过夜,60 ℃烤箱聚合48 h;超薄切片机切片,铀铅双染色,切片室温干燥过夜,于TEM下观察足细胞结构,采集图像后用Image pro plus 6.0软件进行数据分析。
2.6 免疫组化法检测肾组织足细胞标志物和EMT标志物蛋白表达
将肾组织切片脱蜡,梯度乙醇水化后,PBS冲洗3次;95 ℃微波抗原修复10 min,PBS冲洗3次;加入山羊血清封闭20 min,分别滴加α-SMA抗体(1∶200)、nephrin抗体(1∶500)、P-cadherin抗体(1∶500)、Desmin抗体(1∶200)、FSP-1抗体(1∶500),4 ℃孵育过夜;漂洗后,滴加二抗,孵育后冲洗,加入DAB显色液,二甲苯透明,中性树胶封片,于显微镜下观察蛋白阳性表达,用Image-Pro Plus 6.0软件分析平均吸光度()值。
2.7 qRT-PCR检测肾组织足细胞标志物、EMT标志物和IRS2/PI3K/FOXO4信号通路相关因子mRNA表达
取低温保存的肾组织5~10 mg,放入钢珠,用冷冻研磨仪将组织研磨成匀浆,按照试剂盒说明书提取总RNA并合成cDNA,进行qRT-PCR分析。引物由上海捷瑞生物工程有限公司合成,引物序列见表1。
2.8 Western blotting检测肾组织足细胞标志物、EMT标志物和IRS2/PI3K/FOXO4信号通路相关蛋白表达
取低温保存的肾组织20 mg,置于装有RIPA裂解液的离心管,放入钢珠,用冷冻研磨仪将组织匀浆(10 000 r/min、5 min),取出钢珠,冰上裂解20 min,取上清,BCA法测定蛋白浓度,将上清液与5×上样缓冲液混匀煮沸,得到变性蛋白。蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,用5%脱脂牛奶封闭;分别加入p-IRS2抗体(1∶10 000)、IRS2抗体(1∶3000)、p-PI3K抗体(1∶10 000)、PI3K抗体(1∶10 000)、FOXO4抗体(1∶3000)、α-SMA抗体(1∶6000)、nephrin抗体(1∶2000)、P-cadherin抗体(1∶2000)、Desmin抗体(1∶50 000)和GAPDH抗体(1∶20 000),4 ℃孵育过夜;TBST洗涤5次,加入相应二抗,常温孵育1 h,TBST洗涤5次,加入ECL发光试剂显色,使用Image J软件分析条带灰度值。
表1 引物序列
Table 1 Primer sequences
基因序列 NephrinF: 5’-GGCTCTGACCACACCAACATCC-3’ R: 5’-GAGTGAGGGCTTATGCTGACAAC-3’ α-SMAF: 5’-GGCTATGCTCTGCCTCAT-3’ R: 5’-GGACGATCTCACGCTCA-3’ DesminF: 5’-CAGCAACAGGGACAATGA-3’ R: 5’-CACAGCCAACATGGAAGA-3’ P-cadherinF: 5’-TGTCTTGCCTCGGAACA -3’ R: 5’-TAAGCACCACCCCATT-3’ IRS2F: 5’-CCACTGCTGGCTCCTCA-3’ R: 5’-GTCACTCGGGCACCTTCT-3’ PI3KF: 5’-TGTCTTGCCTCGGAACA-3’ R: 5’-CAAACTCCAGCCACACATT-3’ FOXO4F: 5’-CTGTCACCCTTGTCCTTGA-3’ R: 5’-TGCAGAACTCATCAGCCA-3’ FSP-1F: 5’-CAGCAACAGGGACAATGA-3’ R: 5’-CACAGCCAACATGGAAGA-3’ β-actinF: 5’-ATCATTGCTCCTCCTGAGCG-3’ R: 5’-CAGCTCAGTAAVAGTCCGCC-3’
2.9 统计学分析

3 结果
3.1 复方仙草颗粒对DN大鼠一般情况和肾脏外观的影响
对照组和假手术组大鼠毛发顺滑,反应灵敏,一般情况较好;模型组大鼠精神欠佳,反应迟钝,毛发枯黄杂乱,掉毛严重,身上出现斑秃现象,进食量和饮水量与日剧增,但体质量减轻,尿量增多。各给药组大鼠相较于模型组大鼠精神稍好,反应稍迟钝,进食量和饮水量相较于对照组大鼠增加,但少于模型组大鼠,体质量变化起伏不大。
如图1所示,与对照组比较,模型组大鼠由于单侧肾切除术后仅有1个肾脏进行全身的代谢活动并且无药物干预,因此肾脏明显大于对照组大鼠肾脏;与模型组比较,各给药组肾脏略小于模型组大鼠肾脏,且各组间基本无差别。
3.2 复方仙草颗粒对DN大鼠KI及肾功能的影响
如表2所示,与对照组比较,假手术组大鼠KI、UACR、BUN无统计学差异,模型组大鼠KI、UACR和BUN水平均显著升高(<0.05);与模型组比较,各给药组大鼠KI、UACR和BUN水平均显著降低(<0.05)。
3.3 复方仙草颗粒对DN大鼠FBG、FINS及HOMA-IR的影响
如表3所示,与对照组比较,假手术组大鼠FBG、FINS及HOMA-IR无统计学差异,模型组大鼠FBG、HOMA-IR均显著升高(<0.05),FINS显著降低(<0.05);与模型组比较,各给药组大鼠FBG、HOMA-IR均显著降低(<0.05),FINS显著升高(<0.05)。

图1 复方仙草颗粒对DN大鼠肾脏外观的影响

表2 复方仙草颗粒对DN大鼠KI及肾功能指标的影响()
与对照组比较:*<0.05;与模型组比较:#<0.05,下表同
*< 0.05control group;#< 0.05model group, same as below tables

表3 复方仙草颗粒对DN大鼠FBG、FINS及HOMA-IR的影响()
3.4 复方仙草颗粒对DN大鼠肾组织病理及足细胞超微结构的影响
如图2所示,HE染色结果显示,对照组和假手术组大鼠肾组织结构正常,肾小管上皮细胞未见明显变性,肾小球结构正常,系膜细胞未见增生,组织未见明显炎症细胞浸润;与对照组比较,模型组大鼠肾组织结构重度异常,肾小管广泛扩张,上皮细胞变性脱落,部分上皮细胞气球样变,胞质完整消失,间质可见少量炎症细胞浸润,肾小球肥大,毛细血管袢扩张;与模型组比较,各给药组肾组织各种损伤较轻,部分肾小管扩张,个别肾小管上皮细胞数量减少并可见气球样变,肾小球轻度肥大,未见炎症细胞浸润。
TEM结果显示,假手术组大鼠肾皮质与对照组无明显差异;模型组大鼠足突约有80%融合,部分足突变宽,基底膜局部增宽,厚薄不均匀,线粒体可见轻度肿胀,大小不均,部分嵴减少,基质溶解空泡变。与模型组比较,厄贝沙坦组和复方仙草颗粒高剂量组足突融合40%左右,基底膜厚薄较均匀;复方仙草颗粒低剂量组足突融合程度70%左右,基底膜局部增宽,线粒体未见肿胀;复方仙草颗粒中剂量组足突融合程度60%左右,基底膜局部增宽,线粒体未见肿胀。
3.5 免疫组化法检测肾组织足细胞标志物和EMT标志物蛋白表达
如图3和表4所示,与对照组比较,假手术组大鼠EMT标志物(Desmin、α-SMA、FSP-1)和足细胞标志物(nephrin、P-cadherin)蛋白表达无统计学差异意义,模型组大鼠肾组织Desmin、α-SMA、FSP-1蛋白表达显著升高(<0.05),nephrin、P-cadherin蛋白表达显著降低(<0.05);与模型组比较,各给药组α-SMA蛋白表达显著降低(<0.05),nephrin蛋白表达显著升高(<0.05);厄贝沙坦组和复方仙草颗粒中、高剂量组Desmin、FSP-1蛋白表达显著降低(<0.05),P-cadherin蛋白表达显著升高(<0.05)。
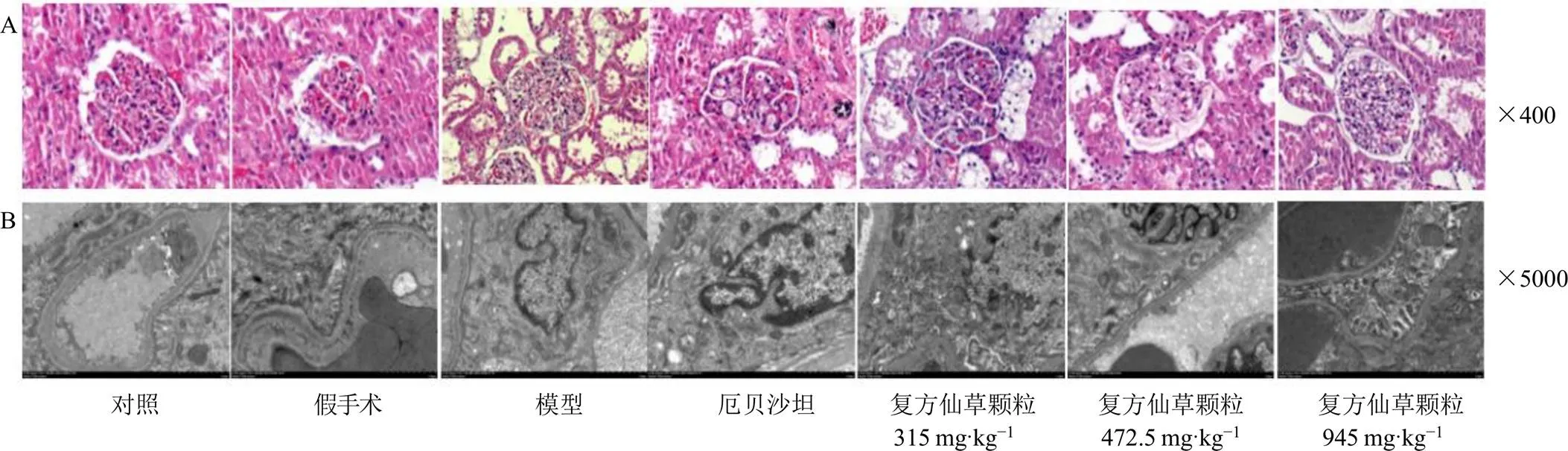
图2 复方仙草颗粒对DN大鼠肾组织病理(A) 及足细胞超微结构(B) 的影响
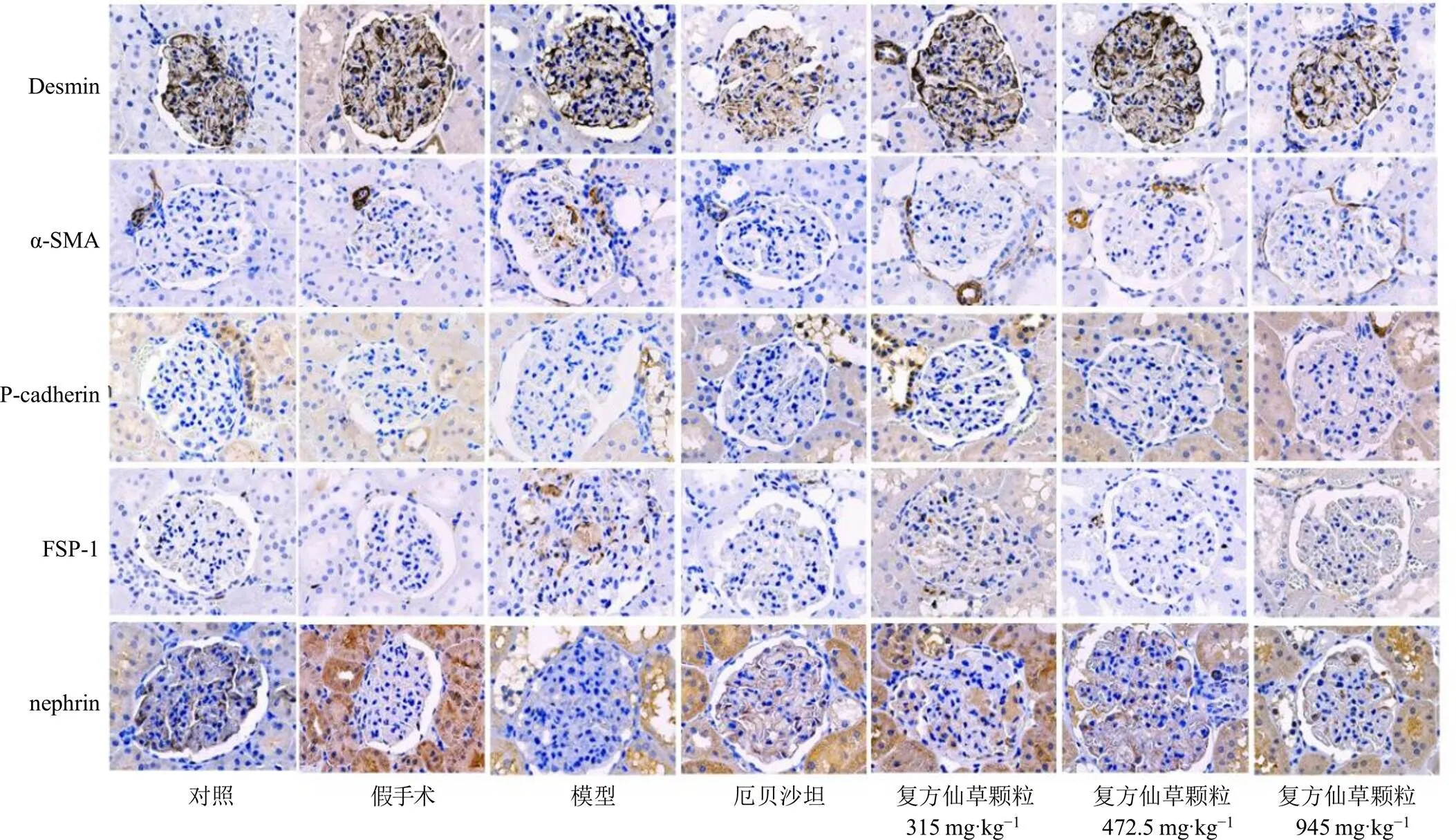
图3 复方仙草颗粒对DN大鼠肾组织α-SMA、nephrin、P-cadherin、Desmin和FSP-1蛋白表达的影响 (免疫组化, ×400)

表4 复方仙草颗粒对DN大鼠肾组织α-SMA、nephrin、P-cadherin、Desmin和FSP-1蛋白表达的影响()
3.6 复方仙草颗粒对DN大鼠肾组织α-SMA、Desmin、FSP-1、nephrin和P-cadherin mRNA表达的影响
如表5所示,与对照组比较,假手术组大鼠肾组织、、、和mRNA表达无统计学差异,模型组大鼠肾组织、、mRNA表达水平均显著升高(<0.05),、mRNA表达水平显著降低(<0.05);与模型组比较,各给药组大鼠肾组织、、mRNA表达水平显著降低(<0.05),、mRNA表达水平显著升高(<0.05)。
3.7 复方仙草颗粒对DN大鼠肾组织IRS2、PI3K和FOXO4 mRNA表达的影响
如表6所示,与对照组比较,假手术组大鼠肾组织、和mRNA表达无统计学差异,模型组大鼠肾组织、mRNA表达水平显著升高(<0.05),mRNA表达水平显著降低(<0.05);与模型组比较,各给药组大鼠肾组织mRNA表达水平显著降低(<0.05),、mRNA表达水平显著升高(<0.05)。

表5 复方仙草颗粒对DN大鼠肾组织α-SMA、Desmin、FSP-1、nephrin和P-cadherin mRNA表达的影响(, n = 3)

表6 复方仙草颗粒对DN大鼠肾组织IRS2、PI3K和FOXO4mRNA表达的影响(, n = 3)
3.8 复方仙草颗粒对DN大鼠肾组织α-SMA、nephrin、P-cadherin和Desmin蛋白表达的影响
如图4和表7所示,与对照组比较,假手术组大鼠肾组织α-SMA、Desmin蛋白表达无统计学差异,模型组大鼠肾组织α-SMA、Desmin蛋白表达水平显著升高(<0.05),nephrin、P-cadherin蛋白表达水平显著降低(<0.05);与模型组比较,各给药组大鼠肾组织α-SMA、Desmin蛋白表达水平显著降低(<0.05),nephrin、P-cadherin蛋白表达水平显著升高(<0.05)。

图4 复方仙草颗粒对DN大鼠肾组织α-SMA、nephrin、Desmin和P-cadherin蛋白表达的影响

表7 复方仙草颗粒对DN大鼠肾组织α-SMA、nephrin、Desmin和P-cadherin蛋白表达的影响(, n = 3)
3.9 复方仙草颗粒对DN大鼠肾组织IRS2/PI3K/ FOXO4信号通路相关蛋白表达的影响
如图5和表8所示,与对照组比较,假手术组大鼠肾组织IRS2、p-IRS2、PI3K、p-PI3K、FOXO4蛋白表达无统计学差异,模型组大鼠肾组织p-IRS2、p-PI3K和FOXO4蛋白表达水平均显著降低(<0.05);与模型组比较,各给药组大鼠肾组织p-IRS2、p-PI3K和FOXO4蛋白表达水平均显著升高(<0.05)。

图5 复方仙草颗粒对DN大鼠肾组织IRS2/PI3K/FOXO4信号通路相关蛋白表达的影响
4 讨论
糖尿病是由于胰岛素分泌相对或绝对不足、靶细胞胰岛素敏感性下降或胰岛素自身结构缺陷而导致代谢紊乱的慢性疾病[15-16]。持续性高血糖、胰岛素抵抗和脂代谢紊乱可导致DN、糖尿病足和神经病变等一系列并发症。肾足细胞是黏附于肾小球基底膜外侧高度分化的细胞,与肾小球血管内皮细胞、基底膜共同构成肾小球滤过屏障[17]。EMT是上皮细胞通过特定程序转化为具有特定表型细胞的生物学过程,是肾间质纤维化和肾功能丧失的主要机制之一[18]。研究表明,当足细胞出现EMT时,可促使足细胞具有运动性,导致足细胞三维结构及表型破坏,进而使其骨架改变[19],是肾足细胞脱落和凋亡前的一个过程[17]。本研究发现复方仙草颗粒干预后,DN大鼠肾组织病理形态改善,足细胞足突融合减少,基底膜厚度相对均一,线粒体未见肿胀,高度特化的足细胞标志物nephrin、P-cadherin蛋白表达显著增加,而EMT标志蛋白α-SMA、Desmin、FSP-1等表达则显著降低。表明复方仙草颗粒能够改善DN足细胞损伤,抑制肾足细胞EMT,改善肾功能。
厄贝沙坦为血管紧张素II受体拮抗剂,能够选择性切断血管紧张素转换酶I和受体血管紧张素II结合,减少醛固酮分泌从而控制血管收缩,减轻肾脏损害[20],具有降血压、减少蛋白尿、组织相容性好、脂溶性高等特点,能选择性对出球小动脉进行扩张[21],从而降低肾小球内高压情况,改善肾小球的高滤过[22];并且能够明显改善肾足细胞相关标志蛋白表达,保护肾足细胞,改善肾功能[23-24];对肾组织的炎症因子有抑制作用[25],能够延缓肾间质的纤维化[26]。研究已证实,厄贝沙坦能够激活PI3K/蛋白激酶B(protein kinase B,Akt)[27-28]、IRS2/PI3K/葡萄糖转运蛋白(glucose transporter,GLUT)[29-30]等信号通路,因此选用厄贝沙坦作为阳性对照药物。

表8 复方仙草颗粒对DN大鼠肾组织IRS2/PI3K/FOXO4信号通路相关蛋白表达的影响(, n = 3)
胰岛β细胞功能受损引发胰岛素分泌不足或胰岛素抵抗是引起2型糖尿病的重要发病机制[31]。IRS2是有丝分裂发生的主要介质[32],能够调节胰岛素、胰岛素样生长因子1等细胞因子;p-IRS2可以激活PI3K/Akt通路[33-36],从而介导FOXO4活性。FOXO因子可与多种靶基因的启动子结合,并控制细胞内环境稳定的几个关键过程[3],大量研究证明,FOXO作为调节下游靶基因以抵消细胞压力的转录因子,调控体内的氧化应激、代谢、免疫以及细胞凋亡等生物过程[32-33]。研究表明,IRS2与肾皮质纤维化有关[37-38],PI3K能够改善DN大鼠肾脏细胞的葡萄糖代谢和水盐代谢紊乱[38],也可通过Akt途径上调FOXO3、FOXO3a、FOXO4[39-41]。FOXO4与糖尿病及其并发症的发生发展起关键性作用,且具有促进细胞增殖[42]、抗肿瘤细胞转移的作用[43]。本研究结果表明复方仙草颗粒能够改善DN大鼠胰岛素功能,从而分泌胰岛素,与胰岛素受体结合,导致胰岛素磷酸化和IRS2酪氨酸位点磷酸化,p-IRS2可以激活PI3K及其下游分子[33-35],促进葡萄糖转运及糖原合成。酪氨酸磷酸化后的IRS2与PI3K的调节亚基p85结合,进而激活PI3K。活化的PI3K将磷脂酰肌醇一磷酸转化为磷脂酰肌醇二磷酸和磷脂酰肌醇三磷酸,并作为其第二信使激活Akt[36,44-45],从而介导FOXO家族的活性。
综上所述,复方仙草颗粒能够改善DN大鼠足细胞EMT,减轻足细胞损伤,具有较好的保护肾脏的作用,其作用机制可能与调控IRS2/PI3K/FOXO4信号通路有关。
利益冲突 所有作者均声明不存在利益冲突
[1] Cellesi F, Li M, Rastaldi M P. Podocyte injury and repair mechanisms [J]., 2015, 24(3): 239-244.
[2] 陆世龙, 王龙龙, 黄国东. 中医药治疗早期糖尿病肾病的研究进展 [J]. 辽宁中医杂志, 2016, 43(5): 1101-1103.
[3] Link W. Introduction to FOXO biology [J]., 2019, 1890: 1-9.
[4] 周骅, 曹新生, 胡泽兵, 等. FOXOs转录因子生物学功能的研究进展 [J]. 现代生物医学进展, 2017, 17(1): 185-188.
[5] Herman-Edelstein M, Thomas M C, Thallas-Bonke V,. Dedifferentiation of immortalized human podocytes in response to transforming growth factor-β: A model for diabetic podocytopathy [J]., 2011, 60(6): 1779-1788.
[6] 黄雅兰, 黄国东, 蔡林坤, 等. 壮药复方仙草颗粒治疗早期糖尿病肾病的临床疗效及对患者内皮功能、血液流变学、免疫功能的影响 [J]. 中国全科医学, 2020, 23(24): 3086-3093.
[7] 李燕珍, 吴强, 芦万华. 复方仙草颗粒治疗IgA肾病的临床效果研究 [J]. 人人健康, 2016(23): 58.
[8] 吕建珍, 淮国丽, 黄国东, 等. 复方仙草颗粒通过线粒体途径抑制肾足细胞凋亡的研究 [J]. 中华中医药杂志, 2017, 32(6): 2730-2735.
[9] 陈少锋, 梁丽清, 王河, 等. 复方仙草颗粒的急性毒性研究 [J]. 中国民族民间医药, 2020, 29(7): 17-19.
[10] 黄国东, 顾敬文, 莫宇凤, 等. 复方仙草颗粒的质量标准研究 [J]. 广西中医药, 2019, 42(5): 67-71.
[11] 郭丛丛, 焦明文, 张亚芹, 等. 单侧肾切除联合链脲佐菌素诱导糖尿病肾病大鼠建模方法改进与评价 [J]. 动物医学进展, 2019, 40(2): 135-139.
[12] Mori Y, Ajay A K, Chang J H,. KIM-1 mediates fatty acid uptake by renal tubular cells to promote progressive diabetic kidney disease [J]., 2021, 33(5): 1042-1061.e7.
[13] Sugano M, Yamato H, Hayashi T,. High-fat diet in low-dose-streptozotocin-treated heminephrectomized rats induces all features of human type 2 diabetic nephropathy: A new rat model of diabetic nephropathy [J]., 2006, 16(7): 477-484.
[14] 王康, 李平, 张浩军, 等. 2型糖尿病肾病中晚期病变大鼠模型的研究 [J]. 中国中西医结合肾病杂志, 2010, 11(1): 14-17.
[15] Liu Y F, Huang H, Gao R,. Dynamic phenotypes and molecular mechanisms to understand the pathogenesis of diabetic nephropathy in two widely used animal models of type 2 diabetes mellitus [J]., 2020, 8: 172.
[16] Victor P, Umapathy D, George L,. Crosstalk between endoplasmicstress and oxidative stress in the progression of diabetic nephropathy [J]., 2021, 26(2): 311-321.
[17] 查冬青, 高苹, 吴小燕.-乙酰基-丝氨酰-天门冬酰-赖氨酰-脯氨酸对高糖诱导足细胞损伤的保护作用及机制 [J]. 临床肾脏病杂志, 2018, 18(9): 574-578.
[18] Cruz-Solbes A S, Youker K. Epithelial to mesenchymal transition (EMT) and endothelial to mesenchymal transition (EndMT): Role and implications in kidney fibrosis [J]., 2017, 60: 345-372.
[19] 赵敬, 赵宗江. 足细胞上皮-间充质转分化的分子机制及中药干预的研究进展 [J]. 中国中西医结合肾病杂志, 2014, 15(12): 1119-1122.
[20] 陈娇月, 山秀杰, 刘敏, 等. 骨化三醇联合二甲双胍对腹型肥胖2型糖尿病早期肾病的影响 [J]. 河北医学, 2020, 26(4): 602-605.
[21] 孙冠媛, 于辉田, 宁宁, 等. 不同剂量阿托伐他汀对糖尿病肾病患者免疫及全身微炎症状态的影响 [J]. 实用药物与临床, 2019, 22(7): 693-696.
[22] 孙霄龙, 张蕾. 厄贝沙坦联合阿托伐他汀治疗早期糖尿病肾病对患者内皮素水平的影响 [J]. 山西医药杂志, 2022, 51(6): 661-664.
[23] 应帅兵, 张伊娜, 邱华锋, 等. 益气养阴活血方对糖尿病肾病大鼠肾功能及足细胞的影响 [J]. 浙江中医药大学学报, 2019, 43(4): 354-359.
[24] 王颖超, 王婷, 于眉, 等. 糖肾平对糖尿病肾病大鼠肾脏保护作用及对足细胞标志蛋白Podocalyxin影响 [J]. 辽宁中医药大学学报, 2019, 21(4): 39-43.
[25] 王岚, 朱国双, 王小琴. 基于Klotho调控的TGF-β1/ Egr1信号通路探讨肾元颗粒对db/db糖尿病肾病小鼠肾脏保护作用 [J]. 中华中医药杂志, 2021, 36(8): 5033-5036.
[26] 胡秀, 李海燕, 宋斌, 等. 阿托伐他汀对糖尿病肾病患者肾纤维化程度、氧化应激及相关因子水平的影响 [J]. 海南医学院学报, 2019, 25(9): 662-665.
[27] 高航, 田明慧. 厄贝沙坦对大鼠心肌缺血再灌注PI3K/Akt通路与细胞凋亡的影响 [J]. 中国现代医学杂志, 2011, 21(30): 3746-3749.
[28] Mohamed E A, Ahmed H I, Zaky H S. Protective effect of irbesartan against doxorubicin-induced nephrotoxicity in rats: Implication of AMPK, PI3K/Akt, and mTOR signaling pathways [J]., 2018, 96(12): 1209-1217.
[29] 刘莉, 罗鹏, 周田田, 等. 厄贝沙坦对高血压合并2型糖尿病大鼠胰岛素抵抗IRS-1/PI3K/GLUT4信号通路的影响 [J]. 中国临床解剖学杂志, 2021, 39(5): 563-568.
[30] Xuan C, Xi Y M, Zhang Y D,. Yiqi Jiedu Huayu Decoction alleviates renal injury in rats with diabetic nephropathy by promoting autophagy [J]., 2021, 12: 624404.
[31] 朱菲, 吴梅, 孔向军, 等. 金线莲干预2型糖尿病的“关键成分-潜在靶标-核心通路”网络挖掘及实验验证[J]. 中草药, 2022, 53(12): 3720-3729.
[32] 杨洁, 王宝西. IRS-2 siRNA对肾母细胞瘤G401细胞增殖的影响及其分子机制 [J]. 山西医科大学学报, 2016, 47(9): 813-817.
[33] Zhang C T, Huang C C, Yang P P,. Eldecalcitol induces apoptosis and autophagy in human osteosarcoma MG-63 cells by accumulating ROS to suppress the PI3K/Akt/ mTOR signaling pathway [J]., 2021, 78: 109841.
[34] Yang L, Lv Q, Liu J,. miR-431 regulates granulosa cell function through the IRS2/PI3K/AKT signaling pathway [J]., 2020, 66(3): 231-239.
[35] Mao N H, Gao D, Hu W H,. Oncogenic ERG represses PI3K signaling through downregulation of IRS2 [J]., 2020, 80(7): 1428-1437.
[36] 姚凤云, 张蓉, 左铮云, 等. 加味温胆汤调控INSR/PI3K/Akt/GLUT4信号通路抗雄性幼鼠营养性肥胖机制研究 [J]. 中华中医药学刊, 2021, 39(9): 1-4.
[37] Lee H J, Feliers D, Barnes J L,. Hydrogen sulfide ameliorates aging-associated changes in the kidney [J]., 2018, 40(2): 163-176.
[38] Gao L Y, Yuan P P, Zhang Q,. Taxifolin improves disorders of glucose metabolism and water-salt metabolism in kidney via PI3K/AKT signaling pathway in metabolic syndrome rats [J]., 2020, 263: 118713.
[39] Lin F M. Molecular regulation and function of FoxO3 in chronic kidney disease [J]., 2020, 29(4): 439-445.
[40] Zhao C M, Gu Y B, Chen L Y,. Upregulation of FoxO3a expression through PI3K/Akt pathway attenuates the progression of lupus nephritis in MRL/lpr mice [J]., 2020, 89(Pt A): 107027.
[41] Chen C, Tan H, Bi J,. LncRNA-SULT1C2A regulates Foxo4 in congenital scoliosis by targeting rno-miR-466c-5p through PI3K-ATK signalling [J]., 2019, 23(7): 4582-4591.
[42] Lin S J, Chiang M C, Shih H Y,. Spatiotemporal expression of foxo4, foxo6a, and foxo6b in the developing brain and retina are transcriptionally regulated by PI3K signaling in zebrafish [J]., 2017, 227(3): 219-230.
[43] Su B, Gao L Q, Baranowski C,. A genome-wide RNAi screen identifies FOXO4 as a metastasis-suppressor through counteracting PI3K/AKT signal pathway in prostate cancer [J]., 2014, 9(7): e101411.
[44] 周琦, 朱向东, 仝小林, 等. 葛根芩连汤对2型糖尿病模型大鼠胰岛细胞IRS-2/PI3K-Akt通路的影响 [J]. 中医杂志, 2018, 59(11): 973-977.
[45] 陆梓华, 吕雄, 曹明满, 等. 舒正颗粒对2型糖尿病大鼠糖脂代谢异常PI3K/AKT信号通路的影响 [J]. 广州中医药大学学报, 2020, 37(1): 128-134.
Mechanism of Compound Xianchao Granules on inhibiting epithelial mesenchymal transformation in diabetic nephropathy podocytes based on IRS2/ PI3K/FOXO4 signaling pathway
LIU Dan-ning1, HUANG Guo-dong2, YANG Xin-yong1, ZHOU Chang-yan1, WANG Ya-nan1
1. Guangxi University of Chinese Medicine, Nanning 530000, China 2. Guangxi International Zhuang Medicine Hospital, Nanning 530000, China
To investigate the mechanism of Compound Xiancao Granules (复方仙草颗粒) on inhibiting epithelial-mesenchymal transition (EMT) of renal podocytes in diabetic nephropathy (DN) rats based on insulin receptor substrate 2 (IRS2)/phosphatidylinositol-3-kinase (PI3K)/forkhead box O4 (FOXO4) signaling pathway.DN model rats were prepared by unilateral nephrectomy, high sugar and high fat diet and one-time ip streptozocin, control group and sham-operated group were set up. Successfully modeled rats were randomly divided into model group, irbesartan (15.75 mg/kg) group, Compound Xiancao Granules low-, medium- and high-dose (315, 472.5, 945 mg/kg) groups, and each administration group was ig corresponding drugs for six weeks. Fasting blood glucose, kidney index (KI), urinary albumin-to-creatinine ratio (UACR) and blood urea nitrogen (BUN) of rats in each group were measured; Hematoxylin-eosin (HE) staining was used to observe histopathology changes in renal; Transmission electron microscopy was used to observe ultrastructural changes in renal pedicle cells; qRT-PCR and Western blotting were used to detect mRNA and protein expressions of,, α-smooth muscle actin (),, fibroblast specific protein-1 () and IRS2/PI3K/FOXO4 signaling pathway related factors.Compared with control group, KI, UACR and BUN in model group were significantly increased (< 0.05); Glomerular hypertrophy, extensive tubular dilatation, epithelial cell degeneration and shedding, fusion or loss of peduncle were observed; Nephrin and P-cadherin expressions in renal were significantly decreased (< 0.05), α-SMA, Desmin and FSP-1 expressions were significantly increased (< 0.05), mRNA and protein expressions of IRS2/PI3K/ FOXO4 signaling pathway related factors were significantly decreased (< 0.05). Compared with model group, KI, UACR and BUN in Compound Xiancao Granules groups were significantly decreased (< 0.05), renal pathological structure and podocyte ultrastructure were significantly improved; Nephrin and P-cadherin expressions in renal were significantly increased (< 0.05), α-SMA, Desmin and FSP-1 expressions were significantly decreased (< 0.05), mRNA and protein expressions of IRS2/PI3K/FOXO4 signaling pathway related factors were significantly increased (< 0.05).Compound Xiancao Granules can improve kidney function in DN rats by regulating IRS2/PI3K/FOXO4 signaling pathway, inhibit EMT of podocytes in DN rats and reduce podocyte injury.
Compound Xiancao Granules; diabetic nephropathy; podocytes; epithelial-mesenchymal transformation; insulin receptor substrate 2/phosphatidylinositol-3-kinase/forkhead box O4 signaling pathway
R285.5
A
0253 - 2670(2022)21 - 6795 - 10
10.7501/j.issn.0253-2670.2022.21.017
2022-07-04
国家自然科学基金资助项目(81960913);广西中医药大学2021年研究生教育创新计划项目区级课题(YCSW2021235)
刘丹宁,硕士,从事中西医结合治疗肾脏疾病研究。Tel: 15878778767 E-mail: 353580454@qq.com
黄国东,博士,教授,博士生导师,从事中西医结合治疗肾脏疾病研究。Tel: 13768372258 E-mail: 644781538@qq.com
[责任编辑 李亚楠]

