外源H2O2预处理对垂盆草抗寒性及药材产量和品质的影响
赖秋洁,崔运启,朱再标,晏梦恬,成 琳,韩佳沛
外源H2O2预处理对垂盆草抗寒性及药材产量和品质的影响
赖秋洁,崔运启,朱再标*,晏梦恬,成 琳,韩佳沛
南京农业大学 中药材研究所,江苏 南京 210095
探索外源过氧化氢(hydrogen peroxide,H2O2)预处理对垂盆草抗逆性及药材产量和品质的影响,为逆境信号物质诱导药材高产优质的栽培模式提供依据。垂盆草叶面喷施不同浓度(0、1、10、100 mmol/L)H2O2后经历自然低温,收获时测定生长指标、生物量、多种黄酮类成分含量及多种体外抗氧化能力。在低温条件下,喷施H2O2均显著提高垂盆草最大分枝长、叶片层数、分枝数、生物量、多种黄酮类成分含量以及体外抗氧化能力。随外源H2O2浓度提高,垂盆草叶片层数、分枝数、新生芽数、生物量及过氧化物酶(peroxidase,POD)酶活性呈下降趋势,而超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)酶活性及丙二醛(malondialdehyde,MDA)含量呈上升趋势。1、10 mmol/L H2O2处理的生物量分别比对照提高209.38%和87.50%。总黄酮、总酚酸含量以及槲皮素、山柰酚、异鼠李素含量均以10 mmol/L H2O2处理最高,比对照提高16.67%~37.84%,1 mmol/L H2O2处理次之。1 mmol/L H2O2处理垂盆草1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)和2,2′-联氮-双(3-乙基苯并噻唑啉-6-磺酸)二铵盐[2,2′-azino-bis (3-ehtylbenzothiazolin-6-sulfnic acid),ABTS]自由基清除能力最强,而羟基自由基清除能力和抗脂质过氧化能力以10 mmol/L H2O2处理最强。在低温条件下H2O2预处理有利于提高垂盆草抗寒性及药材产量和品质;综合比较生物量及活性成分含量,1或10 mmol/L H2O2预处理利于提高垂盆草抗寒性,高产优质兼得。
垂盆草;诱导抗性;抗氧化;低温胁迫;逆境;过氧化物酶;超氧化物歧化酶;过氧化氢酶;丙二醛
过氧化氢(hydrogen peroxide,H2O2)是植物在正常有氧代谢过程中产生的一种相对稳定的活性氧。它一方面是引起细胞氧化损伤破坏的毒性分子,另一方面是一种重要的信号分子,参与植物防御系统对逆境的响应调控,缓解逆境对植物的胁迫[1-2]。它在增强植物应激耐受性方面发挥重要作用,如外施H2O2能提高裸燕麦对干旱胁迫的耐性[3],增强柑橘叶片对低温的抗性[4]。另一方面,H2O2也可调节植物的次生代谢,如提高黄芩植株苷元类成分含量,提高其药材质量[5]。药用植物中许多活性成分的生态功能之一即是应对逆境导致的氧化胁迫,因此,将外源H2O2应用于药用植物生产,在诱导提高药用植物抗逆性的同时提高其药用品质,减少生产损失,同时实现高产优质,对于药材生产具有较高的应用价值。但目前外源H2O2应用于药用植物抗逆性的研究鲜见报道。
垂盆草Bunge为景天科景天属多年生草本植物。具有利湿退黄、清热解毒功效,用于湿热黄疸、小便不利、痈肿疮疡[6],可用于治疗肝炎、咽喉肿痛、疖痈、湿热黄疸等。垂盆草含有黄酮、三萜、氰苷类等成分,在观赏、环保、医药和食用方面均具潜在价值[7]。目前,对垂盆草的研究多集中在化学成分、药理作用和应用开发等方面[8-12],栽培方面[13-14]也有一些研究,鲜见外源信号物质如H2O2对垂盆草药材品质及抗氧化活性影响的报道。
冷害是一类对植物具有重大影响的非生物胁迫因子,它不仅影响植物的生长、导致植物产量降低,严重时甚至会造成植物死亡。低温胁迫下许多植物(包括垂盆草)叶片变黄、萎蔫,生长受到抑制,最终制约药材产量和品质。槲皮素、山柰素、异鼠李素3种黄酮类物质是《中国药典》2020年版垂盆草药材指标性成分,均具有较强的抗氧化作用,其含量在干旱条件下显著提高[14]。因此,基于H2O2的生物学功能及槲皮素等3种黄酮类物质的抗氧化作用,本研究提出假设:通过外源H2O2预处理,可提高垂盆草的抗寒性并提高其槲皮素、山柰素、异鼠李素等黄酮类成分的含量。本研究通过盆栽试验,比较不同浓度外源H2O2预处理对低温条件下垂盆草生长发育和药材品质的影响,以期通过外源H2O2喷施减轻低温对垂盆草生长和产量的不利影响,并提高其药材质量,为建立逆境信号物质诱导药材高产优质栽培模式提供依据。
1 材料
试验材料栽培于南京农业大学中药材研究所试验大棚,经郭巧生教授鉴定为景天科景天属植物垂盆草Bunge。
2 方法
2.1 样品的处理
2020年6月,选取健康、长势均一的垂盆草茎段(4个茎节),去侧芽和顶芽,种植于试验大棚塑料花盆(直径15.0 cm,高12.1 cm,底径10.6 cm)中,每盆5株。试验用土为营养土-园土1∶3(体积比),前期统一养护的光照强度控制在60%左右,适宜水分控制在田间持水量的75%左右。于10月18日开始处理,4个处理 [对照(CK)、T1、T10、T100] 分别喷施0、1、10、100 mmol/L H2O2,然后经历自然低温。每个处理7盆。实验期间10、11、12月平均气温分别为17、12.5、4.5 ℃,日最高温和最低温变化见图1。每隔7 d喷施1次相应浓度的H2O2,对照处理为喷施相同体积的纯净水。各处理喷施量相同,以叶片滴水为度。随机排列,试验过程中每周随机变换位置。于2021年1月3日收获并测定各项指标。

图1 实验期间日最高温和最低温变化
2.2 生长指标测定
收获时每处理组中选取具有代表性的18株垂盆草进行标记,记录分枝数、新生芽数、叶片层数,直尺和游标卡尺测其最大分枝长、叶长、叶宽。
2.3 生物量测定
收获时每处理随机挑选18株,测定鲜质量。将植株样品于105 ℃杀青后,将植株样品于60 ℃烘干至恒定质量,称取干质量,之后粉碎过3号筛备用。
根冠比=地下干质量/地上干质量
折干率=干质量/鲜质量
2.4 抗氧化酶活性和丙二醛(malondialdehyde,MDA)含量测定
分别从各处理组中随机选取长势相似代表性植株,选取植株中成熟饱满叶片测定其生理指标。参考高俊山等[15]的方法,取0.5 g垂盆草相同部位的成熟叶片至预冷研砵,加入8 mL预冷的0.05 mmol/L磷酸缓冲液(pH 7.8),冰浴研磨后离心(4 ℃,8500 r/min,10 min),上清液即为酶提液。超氧化物歧化酶(superoxide dismutase,SOD)活性采用氮蓝四唑法,过氧化物酶(peroxidase,POD)活性采用愈创木酚法,过氧化氢酶(catalase,CAT)活性采用紫外分光光度法[16], MDA采用硫代巴比妥酸法。每个处理测定3次。
2.5 化学成分指标测定
总黄酮含量测定时取垂盆草粉末适量,按料液比1∶25加入50%乙醇,60 ℃超声提取40 min,过滤,加50%乙醇定容至10 mL,以芦丁为对照品,510 nm波长处吸光度,采用亚硝酸钠-硝酸铝比色法[17]测定。总酚含量测定时取垂盆草粉末适量加蒸馏水回流提取2 h,滤液经旋转蒸发仪浓缩,用蒸馏水定容至10 mL,以没食子酸为对照品,采用 Folin-Ciocalteu法[18]测定。槲皮素、山柰素、异鼠李素含量参照《中国药典》2020年版[6]HPLC法测定。
2.6 体外抗氧化能力测定
将垂盆草粉末加蒸馏水回流提取2 h,滤液经旋转蒸发仪浓缩,用蒸馏水定容至10 mL,置4 ℃冰箱保存,测定抗氧化活性时稀释至500 μg/mL。采用 DPPH、ABTS等方法,进行垂盆草抗氧化能力评价[19],以维生素C(Vc)为对照。
2.6.1 1,1-二苯基-2-三硝基苯肼自由基(DPPH·)清除率的测定 精密称取DPPH试剂0.024 0 g,无水乙醇溶解定容至100 mL,得DPPH溶液,避光保存。试管1(1)中加去离子水、DPPH溶液各4 mL;试管2(2)中加垂盆草提取液(500 μg/mL)、DPPH溶液各4 mL;试管3(3)中加垂盆草提取液(500 μg/mL)与去离子水各2 mL。静置30 min后于517 nm处测定试管1、2、3的吸光度值,分别为1、2、3值。计算垂盆草清除DPPH·的清除率(SA)。
SA=[1-(2-3)]/1
2.6.2 2,2′-联氮-双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS+)自由基清除率()的测定 首先配制7 mmol/L的ABTS溶液,140 mmol/L的过硫酸钾溶液,按10∶1混合成ABTS混合液,静置过夜。用无水乙醇将混合液稀释至在734 nm处的值为(0.700±0.05),备用。在试管中加入1 mL提取液(空白溶液、样品溶液、样品溶液本底溶液),再加入4 mL的ABTS工作液,混合,静置6 min,在405 mm处测定值,实验平行测3次。计算值。
=0-(A-A)/0
0为空白对照的值;A为加入样品溶液后的值;A为不加H2O2的样品溶液本底的值
2.6.3 羟基自由基的清除率的测定 取2 mmol/L的硫酸亚铁溶液1 mL,6 mmol/L H2O21 mL,6 mmol/L水杨酸-乙醇溶液1 mL,加入垂盆草提取液(500 μg/mL)1 mL,放置30 min,在510 nm处测定值,计算羟自由基OH−(·OH)的清除率。实验平行测3次。根据公式计算值。
2.6.4 硫氰酸铁(FTC)法检测抗脂质过氧化能力 参照Kim等[18]方法,取不同处理的垂盆草黄酮溶液各4 mL,分别放入加塞试管中,加入4.1 mL 2.5%亚油酸(乙醇配制)、8 mL磷酸缓冲液(0.05 mol/L,pH7.0)和3.9 mL去离子水,密封,并放置40 ℃恒温箱中保存。24 h后,取40 ℃恒温箱中的培养液各0.1 mL,分别加入9.7 mL 75%乙醇溶液、0.1 mL 30%硫氰酸铵溶液,然后再加入0.1 mL 0.02 mol/L氯化亚铁溶液(3.5% HCl配制),准确反应3 min,于500 nm下测定值。
2.7 数据分析
数据采用Excel 2019和SPSS21.0进行统计与分析,不同处理相同指标进行LSD法进行多重比较。不同小写字母表示差异显著(<0.05)。
3 结果与分析
3.1 低温条件下外源H2O2喷施对垂盆草生长指标的影响
外源H2O2喷施处理对垂盆草的叶宽、叶长影响不显著(表1)。在低温条件下,喷施H2O2的垂盆草最大分枝长、叶片层数、分枝数均显著高于CK。随外源喷施H2O2浓度升高,垂盆草最大分枝长、叶片层数、分枝数、新生芽数呈下降趋势。其中T1处理生长优势明显,最大分枝长、叶片层数、分枝数、新生芽数最高,分别比T100处理增加35.53%、27.83%、25.36%和27.89%,T10处理居中。在低温条件下,喷施H2O2有利于提高垂盆草抗寒性,减轻低温对垂盆草生长的抑制作用,其中T1、T10处理优势更明显。
表1 外源H2O2喷施处理对垂盆草植株形态的影响(, n = 18)
同列不同小写字母表示差异显著,<0.05;CK代表对照,T1、T10、T100分别代表不同浓度(1、10、100 mmol/L)H2O2,下同
Different lowercase letters in the same column indicate significant difference (<0.05). CK means control, and T1, T10 and T100 mean H2O2of different concentrations (1, 10 and 100 mmol/L), same as below
3.2 低温条件下外源H2O2喷施对垂盆草生物量的影响
在低温条件下,喷施H2O2的垂盆草单株鲜质量、干质量显著高于CK,折干率没有显著差异(表2)。随着H2O2浓度升高,垂盆草单株鲜质量、干质量呈下降趋势,根冠比呈上升趋势。单株干质量以T1处理最高,T10处理次之,分别比CK提高209.38%和87.50%。T1的根冠比显著低于其他处理。在低温条件下喷施H2O2,尤其较低浓度H2O2,有利于垂盆草生物量积累。
3.3 低温条件下外源H2O2喷施对垂盆草抗氧化酶活性和MDA含量的影响
低温条件下各外源H2O2喷施处理均显著提高SOD和CAT活性,降低MDA含量。T1处理的POD活性显著高于CK,而T10和T100处理显著低于CK(表3)。3个H2O2浓度处理中,T1处理的SOD和CAT活性最低,而T100处理最高。T100的SOD和CAT活性分别比T1提高了14.77%和15.90%。而POD活性的变化趋势与之相反。
各外源H2O2喷施处理均显著降低MDA含量。随着H2O2浓度升高,MDA含量呈升高趋势,且各处理间差异达到显著水平,其中T1处理的MDA含量仅为CK的51.03%,分别是T10和T100处理的68.48%和63.95%。
3.4 低温条件下外源H2O2喷施对垂盆草品质的影响
低温条件下外源H2O2喷施处理对垂盆草总黄酮、总酚含量影响显著,均显著高于对照处理(CK)。总黄酮、总酚酸含量随H2O2量提高呈先升后降趋势,最高值均出现在T10处理(分别为1.49、6.01 mg/g),比CK分别提高20.16%、37.84%。T1和T10处理的总黄酮含量差异不显著(图2)。
低温条件下喷施H2O2有利于垂盆草槲皮素、山柰酚和异鼠李素积累,随外源H2O2量提高,槲皮素、山柰酚和异鼠李素含量整体呈先升后降趋势(表4)。槲皮素、山柰酚和异鼠李素量最高值均出现在T10处理(喷施10 mmol/L H2O2),分别比对照提高了34.92%、16.67%、35.00%,其中槲皮素和异鼠李素均显著高于其他处理,而T10和T1处理的山柰酚量差异不显著。
表2 外源H2O2喷施处理对垂盆草生物量的影响(, n = 18)
表3 外源H2O2处理对垂盆草抗氧化酶活性和MDA含量的影响(, n = 18)
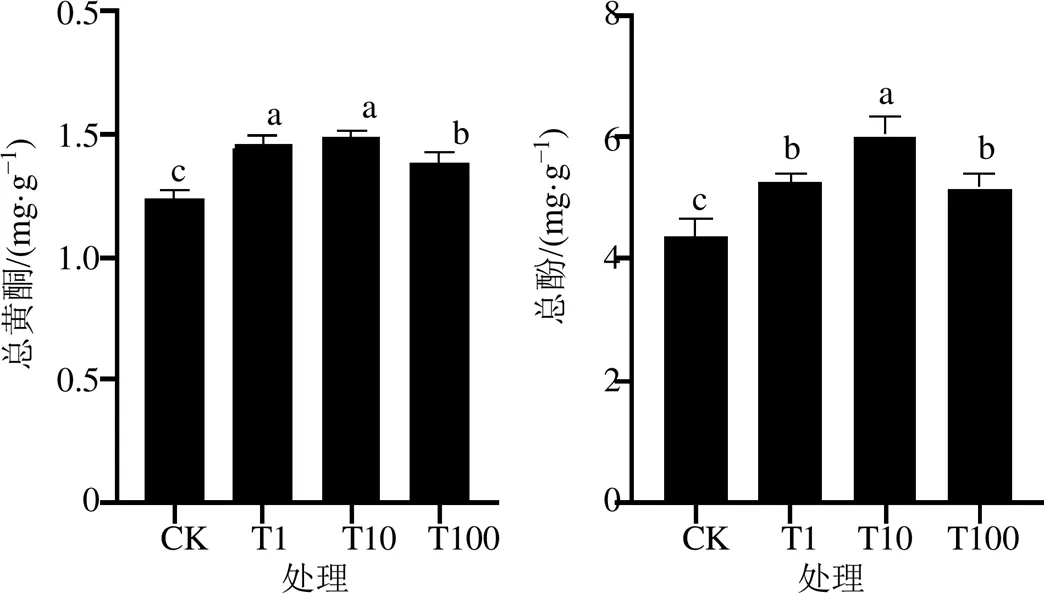
图2 外源H2O2处理处理对垂盆草水提物总黄酮和总酚含量的影响(, n = 3)
3.5 低温条件下外源H2O2喷施对垂盆草体外抗氧化能力的影响
生长过程中经过不同浓度外源H2O2喷施处理的垂盆草,干燥后其水提物的体外抗氧化能力见表5。不同处理的DPPH·清除率具有较大差异,以T10处理最高,为46.06%,显著高于其他浓度H2O2处理,比CK高13.01%;T1次之,为41.60%。4组处理的DPPH·清除作用均弱于Vc组。ABTS+法测得的自由基清除能力在各处理中的变化与DPPH·清除能力一致。各处理的·OH清除率差异均达到显著水平。以T1处理最高,为76.45%,T2次之,CK最低。·OH清除率高低顺序为T1处理>T10处理>T100处理>CK处理。4组H2O2处理的·OH清除作用均弱于Vc组。
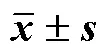
表4 外源H2O2处理对垂盆草黄酮类成分含量的影响(, n = 3)
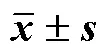
表5 外源H2O2处理对垂盆草水提物体外抗氧化活性的影响(, n = 3)
FTC法测得T1处理的吸光度低于其他处理,表明T1处理抗脂质过氧化能力强于其他处理,但和T10处理差异不显著。CK的吸光度最高,显著高于H2O2处理。
4 讨论
4.1 低温条件下外源H2O2对垂盆草抗寒性的影响
H2O2在植物受到低温胁迫时具有重要信号调控功能[20];在对低温胁迫的响应中,低浓度H2O2可作为信号分子诱发防御反应,提高油菜种子的低温耐受能力[21],增强水稻幼苗的抗寒性[22]。
本研究结果表明,外源H2O2喷施处理垂盆草新生芽数、枝条、叶片层数、干质量、鲜质量等指标显著优于对照处理组。试验中施加低浓度即T1、T10处理(浓度分别为1、10 mmol/L)H2O2处理不同程度提高垂盆草的生物量、新生芽数、枝条、叶片层数、最长分枝长。与蒋景龙等[23]在大红柑上的研究结果相似。表明外源H2O2能够缓解低温胁迫对垂盆草的生长抑制,尤其较低浓度H2O2。H2O2对低温条件下垂盆草的促进作用可能是因为在低浓度下,H2O2对植物的同化、光合作用、呼吸、气孔导度、渗透压的积累、ABA水平的调节和酶的抗氧化活性的增强起着重要的调节作用[24]。
万林等[25]研究表明外源H2O2处理可通过诱导抗氧化物质积累,激活抗氧化酶活性等途径增强油菜幼苗的抗寒性。本研究发现低温条件下各外源H2O2喷施处理均显著提高SOD和CAT活性,降低MDA含量。随着H2O2浓度升高,MDA量呈升高趋势,且各处理间差异达到显著水平,这与油菜[25]、柑橘[4]的相关研究结果类似。表明外源H2O2可以提高垂盆草SOD和活性,降低细胞膜质过氧化程度,减轻低温胁迫的伤害,从而增强垂盆草的抗寒性。
4.2 低温条件下外源H2O2对垂盆草品质的影响
H2O2除了具有潜在的催化作用外,还在苯丙烷途径中充当重要的信号分子,激活苯丙氨酸解氨酶、肉桂酸-4-羟基化酶和4-香豆酰-辅酶A连接酶的活性,从而促进木质素的生物合成[26]。H2O2可以显著提高大叶榕[27]的抗氧化活性,促进黄芩苯丙氨酸解氨酶(phenylalanineammonialyase,和β-葡萄糖苷酸酶基因表达,提高了PAL活性,促进了黄酮类成分的生物合成和苷元类成分的转化[5]。
本研究结果显示,低温条件下外源H2O2喷施处理对垂盆草总黄酮、总酚含量影响显著,均显著高于对照处理CK。总黄酮、总酚酸含量随H2O2浓度的提高,整体呈先升后降趋势,最高值均出现在 T10处理(10 mmol/L H2O2)。随H2O2浓度的提高,槲皮素、山柰素和异鼠李素含量整体呈先升后降趋势,最高值均出现在10 mmol/L H2O2处理。说明低温条件下喷施H2O2有利于垂盆草黄酮类成分积累,其中10 mmol/L H2O2处理促进效果最佳。在组培或非逆境环境下前人有类似研究结果,如低浓度H2O2提高了远志愈伤组织次生代谢产物总酚、总黄酮含量[28],增强黄芩基因表达和活性,促进黄酮类成分积累,尤其是苷元类成分,提高了黄芩药材的质量[5],提高了五味子抗氧化酶活性并促进五味子木脂素类成分的生物合成[29]。
药用植物中黄酮类化合物不仅作为药效成分治疗人类疾病,还保护植物机体本身。黄酮类化合物具有广泛功能,如抗氧化活性、紫外线防护、抵抗植物病原体等[30]。槲皮素和异鼠李素等垂盆草活性成分具有较强的抗氧化性,可能是植物细胞内抵御环境胁迫的抗氧化体系的组成部分。因此,逆境或人为添加的逆境信号物质可诱导这类成分合成积累。
孟祥才等[31]提出了道地药材质量形成活性氧(reactive oxygen species,ROS)机制的假说:生态胁迫通过ROS的作用导致植物次生代谢发生改变,ROS是道地药材质量形成的本质因素之一。在较适宜的环境条件下,在采收前的适宜时间内,可通过增施一定量ROS进行人为干扰来达到药材优质高产的目的。本研究表明,在逆境条件下对垂盆草预处理H2O2还可提高其抗逆性。因此,在逆境下施用H2O2可能是提高药用植物抗逆性同时提高其产量和品质的有效途径。H2O2安全性强,最终分解为水和氧气,是法定的食品添加剂,因此H2O2作为一种促进药用植物增产提质的外源添加物质,具有广泛的应用前景。
体外抗氧化能力与黄酮类、酚酸类成分含量关系密切[32-33]。本研究发现,垂盆草ABTS、DPPH 自由基清除能力与总酚酸、槲皮素含量的趋势一致,最高值均出现在10 mmol/L H2O2处理。羟自由基清除率,以T1处理最大,为76.45%,随H2O2浓度的提高,呈下降趋势。表明说明低温条件下喷施较低浓度H2O2(1或10 mmol/L)有利于增强垂盆草体外抗氧化能力。
综上所述,在低温条件下喷施H2O2有利于减轻低温对垂盆草生长的不利影响,促进黄酮类次生代谢产物积累,从而提高垂盆草药材质量。综合比较各处理生长生理指标、生物量、化学成分含量及抗氧化能力,在低温条件下喷施1或10 mmol/L H2O2时,垂盆草药材高产和优质可兼得,同时具有较高的抗氧化活性。外源H2O2对于具有较强抗氧化活性化学成分的积累是否具有普遍效果,有待于进一步研究。笔者前期研究发现外源H2O2可提高垂盆草的保肝活性,本研究涉及处理的药理作用研究尚在进行中。
利益冲突 所有作者均声明不存在利益冲突
[1] Hossain M A, Bhattacharjee S, Armin S M,. Hydrogen peroxide priming modulates abiotic oxidative stress tolerance: Insights from ROS detoxification and scavenging [J]., 2015, 6: 420.
[2] 刘建新, 欧晓彬, 王金成, 等. 镉胁迫下裸燕麦幼苗对外源H2O2的生理响应 [J]. 草业学报, 2020, 29(1): 125-134.
[3] 刘建新, 欧晓彬, 王金成. 外源H2O2对干旱胁迫下裸燕麦幼苗叶片生理特性的影响 [J]. 干旱地区农业研究, 2019, 37(4): 146-153.
[4] 蒋景龙. 外源H2O2对低温胁迫下柑橘叶片抗寒性的影响 [J]. 西北植物学报, 2016, 36(3): 499-505.
[5] 付晓莹, 郭慧敏, 丛薇, 等. 外源H2O2对黄芩次生代谢调控及道地质量形成机制研究 [J]. 中国中药杂志, 2018, 43(2): 281-287.
[6] 中国药典 [S]. 一部. 2020: 126.
[7] 宋玉华, 李春雨, 郑艳. 垂盆草的研究进展 [J]. 中药材, 2010, 33(12): 1973-1976.
[8] 兰扬, 姜红, 张仕瑾, 等. 不同产地垂盆草中有效成分对比研究[J]. 亚太传统医药, 2020, 16(5): 50-52.
[9] 姚晓敏, 陈磊, 孙梦贤, 等. 垂盆草对四环素所致非酒精性脂肪性肝病的保护作用 [J]. 药学研究, 2018, 37(8): 439-442.
[10] Bai Y H, Lu H, Zhang G,.Bunge extract exerts renal anti-fibrotic effectsand[J]., 2014, 105(1/2): 22-30.
[11] 潘金火, 潘萍. 垂盆草总黄酮的保肝降酶作用及其化学成分的鉴别研究 [J]. 时珍国医国药, 2010, 21(8): 1930-1934.
[12] 蒋志涛, 王雪, 王建春, 等. 垂盆草总黄酮及异鼠李素对对乙酰氨基酚诱导的L02细胞损伤的保护作用 [J]. 中国实验方剂学杂志, 2018, 24(6): 121-125.
[13] 朱再标, 杨金凤, 郭巧生, 等. 不同光强对垂盆草生长和药材品质及抗氧化活性的影响 [J]. 中国中药杂志, 2018, 43(22): 4404-4409.
[14] 杨金凤, 郭巧生, 朱再标, 等. 不同水分梯度下垂盆草生长发育、品质及抗氧化活性关系研究 [J]. 中草药, 2018, 49(14): 3382-3388.
[15] 高俊山, 蔡永萍. 植物生理学实验指导 [M]. 第2版. 北京: 中国农业大学出版社, 2018: 53.
[16] 高俊凤. 植物生理学实验指导 [M]. 北京: 高等教育出版社, 2006: 23.
[17] Chen Y J, Wang J, Wan D R. Determination of total flavonoids in threecrude drugs by UV-Vis spectrophotometry [J]., 2010, 6(24): 259-263.
[18] Kim C Y, Lee M Y, Park I S. Antioxidant activities of fractions from[J]., 2006, 11(1): 6-9.
[19] 唐赟. 药学专业实验教程 [M]. 上海: 华东理工大学出版社, 2010: 263.
[20] 刘零怡, 赵丹莹, 郑杨, 等. 植物在低温胁迫下的过氧化氢代谢及信号转导 [J]. 园艺学报, 2009, 36(11): 1701-1708.
[21] 张曼, 戴蓉, 张顺凯, 等. H2O2浸种对油菜种子低温萌发的缓解效应 [J]. 南京农业大学学报, 2017, 40(6): 963-970.
[22] 韩娜, 冯汉青, 李燕鸿, 等. 外源H2O2对水稻幼苗抗寒性的调节作用 [J]. 西北植物学报, 2009, 29(6): 1214-1219.
[23] 蒋景龙, 沈季雪, 徐卫平, 等. 外源H2O2对低温胁迫下大红柑生长及叶片生理指标的影响 [J]. 浙江农业学报, 2016, 28(7): 1164-1170.
[24] Iqbal H, Yaning C, Waqas M,. Hydrogen peroxide application improves quinoa performance by affecting physiological and biochemical mechanisms under water-deficit conditions [J]., 2018, 204(6): 541-553.
[25] 万林, 张曼, 钟飞燕, 等. H2O2浸种处理对晚直播油菜苗期耐寒性的影响 [J]. 中国油料作物学报, 2015, 37(6): 811-819.
[26] Li D, Limwachiranon J, Li L,. Hydrogen peroxide accelerated the lignification process of bamboo shoots by activating the phenylpropanoid pathway and programmed cell death in postharvest storage [J]., 2019, 153: 79-86.
[27] Nurnaeimah N, Mat N, Suryati Mohd K,. The effects of hydrogen peroxide on plant growth, mineral accumulation, as well as biological and chemical properties of[J]., 2020, 10(4): 599.
[28] 曹福麟, 胡本祥, 彭亮, 等. H2O2对远志愈伤组织中总酚总黄酮含量及相关酶活性的影响 [J]. 中国实验方剂学杂志, 2019, 25(20): 153-159.
[29] 丛薇, 郭慧敏, 付晓莹, 等. H2O2对五味子鲜果次生代谢影响及机制研究 [J]. 中药材, 2018, 41(3): 535-539.
[30] 许永华, 卫宝瑞, 佐月, 等. 低温影响药用植物次生代谢产物积累研究进展 [J]. 分子植物育种, 2022, 20(5): 1708-1715.
[31] 孟祥才, 王喜军. 活性氧促进道地药材质量形成的假说及其探讨 [J]. 中草药, 2011, 42(4): 799-804.
[32] Wojdyło A, Oszmiański J, Czemerys R. Antioxidant activity and phenolic compounds in 32 selected herbs [J]., 2007, 105(3): 940-949.
[33] 袁亚男, 陈承瑜, 杨滨, 等. 31种黄酮、酚酸类化合物和10种中药清除DPPH能力考察 [J]. 中国中药杂志, 2009, 34(13): 1695-1700.
Exogenous H2O2pretreatment improve cold resistance, yield and quality of
LAI Qiu-jie, CUI Yun-qi, ZHU Zai-biao, YAN Meng-tian, CHENG Lin, HAN Jia-pei
Institute of Chinese Medicinal Materials, Nanjing Agricultural University, Nanjing 210095, China
To explore the effects of exogenous hydrogen peroxide (H2O2) pretreatment on the adversity resistance and the yield and quality of, and to provide a basis for the high-yield and high-quality cultivation model ofinduced by stress signal substances.After foliage-spraying with different concentrations of H2O2(0, 1, 10, 100 mmol/L) on, it experienced natural low temperature, and the growth index, biomass, content of various flavonoids and variousantioxidant capacity were measured at harvest.Under low temperature conditions, spraying H2O2significantly increased the maximum branch length, leaf layers, number of branches, biomass, content of various flavonoids, andantioxidant capacity. With the increase of the concentration of exogenous H2O2, the number of leaf layers, branches, number of new buds, biomass and peroxidase (POD) enzyme activity showed a downward trend, while enzyme activities of superoxide dismutase (SOD) and catalase (CAT) as well as malondialdehyde (MDA) content showed an upward trend. The biomass of 1 mmol/L H2O2and 10 mmol/L H2O2treatments increased by 209.38% and 87.50%, respectively compared with control.The content of total flavonoids, total phenolic acids, quercetin, kaempferol, and isorhamnetin were the highest when treated with 10 mmol/LH2O2, which was 16.67%—37.84% higher than the control, followed by treatment with 1 mmol/LH2O2. Thetreated with 1 mmol/LH2O2showed have the strongest free radical scavenging ability with 1, 1-diphenyl-2-picrylhydrazyl (DPPH) and 2, 2′-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid) (ABTS) methods, while the hydroxyl radical scavenging ability and anti-lipid peroxidation ability are the strongest when treated with 10 mmol/LH2O2.H2O2pretreatment under low temperature conditions is beneficial to increase the cold resistance, yield and quality of; And 1 or 10 mmol/LH2O2pretreatment is suitable treatments after comprehensive evaluation.
Bunge; induced resistance; anti-oxidation; cold stress; stress; POD; SOD; CAT; MDA
R286.2
A
0253 - 2670(2022)21 - 6874 - 07
10.7501/j.issn.0253-2670.2022.21.026
2022-02-03
中央高校基本科研业务费专项资金资助(KYZZ201912)
赖秋洁(1996—),女,重庆北碚人,硕士研究生,主要研究方向为中药材规范化生产。
朱再标,教授,研究方向为中药材。Tel: (025)84395980 E-mail: zhuzaibiao@njau.edu.cn
[责任编辑 时圣明]

