新疆地区GIII.2型牛诺如病毒流行病学调查及ORF1基因遗传进化分析
马志刚,何 琴,施晨阳,刘馨博,郭雪萍,吴 静,马英才,苏战强,钟 旗,姚 刚,马雪连*
(1.新疆农业大学动物医学学院,新疆 乌鲁木齐 830052;2.新疆畜牧科学院兽医研究所,新疆 乌鲁木齐 830052)
牛诺如病毒(Bovine norovirus,BNoV)属于杯状病毒科,为无包膜单股正链RNA 病毒,呈20 面体结构,直径为27 nm~40 nm。BNoV 常感染犊牛,使其出现非出血性肠炎、吸附不良性腹泻、食欲下降及木糖吸收不良等临床症状,并伴有肠道病变,如萎缩性空肠炎,最终造成犊牛死亡[1]。目前GenBank中有5 个NoV 基因型,BNoV 属GIII 型,其有GIII.1、GIII.2 和GIII.3 等3 个基因型,该病毒基因组中有3个阅读框(Open reading frame,ORF),其中ORF1 编码P48、NTPase、P22、VPg、Pro 和RdRp,均为非结构蛋白[2];ORF2 编码主要衣壳蛋白,为VP1 结构蛋白,VP1 又包含两个主要的结构域:一个是保守的S 结构域,另一个是更具可变性的P 结构域;ORF3 编码次要结构蛋白VP2,它在BNoV 病毒颗粒中起着稳定作用[3]。目前研究发现,该病毒的基因重组多发生在ORF1 和ORF2。
目前在新疆地区关于BNoV 的研究较少,仅2020 年报道在87 份新疆地区的犊牛腹泻样品中检测出6 个阳性,阳性率为6.9%[4],暂时未见新疆地区BNoV 的全基因组序列的研究。为了进一步完善新疆地区BNoV 的基因型研究,本研究采用RT-PCR 方法对新疆部分地区开展了BNoV 感染的调查,并且对其ORF1 基因进行遗传进化和基因重组分析,填补了新疆地区对BNoV 基因序列研究的空白,为新疆地区BNoV 感染的防制提供参考依据。
1 材料与方法
1.1 主要实验材料TRIzol 购自Invitrogen,Hifair®III 1st Strand cDNA Synthesis Kit(gDNA digester plus)、MolPure®Plasmid Mini Kit 购自翌圣生物科技(上海)有限公司;2×TaqPCR Mix、Universal DNA Purification Kit、DH5α 感受态细胞均购自天根生化科技(北京)有限公司;pGEM®-T Easy Vector System I 购自Promega公司。
1.2 样品来源及处理230 份3 月龄犊牛粪便样品为2020 年7 月至2021 年6 月分别采自新疆乌鲁木齐、塔城、伊犁、喀什地区的牛场。将粪便样品按1∶3 的比例用1×PBS溶液稀释混匀后于-20 ℃反复冻融3次备用。
1.3 BNoV 流行病学调查参照GenBank 登录的BNoV 序列的RdRp 基因序列(MN480761.1),利用Primer 5.0设计引物:5′-ATCTCGCACGATGCCAAG-3′/5′-GTCATCTTCATTTACAAAATCGG-3′,扩增产物长度为342 bp,引物由上海生物工程有限公司合成。采用TRIzol 试剂/氯仿分层法提取1.2 中粪便样品RNA,利用Hifair®III 1st Strand cDNA Synthesis Kit(gDNA digester plus)将其反转录为cDNA,以其为模板,采用上述引物,利用PCR 方法检测粪便样品中BNoV,对检测结果根据区域因素分析新疆地区犊牛BNoV的感染情况。
1.4 BNoV ORF1 基因的PCR 扩增参照GenBank中BNoV 序 列 的ORF1 基 因(MN480761.1),利 用Primer 5.0 设计引物(表1),引物由上海生物工程有限公司合成。选取塔城地区两份阳性样品,按照1.3中方法获得模板后,利用表1 中引物分段扩增ORF1全基因序列,扩增产物由上海生物工程有限公司测序后,对测序结果使用SeqMan 5.08 拼接获得ORF1全基因序列。

表1 引物序列Table 1 Primer sequence
1.5 BNoV ORF1 基因序列分析参考NCBI 中20株NoV 各型ORF1 基因组序列,使用Clustal W 对获得的ORF1 全基因序列比对,然后采用MEGA 7.0 软件,neighbour-joining 法,Bootstrap method 1000 构 建进化树;利用DNAStar 软件中的MegAlign 对该ORF1基因序列与国内外的ORF1 基因序列分别进行核苷酸及氨基酸序列的同源性分析;利用Simplot 分析该ORF1重组情况。
2 结果与讨论
2.1 BNoV 流行病学调查结果由于RdRp 基因是BNoV 遗传与进化的重要基因之一[5],该基因较短,更易获得,所以常常被作为检测BNoV 时的靶基因。本研究以RdRp 基因保守区为目的片段,利用RT-PCR 技术对新疆4 个地区7 个牛场的230 份3 月龄犊牛粪便样品进行BNoV 流行情况检测,结果显示新疆地区230 份样品中共检测出41 份BNoV 阳性样品,阳性率为17.83%(41/230),部分粪便样品的PCR 检测结果见图1。其中乌鲁木齐地区阳性率0.26%(1/38),塔城地区阳性率60.00%(9/15),伊犁地区阳性率3.51%(2/57),喀什地区阳性率24.16%(29/120)。结果表明BNoV 在新疆地区广泛存在,且流行情况存在区域差异。犊牛BNoV 感染一方面与犊牛自身免疫力不足以及环境气候恶劣有关,另一方面与养殖场饲养管理不当也有一定关系[6],包括犊牛初乳饲喂不及时、抗寒措施不到位、疫病隔离不合理等[7]。本研究采样时发现塔城以及喀什地区牛场多建立在沙漠地带,存在自然环境差,水资源缺乏,水质差(硫含量较高),犊牛舍环境不达标,消杀程序不完善,新生犊牛初乳摄入量不足等问题,这些可能是造成这些区域BNoV 检出阳性率偏高的原因。而乌鲁木齐、伊犁均属于北疆地区,北疆环境相对于南疆更加适合养牛业的发展,且北疆地区兽医及养殖人员专业化程度更高,因此这些地区BNoV 的检出率低。

图1 部分样品的PCR检测结果Fig.1 PCR detection results of some samples
BNoV 流行较广,相继在比利时[8]、英国[9]、美国俄亥俄州[10]、韩国[11]、土耳其[12]、法国[13]等全球多个国家检出。在国内多个地区也已检出BNoV,且阳性率较高。师志海在2018年河南省8个腹泻样品中检测出2 份阳性,阳性率为25%[14]。王玥琳在2017 年~2018年对国内5 个省的BNoV 检出率分别是四川34.78%(8/23)、辽宁75.00%(12/16)、河南11.11%(3/27)、山东9.09%(1/11)和陕西0(0/16)[15]。王文佳于2017 年到2019 年对河南省BNoV 的检出率为9.96%(20/221)[16]。而新疆地区直到2020 年王玥琳在87 份犊牛腹泻样品中检测出6 个阳性,阳性率为6.9%,证实了BNoV在新疆地区的存在[2]。本实验对新疆地区流行病学调查结果也进一步说明BNoV 具有广泛的地区流行特征,且新疆多地犊牛感染了该病毒。
2.2 BNoV ORF1 基因的PCR 扩增及序列分析结果选取塔城两个BNoV 阳性样品,分别分段扩增BNoV ORF1 基因片段(图2),经拼接后ORF1 基因长度均为5 055 bp。分别命名为Bo/XJ-TC/2020/China(Gen-Bank: OK254099)和Bo/XJ- TC- 2/2021/China(Gen-Bank:OL304917)。
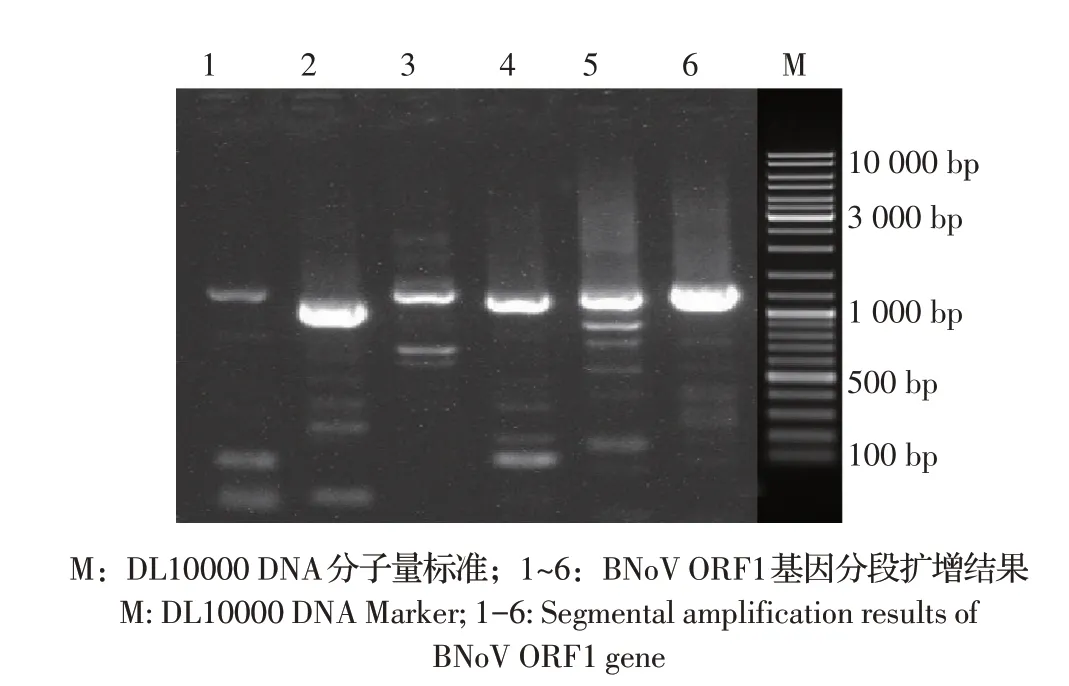
图2 ORF1基因的分段扩增结果Fig.2 Results of BNoV ORF1 gene amplification
分别与GenBank 中的20 株NoV ORF1 基因进行核苷酸序列对比,并构建进化树,结果显示,检测到的Bo/XJ-TC/2020/China 和Bo/XJ-TC-2/2021/China BNoV 与中国四川地区OK32546.1 病毒株位于一个分支(图3A);进一步与GenBank中14株BNoV GIII ORF1基因构建进化树,结果显示,本实验检测到的Bo/XJTC/2020/China 和Bo/XJ-TC-2/2021/China 均属于GIII.2型BNoV(图3B)。

图3 BNoV GIII型遗传进化树Fig.3 Phylogenetic tree of NoV(A)and BNoV GIII type(B)
上述结果表明新疆塔城地区BNoV 与国内不同地区的GIII.2 型BNoV 均为同一进化簇,是源于同一株BNoV 进化而来,并且与国内BNoV 的相似性较高,与国外BNoV 的相似性较低。
对比国内外几株GIII.2 型BNoV ORF1 基因序列,结果显示Bo/XJ-TC/2020/China 和Bo/XJ-TC-2/2021/China ORF1 基因序列的同源性为100%;与中国四川地区OK032546 病毒株相应基因序列同源性最高,为99.6%;与中国江苏地区MW810336 病毒株同源性最低,为82.8%,与国外其他几株的核苷酸同源性为91.3%~96.4%。Bo/XJ-TC/2020/China 和Bo/XJ-TC-2/2021/China ORF1 编码氨基酸序列之间的同源性为99.9%;与中国河北地区MZ573197 病毒株相应氨基酸序列同源性最高,为98.3%;与中国江苏地区MW810336 病毒株相应氨基酸序列同源性最低,为76.1%;与国外其他几株的相应氨基酸序列同源性为96.6%~98.3%。表明塔城地区BNoV 和其他GIII.2 型BNoV 源于同一株BNoV 进化而来,该BNoV的变异程度较低。
近年来韩国[17],乌拉圭[18]等国相继检测到了BNoV GIII.2 型,师志海等人在2018 年检测到BNoV GIII.2型[14]。本实验中的2株BNoV的ORF1基因遗传进化分析结果也显示均为GIII.2 型,可见BNoV GIII.2 型目前已呈现全球广泛流行。
2.3 BNoV ORF1 基因重组分析结果对本实验检测到的BNoV ORF1 基因进行基因重组分析,结果显示其与挪威、英国和比利时报道的GIII.2 型病毒株ORF1 基因中未出现基因重组现象。表明本研究检测到的BNoV 在ORF1 基因中无基因重组现象发生。王文佳等人在2020年报道了BNoV VP1(即为ORF2)基因和ORF1-ORF2 连接处预测到了基因重组现象[16]。在2020 年也报道了BNoV 基因重组现象的发生,且基因重组位点也发生在ORF1-ORF2 连接处[18]。说明BNoV基因变异的情况多发生在ORF1-ORF2 连接处,应对BNoV 该区域基因序列重点关注,并预测优势的抗原表位,为疫苗的研制提供更多理论依据。
本研究结果表明BNoV 在新疆地区的感染率较高,且在多个地区流行,并首次报告了新疆地区BNoV 与国内外BNoV 在ORF1 基因无重组现象。

