红芽芋多糖提取工艺优化及其抗氧化活性的研究
李青青,陈 晨,曹艳亭,2,熊建华,王文君,2*
(1.江西农业大学 食品科学与工程学院,江西 南昌 330045;2.江西省天然产物与功能食品重点实验室,江西 南昌 330045;3.厦门海关技术中心,福建 厦门 361013)
【研究意义】红芽芋,芋类(Colocasia esculenta(L.)Schott)的一种,又名红芋、红眼芋等,为天南星科植物芋的块茎,富含多糖、维生素、膳食纤维、淀粉及其他功能成分,是热带亚热带地区广泛栽培的作物,原产于中国、马来西亚、印度等国家[1]。我国江西省上饶市铅山县在2016 年特产铅山红芽芋年总产量高达15 万t[2],目前对红芽芋的研究主要集中在栽培技术[3-4],为了进一步开发和利用红芽芋资源,将红芽芋功能成分应用到新药及功能保健品和绿色食品添加剂等多个领域具有重要意义。【前人研究进展】多糖主要分为植物多糖、动物多糖和微生物多糖,广泛存在于动植物体内和微生物细胞壁中。因其来源广泛,没有毒副作用,而且药物质量通过化学手段容易控制等优点,成为当今新药及功能保健品和绿色食品添加剂发展的新方向[5-7]。芋头中多糖含量较高,且为具有生物活性的成分之一。研究表明,芋头多糖具有降血糖[8]、免疫调节[9]、抗氧化[10]等作用。植物多糖的提取方法主要有浸提法[11-12]、超声波辅助法[13]、微波辅助法[9]、脉冲电场辅助法[14]和酶解法。有研究[15]表明,多糖的提取方法会影响其抗氧化活性。杨金涛等[16]采用热水浸提法、超声提取法和碱提取法分别提取榆黄蘑多糖,发现榆黄蘑水提多糖具有更强的自由基清除能力,因此,本研究选择热水浸提法提取红芽芋多糖。【本研究切入点】虽然已有关于芋头多糖提取工艺的研究,但对红芽芋多糖的提取工艺及抗氧化作用未见报道。从红芽芋分离出具有生物活性的多糖,以此探究红芽芋多糖的抗氧化活性,因此,优化红芽芋多糖的提取参数极为重要,从而进一步了解红芽芋多糖抗氧化活性的强弱。【拟解决的关键问题】本研究以铅山红芽芋为试验材料,通过正交设计优化红芽芋多糖的提取参数,包括料液比、水浴温度和水浴时长,采用清除过氧化氢、DPPH 自由基、ABTS+自由基、超氧阴离子自由基、羟自由基活性和总还原力的能力作为初步考察红芽芋多糖抗氧化活性的模型,探讨红芽芋多糖的抗氧化活性,以期最大程度地提取红芽芋多糖,从而提高红芽芋的资源利用率和经济附加价值,为红芽芋多糖应用到新药及功能保健品和绿色食品添加剂等领域提供参考。
1 材料与方法
1.1 材料与试剂
红芽芋:铅山红芽芋(产于江西省铅山县葛仙山乡,采收时间为9月);木瓜蛋白酶(80万U/g,北京索莱宝科技有限公司);α-淀粉酶(3 700 U/g,北京索莱宝科技有限公司);1,1-二苯基-2-三硝基苯肼(DPPH,梯希爱化成工业发展有限公司);2,2′-联氮-双-3-乙基苯并噻唑啉-6-磺酸(ABTS,北京金克隆生物技术有限公司);L-抗坏血酸(VC,纯度99%,上海蓝季生物有限公司);邻苯三酚(上海麦克林生化科技有限公司);Tris-HCl缓冲液(北京鼎国昌盛生物技术有限责任公司);苯酚(上海阿拉丁生化科技股份有限公司);过氧化氢;葡萄糖;浓硫酸;磷酸盐缓冲液;铁氰化钾;三氯乙酸;三氯化铁;硫酸亚铁;水杨酸;氯仿;正丁醇;无水丙酮均为分析纯。
1.2 仪器与设备
HC-2518R 高速冷冻离心机(安徽中科中佳科学仪器有限公司);GL-21M 高速冷冻离心机(湖南湘仪实验室仪器开发有限公司)SpectraMax M2 酶标仪(Molecular Devices);XD-2000A 旋转蒸发仪(上海贤德实验仪器有限公司);FE-1D-50 冷冻干燥机(北京博医康实验仪器有限公司);YXQ-LS-50SⅡ立式压力蒸汽灭菌器(上海博迅实业有限公司医疗设备厂)。
1.3 试验方法
1.3.1 多糖的制备样品预处理新鲜红芽芋→清洗去皮→切片→烘干→粉碎→过筛→多次粉碎后为全粉。
红芽芋多糖的提取:称取红芽芋全粉75 g,加入750 mL蒸馏水,混匀,90 ℃水浴提取4.5 h,离心半径14 cm,4 500 r/min离心15 min,保留上清液,滤渣重新提取。将提取的上清液合并,用95%乙醇(V(样品)∶V(乙醇)=1∶4)在4 ℃下醇沉12 h;4 500 r/min离心15 min,离心后取沉淀,依次用无水乙醇、无水丙酮和水洗涤沉淀,于50 ℃烘箱中挥发有机溶剂,复溶至多糖浓度为10 mg/mL,用0.1 mol/L NaOH溶液调整pH为6,按18 U/g加入α-淀粉酶,60 ℃水浴1.5 h,用I2/KI 溶液检验直至碘液不变色;按12 万U/g 加入木瓜蛋白酶,pH 6,55 ℃水浴1.5 h,沸水浴灭活蛋白酶。再用经典的Sevage 法按1∶3(Sevage∶供试液=1∶3)的体积加入Sevage 液(V(氯仿)∶V(正丁醇)=4∶1),反复振荡10 min,离心半径14 cm,4 000 r/min,离心15 min 沉淀蛋白,取上清液,重复上述步骤4次。收集上清液浓缩后流动水透析36 h,蒸馏水透析36 h,冷冻干燥得到红芽芋多糖。

1.3.2 红芽芋多糖含量测定红芽芋多糖含量的测定采用苯酚-硫酸法,以葡萄糖作为标准品。于试管中依次加入1 mL 不同浓度的葡萄糖标准品、0.3 mL 5%苯酚,然后立即加入2 mL 浓硫酸,摇匀后于60 ℃水浴加热5 min,冰水浴10 min,冷却至室温,在波长483 nm 处测定其吸光度,以葡萄糖浓度为纵坐标,作标准曲线。样品管以1 mL样品代替葡萄糖,其余操作与上述标准管步骤相同。记录其在波长483 nm处的吸光度,平行测定3次取平均值。求出回归方程为y=0.005 2x+0.114 4,R2=0.994 8,线性关系良好,计算其多糖含量为(70.48±0.10)%。
1.4 单因素及正交设计
1.4.1 红芽芋多糖水浴提取工艺称取红芽芋全粉1 g,加入10 mL蒸馏水,混匀,于70 ℃水浴提取4.5 h,离心半径8.3 cm,4 500 r/min,离心15 min,保留上清液,滤渣重新提取。将提取的上清液合并,用95%乙醇(V(样品)∶V(乙醇)=1∶4)在4 ℃下醇沉12 h;离心半径8.3 cm,4 500 r/min,离心15 min,离心后取沉淀,依次用无水乙醇、无水丙酮和水洗涤沉淀,于50 ℃烘箱中挥发有机溶剂,复溶至多糖浓度为10 mg/mL,用0.1 mol/L NaOH 溶液调整pH 为6,按18 U/g 加入α-淀粉酶,60 ℃水浴1.5 h,用I2/KI 溶液检验直至碘液不变色;按12万U/g加入木瓜蛋白酶,pH 6,55 ℃水浴1.5 h,沸水浴灭活蛋白酶。再用经典的Sevage法按1∶3(Sevage∶供试液=1∶3)的体积加入Sevage 液(V(氯仿)∶V(正丁醇)=4∶1),反复振荡10 min,4 000 r/min 离心15 min 离心半径 min,取上清液,重复上述步骤4 次。收集上清液浓缩后流动水透析36 h,蒸馏水透析36 h,冷冻干燥得到红芽芋多糖。
1.4.2 单因素试验设计称取红芽芋全粉1 g,根据预试验结果考察料液比1∶4,1∶8,1∶10,1∶16,1∶20 g/mL,水浴温度50,60,70,80,90 ℃,水浴时长1.5,3.0,4.5,6.0,7.5 h时多糖的得率,每组试验重复3次。
1.4.3 正交试验设计根据单因素试验结果,选择料液比、水浴温度及水浴时长3 个因素设计四因素三水平正交试验,表1所示为试验因素和水平。

表1 红芽芋多糖提取正交试验的因素和水平Tab.1 Factors and level of extraction of red bud taro polysaccharides by orthogonal test
1.5 体外抗氧化
总还原力的测定:参考初雅洁,龚加顺[17]的方法,以VC作为阳性对照组。在波长700 nm处测不同浓度红芽芋多糖的吸光度,平行测定3次取平均值。
机器学习中的现代个性化的推荐系统与我们的日常生活有着密不可分的联系,它使我们的眼界更加开拓。随着现代计算机科学地迅速发展,推荐系统中的核心——推荐算法也在不断的发展,但每一种算法都还是存在着一定的局限性。在将来的工作中我们可以注重在技术方面上解决这些问题,通过更深入地学习数学与理论计算机科学知识,去尝试设计更好的推荐算法,使得推荐系统可以更加成熟。
清除DPPH 自由基能力的测定:参考初雅洁,龚加顺[17]的方法,以VC 作为阳性对照组。测不同浓度红芽芋多糖清除DPPH自由基的效果,平行测定3次取平均值,计算清除50%自由基的样品浓度(IC50)。
清除ABTS+自由基能力的测定:参考初雅洁,龚加顺[17]的方法,以VC 作为阳性对照组。测不同浓度红芽芋多糖清除ABTS+自由基的效果,平行测定3次取平均值,计算清除50%自由基的样品浓度(IC50)。
清除羟自由基能力的测定:参考王凯等[18]的方法,以VC 作为阳性对照组。测不同浓度红芽芋多糖清除自由基的效果,平行测定3次取平均值,计算清除50%羟自由基的样品浓度(IC50)。
清除超氧阴离子自由基能力的测定:参照赵鹤鹏等[19]的方法,以VC作为阳性对照组。测不同浓度红芽芋多糖清除自由基的效果,平行测定3次取平均值,计算清除50%超氧阴离子自由基的样品浓度(IC50)。
清除过氧化氢能力的测定[20]:分别取不同浓度的红芽芋多糖溶液100 μL 于5 mL 离心管中,分别加入10 mmol/L 过氧化氢溶液600 μL,用pH=7.4 的PBS 缓冲溶液定容到3 mL,均匀混合,在波长230 nm 条件下考察红芽芋多糖对过氧化氢的清除作用。其中,样品的吸光度记为Ai,对照组用PBS缓冲液替代样品,在波长230 nm 条件下的吸光度记为Ac,空白组用蒸馏水代替样品,在波长230 nm 条件下的吸光度记为A0。用VC作为阳性对照组,平行测定3次取平均值,计算清除50%过氧化氢时的样品浓度(IC50)。

1.6 统计分析
采用SPSS Statistics 19 软件对试验数据进行单因素方差分析,结果均以均值±标准误差表示,使用Originpro 9.1作图。
2 结果与分析
2.1 单因素及正交试验
2.1.1 料液比、水浴温度及水浴时长对红芽芋多糖水浴提取工艺的影响由图1可知,红芽芋多糖受料液比、水浴温度及水浴时长等因素影响,且不同因素对红芽芋多糖得率的影响不同。由图1(1)可知,红芽芋多糖得率随着料液比的升高先增大后减小,当料液比为1∶8时,红芽芋多糖得率达到最大(5.56%),各个水平之间存在极显著差异(P<0.01),各水平按红芽芋多糖得率大小依次为1∶8、1∶10、1∶4、1∶16、1∶20(红芽芋多糖得率分别为5.56%、1.94%、1.49%、0.70%、0.35%),因此,料液比的最佳选择为1∶8 g/mL,这与杨秀芳等[21]对陕西芋头多糖的提取结果基本一致。由图1(2)可知,红芽芋多糖得率随着水浴温度的升高先减小后增大,水浴温度为70 ℃时得率最小,仅为1.94%,水浴温度为90 ℃时,红芽芋多糖得率可达6.72%,除水浴温度50 ℃与60 ℃之间不存在极显著差异(P>0.01)外,其他水平间均存在极显著差异(P<0.01),因此,本试验水浴温度的最佳选择为90 ℃。由图1(3)可知,红芽芋多糖得率随着水浴时间的升高先增大后减小。当水浴时间为6 h 时,多糖得率可达6.38%,各个水平间均存在极显著差异(P<0.01),因此,水浴时长的最佳选择为6 h,这与王瑜等[10]对芋头多糖的提取结果一致。
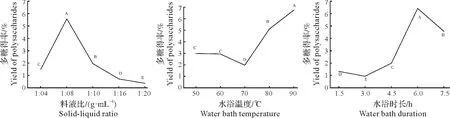
图1 不同因素对红芽芋多糖得率的影响Fig.1 Effect of factors on the yield of polysaccharides from red bud taro
2.1.2 正交试验利用L9(34)正交设计试验(表1),计算红芽芋多糖得率,试验结果如表2所示。对正交试验结果进行方差分析,结果如表3 所示。从表2 和表3 可知,红芽芋多糖提取工艺的3 个影响因素中,对得率影响大小依次为:水浴温度(B)、料液比(A)、水浴时长(C)。方差分析表明,A、B 因素为主要影响因素,A因素对红芽芋多糖提取工艺有一定影响,B因素对红芽芋多糖提取工艺有显著性影响,C因素对红芽芋多糖提取工艺无显著性影响,而C因素在单因素试验中各个水平之间呈极显著差异(P<0.01),说明这种混杂因素对C 因素进行了掩盖,也就是说,在多因素分析中,C 因素在混杂因素的作用下被校正而使得其显著性消失,这意味着C 因素在红芽芋多糖的提取工艺存在影响但不是主要因素,又由于C 因素R 值小于误差列R 值,因此该因素选择最小值C1,由此得出,在所选水平范围内,红芽芋多糖最佳工艺为A3B3C1,即:料液比为1∶10 g/mL,水浴温度为90 ℃,水浴时长为4.5 h。以最佳工艺条件进行红芽芋多糖提取的放大验证试验,平行3 次,红芽芋多糖的平均得率为(6.34±0.20)%,结果显示A3B3C1为最佳提取工艺。

表2 L9(34)正交试验结果Tab.2 L9(34)orthogonal test

表3 方差分析Tab.3 Analysis of variance
2.2 体外抗氧化
2.2.1 总还原力抗氧化剂能使铁氰化钾的三价铁还原成二价铁的亚铁氰化钾,亚铁氰化钾进一步与三氯化铁反应生成在波长700 nm 处有最大吸光度的普鲁士蓝,因此,在波长700 nm 处吸光度的高低可以反映抗氧化剂的还原能力大小。由图2可知,红芽芋多糖的总还原力与红芽芋多糖浓度呈正相关,这与苏颖杰[11]提取的槟榔芋多糖的研究结果相符合,但是红芽芋多糖的总还原力相比与VC 更弱,且红芽芋多糖各个浓度之间总还原力存在极显著差异(P<0.01),表明红芽芋多糖具有一定的还原力。

图2 红芽芋多糖总还原力Fig.2 Total reducing power of red bud taro polysaccharides
2.2.2 清除DPPH 自由基能力DPPH 是具有质子自由基的重要化合物,一旦接触质子自由基清除剂会使其含量减少,能与有供氢能力的化合物反应,其清除机制主要是氢转移(HAT),DPPH 自由基清除实验被广泛应用于评价各种提取物是否具有抗氧化活性或者活性的强度[22-23]。由图3(1)可知,当红芽芋多糖浓度从1 mg/mL 增加到6 mg/mL 时,红芽芋多糖对DPPH自由基清除能力由28.95%增加到62.94%,相同浓度的VC 的DPPH 自由基清除率由88.99%增加到92.53%。当红芽芋多糖浓度为2 mg/mL 和4 mg/mL 时,DPPH 自由基清除能力存在极显著差异(P<0.01)。红芽芋多糖对DPPH 自由基清除率随着红芽芋多糖的浓度的增大而增强,并在一定浓度范围内存在量效关系。由计算可知,红芽芋多糖IC50为4.46 mg/mL。这说明了红芽芋多糖可以提供氢原子并对DPPH自由基发挥强有力地清除活性。

图3 红芽芋多糖对自由基清除效果Fig.3 Scavenging effect of red bud taro polysaccharides on free radicals
2.2.3 清除ABTS+自由基能力ABTS 是一种化学性自由基引发剂,在反应体系中被氧化后会生成稳定的蓝绿色亚稳态阳离子自由基ABTS+,抗氧化剂与ABTS+自由基发生反应使溶液褪色生成无色的ABTS,在波长734 nm处有特征吸收,褪色越明显,则提取物的抗氧化能力越强[24]。亚稳态自由基阳离子可以作为的过氧化物酶底物,作为反映提取多糖的抗氧化活性的指标[22]。由图3(2)可知,红芽芋多糖对ABTS+自由基的清除能力较强,当红芽芋多糖浓度从1 mg/mL 增加到10 mg/mL 时,红芽芋多糖对ABTS+自由基清除能力由34.81%增加到93.10%,当红芽芋多糖浓度达到10 mg/mL 时,多糖对ABTS+自由基清除能力与VC对ABTS+自由基的清除能力大致相当,当红芽芋多糖浓度为1~6 mg/mL时,与10 mg/mL红芽芋多糖之间对ABTS+自由基清除能力具有极显著差异(P<0.01)。由计算可知,红芽芋多糖的IC50为3.97 mg/mL。ABTS+自由基清除能力随着红芽芋多糖浓度增加而增大。有研究[11]表明,槟榔芋多糖对ABTS+自由基的清除能力IC50为4.99 mg/mL,说明红芽芋多糖比槟榔芋多糖具有更强的清除ABTS+自由基的能力,这可能与多糖的分子量、化学组成等有关[25]。
2.2.4 清除超氧阴离子自由基能力在弱碱环境下,邻苯三酚能自氧化反应生成超氧阴离子自由基和有色中间产物,抗氧化剂将超氧阴离子自由基歧化分解为H2O2和O2,从而抑制邻苯三酚的自氧化反应[22],而有色中间产物在波长325 nm 处有吸收峰,且产物越多,峰越高。当加入具有·O2-清除能力的抗氧化剂时,抗氧化剂与·O2-迅速发生反应并阻止有色中间产物的积累,从而吸收峰减弱[26]。由图3(3)可知,红芽芋多糖对·O2-的清除能力较差,各浓度之间不存在极显著差异(P>0.01),当红芽芋多糖浓度为6 mg/mL 时,对超氧阴离子自由基的清除能力为18.26%,这和刘楠楠[27]研究荔浦芋多糖对超氧阴离子的结果基本一致。当VC 浓度从1 mg/mL 增加到10 mg/mL 时,超氧阴离子自由基清除率从26.36%增加到90.17%。这说明红芽芋多糖存在超氧阴离子清除活性,这可能与多糖结构含有醛或酮、醛或酮,可以释放O-H稳定氢根离子,从而稳定·O2-,因此当溶液中的O-H降低时,一些超氧阴离子不稳定,导致清除率的降低[28]。
2.2.5 清除羟自由基能力羟自由基易于碳水化合物、蛋白质、脂质和DNA 发生反应,导致细胞损伤或死亡,是一类化学性质非常活跃的自由基[29]。水杨酸比色法是反应生成的羟自由基进攻水杨酸分子上的苯环,生成有色产物[30],在波长510 nm 处有较强吸收,当反应体系中加入具有清除羟自由基的提取物时会降低其吸光度,所以当有色物质越少时,说明提取物对羟自由基的清除能力越强。由图3(4)可知,当红芽芋多糖浓度从1 mg/mL 增加到10 mg/mL 时,红芽芋多糖对羟自由基清除能力由2.81%增加到47.22%,当红芽芋多糖浓度为6 mg/mL 时,对羟自由基的清除能力为32.95%,这和周东月等[31]研究的黄精多糖对羟自由基的清除能力结果基本一致。由计算可知,红芽芋多糖的IC50为9.52 mg/mL,当红芽芋浓度分别为1 mg/mL 和2 mg/mL 时,它们与浓度为8 mg/mL 的红芽芋多糖对羟自由基清除能力存在极显著差异(P<0.01),同时与浓度为10 mg/mL 的红芽芋多糖对羟自由基清除能力也存在极显著差异(P<0.01)。羟自由基清除能力随着红芽芋多糖溶液浓度增加而增大,且羟自由基清除率与质量浓度之间存在较好的剂量效应关系,表明红芽芋多糖具有一定的羟自由基清除能力,这可能是多糖引起电子或氢供体清除羟自由基[28]。
2.2.6 清除过氧化氢能力几乎所有有氧生物细胞内都存在过氧化氢,生物体内氧气在有氧呼吸和光合作用等生命活动过程中由细胞内获取电子和质子,在超氧化物歧化酶的作用下生成过氧化氢[32]。过氧化氢是一种弱氧化物,其自身氧化反应不强,但可快速地跨过细胞膜,并与膜内二价铁离子和二价铜离子反应生成羟自由基,从而产生毒性,因此,清除过氧化氢是细胞和人体系统中非常重要的抗氧化防御系统[20]。由图4 可知,清除过氧化氢能力随着红芽芋多糖浓度的升高先增大后减小,且当红芽芋多糖在1 mg/mL时,清除过氧化氢的清除率已达99.77%,与VC清除过氧化氢的能力相当,当红芽芋浓度为10 mg/mL时,与6 mg/mL红芽芋多糖清除过氧化氢存在显著性差异(P<0.05),与8 mg/mL红芽芋多糖清除过氧化氢也存在显著性差异(P<0.05)。这说明红芽芋多糖有很强的清除过氧化氢的清除能力,这可能是因为多糖的组成、单糖类型等不同[33]。

图4 红芽芋多糖清除过氧化氢效果Fig.4 The effect of hydrogen peroxide removal by red bud taro polysaccharides
3 讨论与结论
本研究采用热水浸提法提取红芽芋多糖,根据预试验及单因素试验发现红芽芋多糖得率与料液比、水浴温度和水浴时长等因素有关。红芽芋多糖得率随料液比的升高先增大后减小,当料液比小于1∶8(g/mL)时,红芽芋多糖得率增大,这可能是当料液比升高时,根据“相似相溶”原理,多糖溶解度增强得以溶出,当料液比大于1∶8(g/mL)时,相对分子质量较小的多糖、低聚糖会提前沉淀[21],使得多糖溶出率下降,从而导致多糖的得率下降。红芽芋多糖得率随水浴温度的升高先减小后增大,红芽芋多糖得率水浴温度为70 ℃时得率最小,水浴温度为90 ℃时,红芽芋多糖得率达到最大,为6.72%,这可能是温度的增加改善了多糖的溶解性。这说明较高的温度有利于多糖溶解,但温度过高会破坏多糖的结构。至于水浴温度小于70 ℃红芽芋多糖得率下降,苏颖杰[11]在水浴提取槟榔芋多糖时发现多糖在60,70 ℃时不易提取。红芽芋多糖得率随水浴时间的增加先增大后减小,当水浴时间小于6 h时,多糖得率不断增大,这可能是水浴时间增加导致多糖的溶出率升高,当水浴时间大于6 h时,多糖得率下降,这可能是因为水浴时间过长导致部分多糖支链破坏[34],多糖黏度降低,使得多糖溶解度下降,且水浴时间过长溶解出来的杂质增多,得率降低。因此,进一步采用L9(34)正交设计对这3 个相关因素选择红芽芋多糖得率较高且水平间存在极显著差异的3 水平对水浴提取参数优化,对正交实验结果采用事后比较SNK 分析发现水浴温度(P<0.1)和料液比(P<0.25)为主要影响因素,水浴时长对红芽芋多糖得率无显著性差异(P>0.25),这可能是由于多因素分析时混杂因素调整了水浴时长因素使得其显著性消失。通过分析选择料液比1∶10(g/mL)、水浴温度90 ℃、水浴时长4.5 h作为红芽芋多糖的最佳提取工艺,该条件下红芽芋多糖平均得率为(6.34±0.20)%。有研究表明不同的提取参数会影响芋头多糖的得率。苏颖杰[11]通过响应面设计优化提取参数提取槟榔芋时,其提取温度为80 ℃、提取时长为0.7 h、料液比为1∶33,多糖得率为5.28%。廖燕玲等[35]通过正交设计优化热水浸提法参数提取槟榔芋,当提取温度为70 ℃、提取时长为3 h、料液比为1∶35 时,芋头多糖的得率为4.89%。多糖的得率是多糖提取工艺的测定指标,可用于评价其提取效果,因此,提取工艺的优化是否合理需要考虑提取参数是否得到优化。
不同的提取参数不仅会影响多糖的得率,还会影响其抗氧化活性,这可能是由于提取参数的不同会影响多糖的理化性质、结构或构象,从而导致抗氧化活性的不同。本研究在水浴温度为90 ℃,料液比为1∶10(g/mL),水浴提取4.5 h 的条件下红芽芋多糖平均得率为(6.34±0.20)%,此时红芽芋多糖具有较好地清除过氧化氢、DPPH 自由基、ABTS+自由基和羟自由基活性,但红芽芋多糖的总还原力不强,对·O2-清除能力较弱。其原因可能有以下三种:
一是多糖的单糖类型不同。苏颖杰[11]采用热水浸提法槟榔芋多糖,发现槟榔芋多糖由葡萄糖(90.64%)、半乳糖醛酸(3.72%)、半乳糖(3.66%)、阿拉伯糖(0.74%)、甘露糖(0.62%)和鼠李糖(0.61%)组成,并具有良好的清除DPPH 自由基、ABTS 自由基和羟自由基活性。而Sokolova 等[36]认为红藻多糖清除羟自由基的能力很大程度上依赖于其浓度,多糖的结构在清除羟自由基过程中并不重要,同时研究发现红藻多糖对过氧化氢是惰性的。而红芽芋多糖却具有较强的清除过氧化氢能力,这可能是因为多糖的组成、单糖类型等不同。据报道[33],淀粉葡糖苷酶水解物半乳糖(27.3%)、葡萄糖(64.5%)和甘露糖(8.3%)组对过氧化氢具有较强的抗氧化作用,且呈剂量依赖性。
二是芋头多糖中含有半缩醛还原基、伯仲羟基等与氧自由基有明显的化学作用[10],此外,其抗氧化作用与单糖相连的糖基键密切相关。研究发现[9,14-15,27,37],芋头多糖其单糖组成均为葡萄糖、木糖、半乳糖、鼠李糖和甘露糖,这些单糖中含有半缩醛还原基、伯仲羟基等基团可以与氧自由基发生作用。Klaus 等[38]也发现不同方法提取的野生担子菌实体多糖中最主要的单糖均是葡萄糖,且DPPH 自由基、总还原力与α-葡聚糖含量呈正相关。Lo 等[39]则采用多元线性回归(MLRA)分析研究了多糖的抗氧化性能与单糖或糖基连接的关系,结果表明单糖的组成和比例以及糖基键的类型会影响多糖的抗氧化活性。具体来说,鼠李糖和甘露糖在所有4 种抗氧化模型(共轭双烯模型、还原力模型、DPPH 清除模型和亚铁离子螯合模型)的MLRA 分析中都显示出正相关,同时,侧链上的糖基键,特别是侧链上的阿拉伯糖1→4 和甘露糖1→2 与还原能力密切相关,而葡萄糖1→6 和阿拉伯糖1→4 与清除DPPH 自由基能力密切相关。
三是多糖与其他化合物结合的杂质存在,也会使得红芽芋多糖展现出一定的抗氧化活性。本研究中红芽芋多糖的含量为70.48%,还有部分其他化合物的存在。而有研究报道芋头中含有花青素、矢车菊素-3-葡萄糖苷等黄酮类化合物等[40],该类物质具有一定的抗氧化活性。
本研究采用正交设计结合热水浸提法提取红芽芋多糖,当水浴温度为90 ℃,料液比为1∶10(g/mL),水浴提取4.5 h 时多糖平均得率为(6.34±0.20)%,同时发现红芽芋多糖具有较好地清除过氧化氢、DPPH自由基、ABTS+自由基和羟自由基活性,但多糖的总还原力不强,对·O2-清除能力较弱,且红芽芋多糖对不同自由基清除能力存在差异。

