谷子ABC1基因家族全基因组鉴定及表达分析
张 诺,任志贤,徐 林,刘 旭,张宝俊
(山西农业大学 植物保护学院,山西 太谷 030801)
【研究意义】植物类蛋白激酶家族(protein kinase-like,PKL)可分为真核生物蛋白激酶(eukaryotic protein kinase,ePK)和非典型蛋白激酶(atypical protein kinases,aPK)两大类[1],在植物生长发育及抗逆信号的感知、传导及基因的表达调控等方面发挥重要作用。ABC1(activity of bc1 complex)家族是存在于原核和真核生物中的一类非典型蛋白质激酶家族[2],最早从酿酒酵母中分离,其功能是抑制细胞色素b mRNA 翻译的缺陷以及维持线粒体呼吸链中bc1复合体的活性[3]。随后,在酵母、大肠杆菌等物种中发现ABC1 家族成员参与线粒体和原核生物蛋白调控泛醌的生物合成,参与呼吸作用电子传递和抗氧化胁迫[4-6]。【前人研究进展】目前ABC1 基因已在拟南芥、水稻、玉米、小麦、烟草、百合、胡杨等植物中得到鉴定[7-13]。高清松等[8]在水稻中鉴定到15 个ABC1 蛋白,其中9 个水稻ABC1 蛋白被预测定位在叶绿体上,5个蛋白的编码基因表达受黑暗处理的调控,表明该家族可能在叶绿体发育中起作用;在拟南芥中共鉴定到17 个ABC1 蛋白,8 个被预测定位于叶绿体[14]。Yang 等[15]发现拟南芥的AtACDO1定位于叶绿体,并且AtACDO1基因在RNAi干扰的情况下,叶片中类胡萝卜素和叶绿素的含量降低,表明该基因对叶绿素的生物合成有重要作用。Jasinsiki 等[7]在拟南芥中发现了1 个镉和氧化胁迫应答因子AtOSA1,王彩香等[10]克隆的小麦类ABC1 基因TaABC1L,该基因能够被渗透、高盐、低温胁迫以及ABA 处理诱导表达。刘继凯等[11]克隆的烟草NtSIA1基因受到盐胁迫和Cd2+的诱导。袁迎迎等[12]鉴定到的lilyABC1基因可能对岷江百合适应高盐、低温和黑暗等非生物胁迫具有一定作用。Wang 等[16]在小麦中鉴定到一个ABC1 家族的基因TaAbc1,该基因受条锈病菌(Puccinia striiformisf.sp.tritici,Pst)诱导,沉默TaAbc1会降低小麦2 个抗性品种‘水源11’和‘CYR23’引发的超敏反应。【本研究切入点】谷子是我国重要的杂粮作物,具有抗旱、耐贫瘠等特点,但谷子生产上受到众多非生物胁迫及生物胁迫,影响到谷子光合作用及产量。任传友等[17]研究表明,水分胁迫会导致谷子光合速率和产量下降,程富英等[18]表明,禾生指梗霉引发的谷子白发病或造成谷子叶片褪绿、畸形,严重影响谷子叶片的光合作用,造成谷子产量的损失。ABC1 基因家族可定位于线粒体和叶绿体,对叶绿体的发育有一定的功能。【拟解决的关键问题】通过鉴定谷子ABC1 家族基因,探究不同成员的差异表达及其调控网络,为解析ABC1 家族基因在谷子叶绿体发育中所发挥的作用提供理论依据。
1 材料与方法
1.1 ABC1基因家族数据获取及基因鉴定
xiaomi全基因组数据从Multi-omics Database forSetaria italica数据库中(http://www.maizesequence.org/index.html)获取。从TAIR(https://www.arabidopsis.org/)数据库及国家水稻数据中心(http://www.ricedata.cn/index.htm)中获取11 条拟南芥ABC1 家族的蛋白序列及15 条水稻ABC1 家族的蛋白序列,基于Pfam 数据库(http://pfam.xfam.org/)中ABC1 家族的HMMER 模型(PF04844),利用TBtools 中的Simple HMM Search工具,在谷子的全基因组蛋白序列中进行筛选,E-value<0.01。
1.2 谷子ABC1基因家族蛋白特征分析
分别利用ExPASY-ProtParam(https://web.expasy.org/protparam/)、PSORT Prediction(http://psort1.hgc.jp/form.html)在线工具分析谷子ABC1 家族蛋白的基本理化性质以及亚细胞定位。利用TBtools 工具对谷子的基因组注释gff3 文件进行分析,并对基因定位的结果可视化。
1.3 谷子ABC1基因家族系统进化及保守结构域分析
使用MEGA7.0中的最大似然法(maximum likelihood estimate,MLE)构建系统发育树。利用MEME在线软件(http://meme-suite.org/tools/meme)鉴定谷子ABC1 家族蛋白中的保守基序,并使用TBtools 工具对谷子ABC1家族基因的motif进行可视化。
1.4 谷子ABC1基因家族的启动子分析
截取ABC1 家族基因起始密码子上游2 000 bp 的基因序列作为启动子序列提交网站PlantCARE(http://bioinformatics.psb.gent.e/eboolslantcare/html)预测顺式作用元件,并在TBtools中进行可视化。
1.5 谷子ABC1家族基因的组织特异性表达及诱导表达分析
从Multi-omics database forSetaria italica数据库中获得谷子种子、根、茎、穗、叶等不同组织的基因表达量数据。基于各基因在植物组织各器官的表达差异构建表达热图,并利用可视化软件TBtools 展示。谷子ABC1 基因响应S.graminicola侵染的转录表达数据来源于实验室所测转录测序数据,取材时期为:在倒二叶形成期至病叶内卵孢子发育完成期,每隔3 d 取材1 次,共取材5 次,分为S1、S2、S3、S4、S5 5 个时期,材料编号为:处理组TG1、TG2、TG3、TG4、TG5;以同时期同部位健康叶片为对照,编号为CK1、CK2、CK3、CK4、CK5,3次重复。
1.6 qRT-PCR分析
使用Trizol 试剂(Sangon biotech)分别提取不同时期谷子叶片RNA,利用反转录试剂盒(Takara)合成cDNA。随机筛选12 个ABC1 家族基因,设计扩增引物(表1),采用qRT-PCR 法分析其表达量。PCR 反应体系(15 μL)为:TB Green®Premix Ex Taq™(Tli RNaseH Plus)mix 7.5 μL、上下游引物各0.6 μL、cDNA 40 ng、ddH2O 3.3 μL。反应条件:95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火/延伸30 s,40 个循环,用2-ΔΔCT法计算各个基因在不同时期的相对表达量,以Actin为内参,3次生物学重复。

表1 定量引物信息Tab.1 Primer information for qRT-PCR
2 结果与分析
2.1 谷子ABC1蛋白家族的筛选、理化性质和基因定位
利用ABC1的HMM 模型在xiaomi基因组中共鉴定得到205个候选成员,通过Pfam 数据库分析后,最终筛选得到谷子ABC1 家族基因共26 个,将其命名为SiABC1-1~SiABC1-26(表2),编码282~942 个氨基酸,平均氨基酸数目为630 aa,蛋白分子量介于30.56~105.20 ku,等电点5.36~10.08。ABC1 蛋白家族在2、8 号染色体上的数目最多,均为6 个,6、7 号染色体分布最少,仅有1 个。亚细胞定位预测结果显示,SiABC1-5、SiABC1-11、SiABC1-12、SiABC1-19、SiABC1-20、SiABC1-22和SiABC1-257 个基因定位于叶绿体,SiABC1-6、SiABC1-10、SiABC1-14和SiABC1-184 个基因定位于线粒体,SiABC1-1、SiABC1-2、SiABC1-8定位于质膜,SiABC1-3、SiABC1-4、SiABC1-13、SiABC1-26定位于内质网,SiABC1-7、SiABC1-9、SiABC1-21定位于过氧化物酶体,SiABC1-15、SiABC1-16、SiABC1-17定位于细胞核,SiABC1-23、SiABC1-24定位于细胞外。

表2 谷子ABC1家族基因的序列特征Tab.2 Sequence characteristics of the genes of ABC1 family in foxtail millet
2.2 谷子ABC1家族蛋白系统进化分析及保守结构域分析
对拟南芥、水稻与谷子的52 个ABC1 蛋白序列进行比对结果显示:ABC1 家族基因可被分为6 类(图1A)。在蓝色、绿色、黄色分支中,仅包含谷子与水稻的ABC1同源基因,包括19个谷子ABC1家族基因和9个水稻ABC1家族基因,在橙色、紫色分支中,包括7个谷子ABC1家族基因,6个水稻ABC1家族基因以及2个拟南芥ABC1家族基因,粉色分支中仅包含9个拟南芥ABC1家族基因。推测ABC1家族基因在进化过程中部分基因存在功能分化。在ABC1 氨基酸序列中共鉴定到8 个推定的基序(图1B)。其中motif2 和motif3 在26 条ABC1 蛋白序列中均存在,且均按照motif3-motif2 的顺序排列。Motif3 中较为保守的序列为PIAAASLGQVYRARLKDGGEV,Motif2中的保守序列为AYLRQLLEFHADPHPGNI(图1C)。
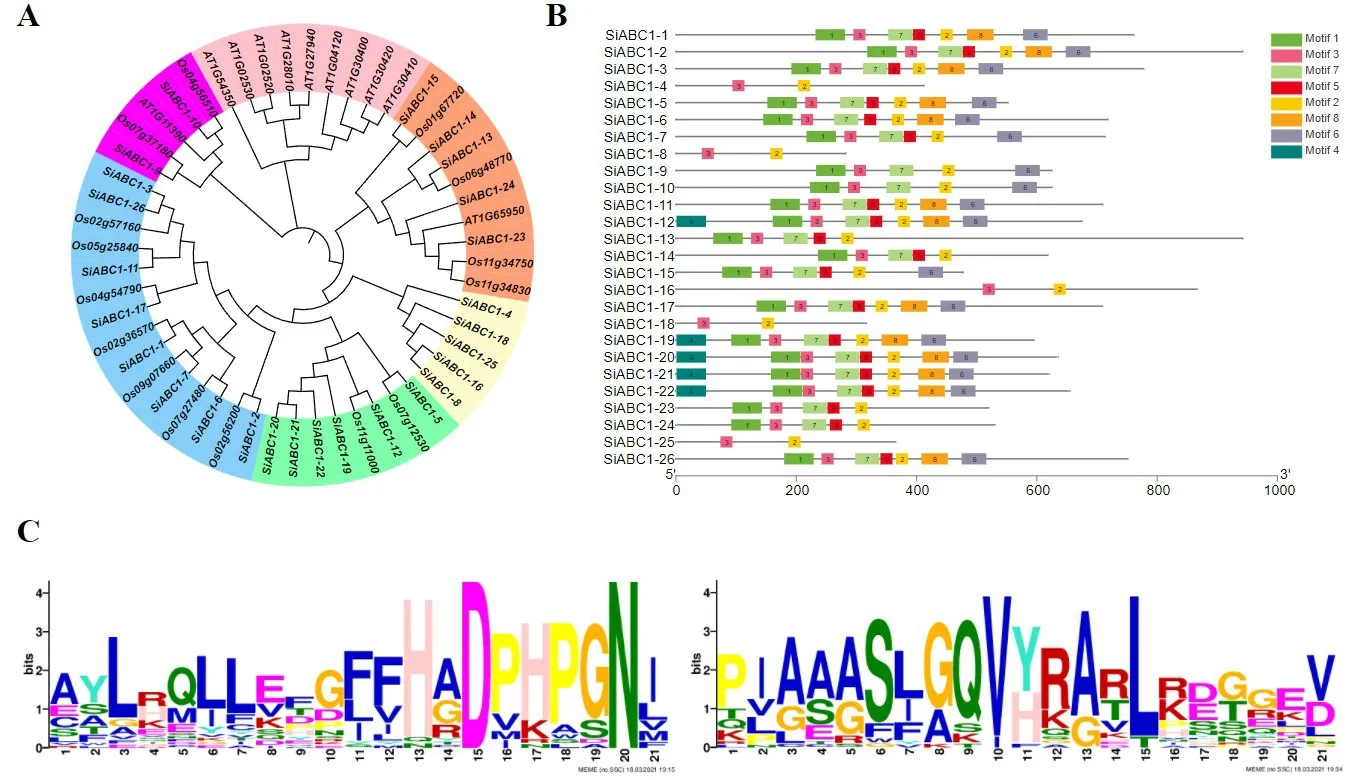
图1 谷子ABC1家族系统进化树及motif 分析Fig.1 Phylogenetic tree and protein motif analysis of ABC1 family of foxtail millet
2.3 谷子ABC1家族基因启动子顺式作用元件分析
顺式作用元件预测表明(图2),ABC1家族基因启动子中与激素响应和光响应相关的元件较多,26个基因中均存在脱落酸作用响应元件,含有响应生长素作用元件的基因有11个,含有响应赤霉素作用元件的基因有17个,含有响应茉莉酸作用元件的有21个,含有响应水杨酸作用元件的基因有8个,表明ABC1家族在谷子中可能与激素调控代谢途径相关。同时,谷子ABC1家族的26个基因均存在光响应元件,说明该基因家族可能在光合作用中也发挥重要作用。

图2 谷子ABC1家族基因启动子顺式作用元件功能Fig.2 Function of promoter cis-acting elements in ABC1 family genes in foxtail millet
2.4 谷子ABC1家族基因的组织特异性表达及诱导表达
谷子ABC1 家族基因组织特异性表达结果表明(图3A),SiABC1家族基因在种子与根中几乎不表达,SiABC1-1、SiABC1-5、SiABC1-12在叶部高表达,其中SiABC1-12表达量最高,TPM 值可达84.34。在受到禾生指梗霉侵染的谷子叶片中,共检测到18 个SiABC1基因被诱导表达,聚类分析可分为classⅠ和classⅡ两类(图3B)。其中classⅡ中的基因均在健康叶片中高表达,发病叶片中低表达,可能与禾生指梗霉侵染导致谷子叶片叶绿体合成及光合作用受阻有关,结合基因功能预测分析,在classⅡ中,SiABC1-1、SiABC1-2、SiABC1-3、SiABC1-5、SiABC1-6、SiABC1-12、SiABC1-14、SiABC1-15、SiABC1-17、SiABC1-26这10 个基因的功能全部预测到与叶绿体相关,同时,在classⅡ中,SiABC1-5、SiABC1-12这两个基因定位于叶绿体,预测其功能发现这两个基因均与叶绿素分解代谢过程相关,进一步证明了SiABC1-5、SiABC1-12可能在谷子的光合作用中发挥重要作用。

图3 谷子ABC1家族基因表达结果Fig.3 Gene expression results of ABC1 genes in different tissues of foxtail millet
2.6 qRT-PCR分析结果
RNA-seq 测定结果表明,所筛选12个ABC1家族基因在受侵染谷子叶片中均差异表达,为进一步验证SiABC1 基因参与谷子抗逆胁迫响应的表达差异,选择SiABC1-1、SiABC1-2、SiABC1-3、SiABC1-5、SiABC1-6、SiABC1-10、SiABC1-12、SiABC1-14、SiABC1-15、SiABC1-17、SiABC1-23、SiABC1-26进行实时荧光定量表达分析,以Actin基因为内参基因,qRT-PCR扩增结果如图4所示,其中SiABC1-1、SiABC1-2、SiABC1-3、SiABC1-6、SiABC1-10、SiABC1-12、SiABC1-14、SiABC1-17在受到禾生指梗霉侵染时5 个时期与健康叶片相比均下调表达,SiABC1-5、SiABC1-15在第4 时期上调表达,SiABC1-23在第2 时期上调表达,SiABC1-26在第1时期上调表达,被检测基因的相对表达量与转录组分析结果具有相似的表达趋势,且两组数据皮尔逊相关系数R2达0.729 7(图5),达到强相关。

图4 基因表达水平及qRT-PCR验证结果Fig.4 Gene expression levels and qRT-PCR validation results

图5 RNA-Seq与qRT-PCR表达模式相关性点图Fig.5 The correlation point map between RNA-Seq and qRT-PCR expression patterns
3 讨论与结论
ABC1属于非典型蛋白激酶,主要参与非生物胁迫的应答,但在线粒体、叶绿体以及在不同的物种中执行的功能存在着差异[7]。Lundquist 等[19]在拟南芥中鉴定到的17 个ABC1 基因有8 个定位于叶绿体,这些基因可能通过使叶绿体质体小球上的其他蛋白磷酸化从而调节其活性。Yang等[20]将拟南芥在低光强下用20 μmol/L 甲基紫精处理2 h 后,发现定位于叶绿体的基因At4g31390(ABC1K1)显著上调,通过构建突变体发现该基因在介导叶绿素降解和光氧化应激反应中起重要作用[15]。本研究利用Pfam 数据库筛选出26个ABC1家族成员,进化分析结果显示,SiABC1-5、SiABC1-12与水稻Os07g12530、Os11g11000同源性较高,高清松等[8]研究表明,Os07g12530、Os11g11000在叶片中特异性表达,并且亚细胞定位预测定位于叶绿体,与本研究结果相似,其中Os07g12530在黑暗处理时,表达量受到抑制。亚细胞定位预测有7个基因定位于叶绿体,根据组织特异性分析发现,定位于叶绿体SiABC1-5、SiABC1-12这2个基因在叶部高表达,并且结合转录组数据分析表明,SiABC1-5、SiABC1-12在健康叶片中的表达量显著高于病叶中表达量,推测这两个基因可能参与叶绿素的合成及光合作用,下一步将继续对这2个基因的功能进行验证和分析。同时,许多研究者发现,脱落酸作为一种逆境信号分子,ABC1基因家族广泛地参与了对其的响应,如拟南芥的ABC1 家族成员对脱落酸响应;大多数水稻的ABC1 家族成员响应脱落酸[12];利用外源脱落酸处理后的小麦TaABC1上调表达[14],说明ABC1 家族的基因可能与ABA 信号通路有关,从而介导ABC1 对逆境响应。同时根据谷子ABC1 家族基因的启动子分析发现,预测到与光响应和激素响应相关的作用元件最多,表明该家族基因可能参与谷子生长发育中的光合作用和抗逆反应。
致谢:山西省研究生创新项目(2021Y331)同时对本研究给予了资助,谨致谢意!

