去分化脂肪肉瘤伴脑膜上皮样漩涡结构10例临床病理分析及MDM2/CDK4基因联合检测的应用
郑美玲,黄海建,陈志忠,陈 新,陈小岩,郑松龄
去分化脂肪肉瘤伴脑膜上皮样漩涡结构(dedifferentiated liposarcomas with meningothelial-like whorls, DDLS-MLWS)是去分化脂肪肉瘤(dedifferentiated liposarcomas, DDLS)的一种少见变异表现。通过Pubmed和CNKI等检索显示:目前国外报道约47例,国内仅报道9例,并且未见有关MDM2/CDK4双基因在DDLS-MLWS中的研究报道。本文收集10例DDLS-MLWS,并复习相关文献,以提高对该病的认识水平,为治疗及预后提供依据。
1 材料与方法
1.1 临床资料收集2011年5月~2021年5月福建省立医院病理科诊断及会诊的DDLS病例作为候选病例,依据标准[1]从中剔除不合格病例,筛选出10例DDLS-MLWS。其中男性4例,女性6例;临床表现:60%(6/10)为体检发现,10%(1/10)表现为头痛,30%(3/10)表现为腹胀、腹部包块;影像学检查显示软组织肿块影,其中4例见钙化;80%(8/10)考虑间叶源性肿瘤,其余考虑畸胎瘤等。
1.2 方法手术标本均经10%中性福尔马林固定,常规石蜡包埋,4 μm厚切片。标本均行HE染色,采用EnVision法分别行p16、CD34、STAT6、S-100、Cyclin D1、Ki-67、SMA、desmin、Myogenin、GLUT-1、Claudin-1、CD117、DOG1、MUC-4、β-catenin、HMB-45、ALK1染色,光镜下观察。所用一抗和EnVision试剂盒均购自福州迈新公司。所有病例3~5 μm厚切片,采用FISH法检测MDM2/CDK4基因扩增状态,MDM2试剂盒购自美国雅培公司,CDK4试剂盒购自广州安必平医药公司,按照试剂盒说明书进行操作。采用PCR+Sanger测序法检测1例C-Kit基因外显子9、11、13、17及PDGFRα基因外显子12及18状态,按照本实验室规范操作。
2 结果
2.1 眼观9例为单发,病变位于右蝶骨嵴1例,腹腔3例,结肠1例,腹膜后1例,小肠系膜1例,十二指肠1例,纵隔1例;1例为腹腔肠系膜、小肠、结肠多发肿块,其中DDLS两个,最大径分别为20.0 cm及30.0 cm,其余结节均为高分化脂肪肉瘤(well differentiated liposarcoma, WDL)(最大径5.0~13.0 cm)。本组肿瘤最大径4.0~30.0 cm(平均17.20 cm),似有包膜,表面呈结节状,可见脂肪组织,肿物切面见两种不同区域,一种是灰黄或灰白、灰黄色脂肪样组织,油腻感,质软;另一种为灰白色结节,质中或质硬(图1),部分可见黏液样变区域及出血。
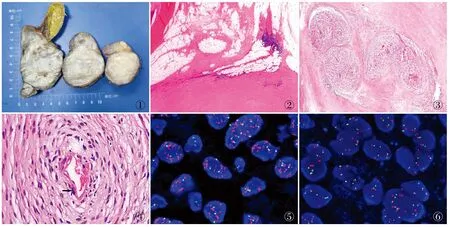
图1 十二指肠浆膜面见一隆起肿物,灰黄色区域为WDL区域,灰白色区域为DDLS区域 图2 WDL低倍镜下表现:脂肪瘤样型、硬化型 图3 MLWS呈结节状分布,大小不等,结节背景中常见玻璃样变性、黏液变性 图4 图3的局部放大,细胞温和,轻度异型性,核分裂象罕见,视野中可见一个核分裂象(箭头) 图5 FISH法检测显示:肿瘤MDM2基因扩增 图6 FISH法检测显示:肿瘤CDK4基因扩增
2.2 镜检镜下见肿瘤均包括WDL(图2)和去分化成分,去分化区域含有脑膜上皮样漩涡结构(meningothelial-like whorls, MLWS)成分。去分化成分以纤维肉瘤(60%,6/10)多见,其他多形性未分化肉瘤占10%(1/10),多形性横纹肌肉瘤及平滑肌肉瘤占10%(1/10),低度恶性纤维黏液样肉瘤占10%(1/10),高级别黏液纤维肉瘤占40%(4/10),纤维瘤病占20%(2/10),结节性筋膜炎样占10%(1/10),孤立性纤维性肿瘤占20%(2/10),炎性肌纤维母细胞瘤占30%(3/10)。40%(4/10)伴有钙化、骨化及软骨化生。30%(3/10)侵犯肠壁。MLWS占肿瘤比例的15%~45%,MLWS结节最大径0.05~2.0 mm,呈结节样、“洋葱皮样”,似神经束膜瘤样,细胞温和,轻度异型性,核分裂象0~1个/10 HPF,结节中央可见血管(图3、4)。
2.3 免疫表型WDL:p16(9/9)、CD34(9/10)、Cyclin D1(7/7)、S-100(7/10)阳性,Ki-67增殖指数2%~10%。去分化成分:CD34(8/10)阳性,GLUT-1(1/10)、Claudin-1(1/8)灶阳性;低度恶性纤维黏液样肉瘤成分:MUC-4阳性(1/10);平滑肌肉瘤成分:SMA、desmin阳性;横纹肌肉瘤成分:Myogenin阳性。Ki-67增殖指数5%~60%;MLWS区域CD34阳性;其余抗体阴性。
2.4 分子病理学检测本组10例采用FISH法检测WDL、去分化区域及MLWS区域,结果显示:8例同时伴有MDM2(图5)/CDK4(图6)基因扩增,1例仅有MDM2基因扩增,1例仅有CDK4基因扩增;1例无C-Kit、PDGFRα基因突变。
3 讨论
DDLS-MLWS较罕见,复习国内外文献及本组合计66例。DDLS-MLWS占DDLS的4.17%~12.0%;统计本科室病例,DDLS-MLWS占脂肪肉瘤的1.96%(10/510),占DDLS的10.99%(10/91)。发病年龄22~77岁(平均52.38岁);男性40例,女性26例(男女比为1.54∶1)。好发于腹膜后(33/66)、纵隔(5/66)、睾丸旁(3/66)、阴囊(3/66)、大腿(3/66)、小肠系膜(3/66)等[2-3]。影像学上表现为软组织肿块影,部分病例中见脂肪成分,多考虑为间叶源性肿瘤、胃肠道外间质瘤及畸胎瘤等。临床无特征性表现,多数以体检发现或无痛性包块,66例中长期高血压、肾纤维肌性发育不良、甲状腺腺瘤、糖尿病、结肠腺癌各1例。本组30%(3/10)病例有肠息肉病史,DDLS-MLWS与肠息肉伴发是否属于罕见综合征有待进一步研究,1例于5年前有皮肤“神经纤维瘤”病史;1例符合DDLS复发;1例多发,较罕见;1例属于WDL复发后为DDLS。MLWS代表一种排列方式,可见于多种软组织肿瘤,如DDLS、神经源性肿瘤等,无特异性;MLWS属于DDLS-MLWS去分化成分中的一种特殊形态,与MDM2/CDK4基因突变有关。大体观肿物一般可见WDL和去分化成分,前者切面呈灰黄色或灰白、灰黄色;后者呈灰白色结节,质中或质硬,可呈鱼肉状,可侵犯周围组织或器官。肿瘤最大径0.30~38.0 cm(平均14.90 cm)。本组肿物最大径为4.0~30.0 cm(平均17.20 cm)。
DDLS-MLWS确诊依赖于病理组织学、免疫表型及分子病理学检查。一般肿瘤有WDL和DDLS区域,或仅有WDL(7/66),其中含MLWS成分。WDL呈分叶状、多结节状结构,可见不等量脂肪组织,其中见脂肪母细胞及异型性间质细胞,形态多样,间质可玻璃样变及硬化,或富于炎症细胞浸润。DDLS去分化成分多样,以纤维肉瘤多见,但结节性筋膜炎样及低度恶性纤维黏液样肉瘤样表现罕见。MLWS常见于去分化区域,少数见于WDL[3]。MLWS直径0.09~20 mm,MLWS占肿瘤总体积5%~75%不等[2]。MLWS细胞形态温和,轻度异型性,核分裂象0~1个/10 HPF,无坏死;中央可见薄壁毛细血管,间质可黏液变性。50%(28/56)DDLS-MLWS伴有骨和软骨化生。MLWS及骨性组织占肿瘤总体积最大为80%[4]。有文献报道DDLS中的成骨约96.43%(27/28)为肿瘤性骨,因其可检测到MDM2基因扩增[5]。本组10例MLWS结节最大径0.05~2.0 mm,占肿瘤主体的15%~45%。目前无MLWS恶变报道,本组亦未见恶性特征。免疫表型上,WDL区域p16、CD34、Cyclin D1、S-100、MDM2、CDK4等阳性,无特异性,作者在工作中发现p16、CD34、Cyclin D1阳性对诊断WDL有一定帮助,Ki-67增殖指数常<10%;去分化成分多数表达CD34、BCL-2,Ki-67增殖指数较高(可达60%);文献报道MLWS区域MDM2、CDK4、p16、Claudin-1阳性[4]。
DDLS-MLWS属于DDLS的一种少见亚型,因此两者分子遗传学特征一致,表现为MDM2/CDK4基因同时扩增或仅一个扩增,少数HMGA2基因扩增。限于技术原因,部分病例未行MDM2/CDK4基因检测;统计文献报道15例行MDM2基因检测,阳性率为93.33%(14/15),均未行CDK4检测。结合本科室统计结果:WDL中MDM2+/CDK4-和MDM2-/CDK4+各占4.17%(1/24);DDLS中MDM2+/CDK4-和MDM2-/CDK4+分别为6.67%(1/15)及13.33%(2/15),提示这组肿瘤单纯行MDM2或CDK4检测存在漏诊风险,建议行MDM2/CDK4双基因联合检测,避免漏诊。
DDLS-MLWS需与以下肿瘤鉴别,(1)WDL:该肿瘤一般无MLWS区域。(2)非典型梭形细胞脂肪瘤样肿瘤:表现为梭形细胞,核深染,染色质粗糙,可有脂肪母细胞、花环样多核巨细胞。肿瘤无MLWS结构。免疫组化标记CD34、p16阳性,RB1缺失;分子检测显示p16基因突变伴RB1基因缺失,无MDM2/CDK4基因扩增,无CHOP基因重排。属于良性,可局部复发,预后佳。(3)外周神经肿瘤:神经束膜瘤及恶性神经束膜瘤、神经鞘瘤及恶性周围神经鞘膜瘤。该组肿瘤好发于肢体、躯干,靠近大神经部位。神经束膜瘤特征结构是瘤细胞呈漩涡状、“洋葱皮”样排列;细胞温和,轻度异型性,无坏死;恶性神经束膜瘤又称为恶性周围神经鞘膜瘤伴神经束膜分化,异型性明显,密度增高,核分裂象增多(>5个/10 HPF),可有坏死;免疫组化标记瘤细胞CD34、EMA、GLUT-1、Claudin-1阳性[6]。恶性周围神经鞘膜瘤:瘤细胞呈束状、漩涡状及片状排列,可见疏松区与致密区,少数瘤细胞呈栅栏状排列,细胞中~重度异型,核分裂象易见(>4个/10 HPF),可见坏死。免疫组化标记瘤细胞S-100、SOX-10和PGP9.5均阳性;H3K27Me3表达缺失。患者可有NF1、NF2突变及PTEN综合征。其它鉴别诊断包括:组织细胞/树突细胞肿瘤、异位脑膜瘤及骨外骨肉瘤等,依据病理学、免疫组化及基因检测等可明确诊断。
DDLS-MLWS主要治疗原则是手术完整切除,必要时辅以化疗、放疗。MDM2/CDK4有望成为治疗靶点。66例DDLS-MLWS患者随访1~264个月,复发1次或多次30.30%(20/66),转移占10.60%(7/66),死亡占15.15%(10/66),带瘤生存占28.79%(19/66),无瘤生存占36.36%(24/66),余13例无随访资料(19.70%,13/66)[4,7]。伴有骨化甚至骨肉瘤时患者预后不良,但非独立预后因素[5]。本组10例随访6~120个月,6例无瘤生存,2例带瘤生存(1例仅CDK4基因扩增,1例MDM2/CDK4同时扩增),1例死亡(MDM2/CDK4同时扩增),1例失访。

