自噬相关蛋白Atg14在碘难治性分化型甲状腺癌的表达及临床意义
罗莹莹,卢其腾,李俊红,周 辉,张筱楠,庞筱安,韦智晓
0 引 言
甲状腺癌是最常见的内分泌恶性肿瘤,占所有癌症的3.1%[1-3]。目前,手术+131I+TSH抑制替代治疗已成为分化型甲状腺癌(differentiated thyroid cancer,DTC)的主要治疗手段,据SEER数据库显示美国甲状腺癌患者的5年生存率高达98.1%[4]。然而,约5%的患者应用131I治疗的效果较差,其10年生存率约为10%[5-7],这部分患者称为碘难治性分化型甲状腺癌(radioiodine refractory-differentiated thyroid cancer, RAIR-DTC)[5, 8-9]。研究表明,自噬与肿瘤的发生发展密切相关,自噬在癌症发生发展的不同阶段起着动态的抑癌或促癌作用[10-12]。自噬相关蛋白 (autophagy-related protein, Atg)是一类自噬组成蛋白, 参与调节自噬起始和延伸等过程。Atg14定位在自噬体上,是III型磷脂酰肌醇-3激酶复合物I(PI3K-CI)的核心成分,通过将其定位于自噬小体形成的位置,指导复合物在自噬中发挥作用[13-14]。已有研究证明,下调Atg14可以促进骨髓瘤、卵巢癌和骨肉瘤细胞的凋亡[14-16];然而,它在DTC的作用仍有待探索。本研究采用免疫组织化学染色方法(Immunohistochemistry, IHC)检测Atg14在RAIR-DTC患者肿瘤组织中的表达水平,探讨其与临床病理特征的关系。
1 资料与方法
1.1 临床资料回顾性收集2013年1月至2019年12月广西医科大学第一附属医院核医学科72例行甲状腺癌手术治疗的DTC患者。其中男24例,女48例,年龄13~72岁,平均年龄(37.0±13.9)岁。纳入标准:①经病理确诊为DTC;②在我院行甲状腺切除术;③至少接受2次131I治疗;④无放化疗史;⑤无其他恶性肿瘤病史;⑥临床资料完整。排除标准:①抗甲状腺球蛋白抗体(antithyroglobulin antibody,TgAb)阳性;②妊娠期或哺乳期妇女;③计划6个月内妊娠者。本研究获得我院伦理委员会的批准[NO.2022-KY-E(194)],患者均签署知情同意书。
1.2分组根据治疗效果分为RAIR-DTC组(碘难治患者,n=37)和NRAIR-DTC组(非碘难治患者,n=35)。RAIR-DTC的诊断标准为在无外源性碘负荷干扰的情况下,TSH刺激状态(>30mIU/L)时,参照文献[5]的方法出现下列情形之一即可界定为RAIR-DTC:①转移灶在清甲成功后的首次131I治疗后全身显像中即表现为不摄碘,致其无法从后续的131I治疗中获益。②原本摄碘的功能性转移灶经131I治疗后逐渐丧失摄碘能力。③部分转移灶摄碘,而部分转移灶不摄碘。④摄碘转移灶在经过多次131I治疗后,虽然保持摄碘能力但仍在1年内出现病情进展。NRAIR-DTC的判断标准包括治愈和好转;治愈:无临床证据支持患者为带瘤状态;即患者已达到临床无瘤生存状态;好转:影像学提示复发灶或转移灶缩小、数量减少,血清甲状腺球蛋白水平下降。
1.3免疫组化染色手术切除的DTC组织标本经甲醛固定和石蜡包埋后切片,采用IHC链霉亲和素-过氧化物酶(streptavidin-peroxidase, SP)法检测Atg14表达情况,IHC染色步骤按说明书进行。Atg14抗体购于GeneTex公司,通用SP法试剂盒、DAB显色试剂盒均购于北京中杉金桥生物技术有限公司。由两位以上副主任病理科医师读片并分析IHC染色结果。在高倍镜下每张切片随机摄取6个视野,采用Image-Pro Plus 6.0图像分析软件分析,计算每张切片的平均光密度值(Average Optical Density, AOD)。
1.4血清学检测所有患者131I治疗前采集血液样本,采用化学发光免疫分析法检测sTg水平,检测范围为0~462.00 μg/L,超出此范围记为462.00 μg/L。计算sTg同比下降率,公式如下:
sTg同比下降率=(sTgbaseline-sTg)/sTgbaseline×100%
sTgbaseline为首次131I治疗前的sTg,sTg为再次131I治疗前的sTg。
1.5131I全身显像半定量分析患者均于131I治疗后第5天行131I全身显像。利用SPECT Region-of-interest软件对患者治疗性131I全身显像中病灶的131I摄取勾画感兴趣区(region of interest,ROI)进行半定量分析,公式如下:
病灶靶区摄取量/本底摄取量(tumor/background,T/B)=病灶最大放射性计数/本底最大放射性计数
其中本底摄取量以正面额骨的摄取量为准。为了避免残余甲状腺组织对病灶131I摄取的影响,我们选取两次131I治疗后的全身扫描图像进行分析,分别记录为T1/B1、T2/B2。本研究中,同一患者有多个病灶时选取病灶最大放射性计数。
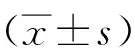
2 结 果
2.1 术后组织标本中癌组织Atg14的表达情况131I治疗前,RAIR-DTC组癌组织中Atg14相对表达量(0.079±0.020)较NRAIR-DTC组(0.034±0.006)明显升高(P=0.001)。免疫组织化学染色情况如下图1所示,棕黄色染色为Atg14染色阳性。
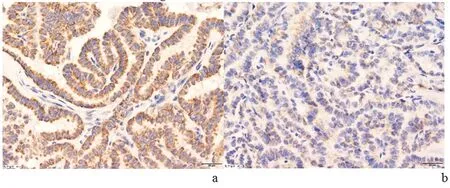
a:RAIR-DTC组;b:NRAIR-DTC组
2.2Atg14的诊断价值ROC曲线分析结果显示:Atg14的AUC为0.995,诊断阈值为0.047,灵敏性为94.6%,特异性为100%,95%CI:0.987~1.000(P<0.01)。提示Atg14可成为碘难治性分化型甲状腺癌的诊断生物标志物。见图2。

图 2 患者Atg14水平的ROC曲线
2.3Atg14表达量与血清sTg、影像学T/B的关系两次131I治疗前,与NRAIR-DTC组血清学sTg水平相比,RAIR-DTC组更高(P<0.05)。RAIR-DTC组sTg同比下降率分别为(0.114±0.759)和(0.900±0.191),明显低于NRAIR-DTC组(P<0.05)。两次131I治疗后,RAIR-DTC组T1/T2均高于NRAIR-DTC组(P<0.05)。见表1。

表 1 两组患者癌组织中sTg及T/B水平的比较[M(P25,P75)]
2.4RAIR-DTC患者Atg14表达水平与sTg同比下降率、T/B的相关性分析经Spearman秩相关分析结果显示,RAIR-DTC组癌组织中Atg14的表达量与首次sTg、再次sTg、血清sTg同比下降率、T1/B1、T2/B2均无相关性(r=-0.13、-0.09、0.12、-0.08、-0.20,P>0.05)。
2.5RAIR-DTC患者Atg14表达水平与其临床病理特征的关系Atg14表达水平与性别、年龄、肿瘤直径、有无局部浸润、是否伴有淋巴结转移、转移部位、分期、危险度分层均无相关性(P>0.05)。见表2。
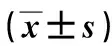
表 2 RAIR-DTC组癌组织Atg14表达与临床病理特征的关系
3 讨 论
绝大多数DTC患者经甲状腺切除术+131I治疗+激素抑制替代治疗预后良好,但部分患者会发展为RAIR-DTC,其治疗一直是核医学亟待攻克的难题。因此,能够尽早诊断RAIR-DTC,对识别高风险患者及个体化治疗具有重要的临床价值。
2015年ATA指南提出,术后Tg是持续性或复发性疾病的独立预测因子[5]。对于RAIR-DTC患者,由于“清甲和/或清灶”治疗无效,甲状腺病灶组织或转移病灶一直存在,导致Tg水平处于较高的状态,本研究中131I治疗前,RAIR-DTC组血清sTg水平相对更高,且sTg同比下降率明显低于NRAIR-DTC组的结论与之相一致。131I全身显像是临床上用于探查不摄碘病灶最有效的手段,在本研究中,RAIR-DTC组T1/B1低于NRAIR-DTC组,而T2/B2高于NRAIR-DTC组,表明RAIR-DTC患者再次接受131I治疗时病灶摄取131I能力明显降低,即使病灶摄取131I,但可能由于对射线的敏感性较差,导致病灶辐射吸收剂量不足,进而致使131I对病灶治疗无效。由于Tg值的测定受到多种内/外在因素的显著影响,且部分肿瘤细胞去分化、Na/I转运能力失衡影响131I的摄取而导致131I全身显像出现假阴性结果从而影响判断,故尚不能将sTg、T/B作为独立预测RAIR-DTC的诊断指标,两者结合可能会有更好的诊断效果。因此,为了更早期的预测RAIR-DTC,寻找更为敏感的分子标志物具有重要的临床意义。
自噬是一种II型程序性细胞死亡,在大多数情况下,自噬促进肿瘤发生,自噬调节细胞死亡的潜在能力使其成为癌症的治疗靶点[17]。III型磷脂酰肌醇-3激酶复合物(PI3KC3)是自噬的核心复合物,其主要由含有Atg14的PI3K-CI以及PI3K-CII组成,通过产生 PI3P 促进自噬的启动和进展,PI3P 正调控自噬体的形成,PI3KC3通过形成蛋白质复合物和直接翻译后修饰调节自噬[18-19]。自噬相关蛋白Atg14又称Atg14L/Barkor,是PI3KC3的重要组成部分,其在自噬中至少有两种功能:①作为连接物形成PI3K-CI,作为吞噬细胞成核的关键成分。②通过将PI3K-CI靶向内质网来引导其在自噬中发挥作用[20]。Atg14的Barkor/Atg14(L)自噬体靶向序列/BATS结构域是将PI3KC3靶向吞噬细胞和/或omegasome膜以及启动自噬体形成所必需的。Atg14 作为一种自噬相关蛋白,已被证明通过调节细胞自噬与肿瘤的进展有关。最近一项研究发现,Atg14在肝癌(HCC)组织样本和细胞中均异常高表达,其与HCC患者的肿瘤分期相关;同时通过体外细胞实验,发现抑制Atg14水平可减弱HCC细胞的增殖能力和细胞侵袭能力[21]。本研究通过IHC法分析肿瘤组织中Atg14表达水平与RAIR-DTC发生的相关性结果显示,RAIR-DTC组患者Atg14表达水平明显高于NRAIR-DTC组,诊断阈值为0.047,灵敏性为94.6%,特异性为100%,表明癌组织中Atg14的高表达可能与DTC向RAIR-DTC进展有关,其机制目前尚不清楚,有待进一步研究证明。本研究中,RAIR-DTC组的一般临床资料与Atg14的表达关系差异无统计学意义,因此尚不能得出Atg14与肿瘤侵袭性存在关联。
综上所述,RAIR-DTC患者癌组织中Atg14的表达水平明显高于NRAIR-DTC组,其可能是诊断DTC向RAIR-DTC进展的重要肿瘤标志物,有助于早期诊断RAIR-DTC,为RAIR-DTC患者提供更精准的治疗。

