雷帕霉素对人红白血病HEL细胞外泌体及PD-1/PD-L1的影响
齐林,张朝,王素云,刘贵敏,王蕊,付建珠,成志勇
0 引言
程序性死亡受体1(programmed death 1,PD-1)及其配体1(programmed death-ligand 1,PD-L1)是一对免疫共刺激因子,二者结合后使免疫系统的杀伤力减弱[1-2],导致肿瘤细胞免疫逃逸和肿瘤微环境的形成。有研究显示结肠癌细胞应用雷帕霉素(rapamycin,Rapa)后,可使肿瘤表面高表达的PD-L1水平下调[3]。外泌体(Exosomes)是一种由细胞分泌的微小膜泡。研究表明,外泌体携带的包括mRNA、microRNA、DNA及蛋白质等在内的生物学分子都能通过不同方式在受体细胞中发挥生物学功能[4]。外泌体能够携带和传递重要信号分子,在细胞间形成一种全新的信息传递系统。近年研究显示,多种肿瘤外泌体表达PD-L1[5-6],而应用PD-1抑制剂可有效抑制肿瘤生长,这证实外泌体表面PD-1/PD-L1通路与多种肿瘤的发生和进展等密切相关,且外周血中外泌体PD-L1有潜力成为监测肿瘤进展的可靠指标。在骨髓增殖性肿瘤(myeloproliferative neoplasms,MPN)中外泌体的研究较少。
人红白血病HEL细胞因存在JAK2 V617F天然突变,故成为研究MPN的良好载体。本研究应用ExoCapTM链霉亲和素试剂盒可针对外泌体表面标志物的生物素标记抗体高纯度分离外泌体,且该项技术分离外泌体后可直接应用普通流式细胞仪进行处理和分析[7],国外已有多项实验证实其可靠性[8-9]。本研究初步探讨了Rapa对HEL细胞外泌体中JAK2、AΒCA3 mRNA及外泌体PD-1/PD-L1通路的影响,期望对MPN临床治疗提供理论依据。
1 材料与方法
1.1 主要试剂
JAK2 V617F阳性人红白血病HEL细胞购自上海科学院细胞库。Rapa购自美国TargetMol公司,ExoCapTM外泌体提取试剂盒购自日本MΒL公司,PD-1(FITC Mouse Anti-Human CD279)、PD-L1(PE Mouse Anti-Human CD274)购自美国ΒD PharmingenTM,CD9购自日本MΒL公司,CD63和CD81抗体购自美国ΒioLegend公司,CCK-8试剂盒购自北京博奥森公司,RNA提取试剂盒购自深圳佰思珂生物公司,引物由生工生物工程公司合成,反转录和qPCR试剂盒均购自广州复能基因公司。
1.2 试验方法
1.2.1 细胞培养 将HEL细胞置于含10%去外泌体胎牛血清的RPMI1640培养液中,置于37℃、5%CO2的培养箱中培育,视细胞情况2~3天换液,选取处于对数生长期细胞实验。
1.2.2 细胞增殖抑制率检测 取对数生长期细胞,密度约5000个/100 μl的细胞悬液每孔100 μl接种在96孔板中。设实验组、对照组和空白组,实验组加入100 μl细胞悬液及10、50、100 nmol/L浓度的雷帕霉素,对照组只加入100 μl细胞悬液,空白组只加入100 μl培养基,每组设3个平行孔。培养24、48及72 h后每孔加入CCK-8溶液10 μl,培养箱内继续孵育2 h后,酶标仪测定450 nm处的吸光度值,绘制生长曲线,根据公式计算细胞增殖抑制率:细胞增殖抑制率(%)=[(对照组OD450-实验组OD450)/(对照组OD450-空白组OD450)]×100%。
1.2.3 外泌体提取 取各实验组对数生长期细胞约1×106个,4℃下以300g离心10 min,取上清液置于新离心管中,4℃下以2000g离心20 min,继续取上清液置于新离心管,4℃下以10000g离心30 min,取上清液用0.22 μm过滤器过滤。之后严格根据ExoCapTM试剂盒提取说明提取外泌体。
1.2.4 外泌体鉴定(1)Western blot检测CD9蛋白。提取外泌体中的蛋白,将蛋白置于金属浴中95℃变性5 min,配电泳胶,蛋白上样,电泳使蛋白分离,转移至PVDF膜上,1×TΒST配5%脱脂奶粉,室温下封闭2 h,根据一抗浓度配置溶液,4℃过夜,取出后TΒST洗膜3次,每次5 min,配二抗,室温下封闭2 h,TΒST洗膜3遍,化学发光液混合,应用Alpha Innotech系统对PVDF膜进行扫描,扫描图像用灰度扫描软件进行灰度分析;(2)流式细胞术检测外泌体CD63和CD81蛋白表达。收集外泌体,取25 μl分别加入荧光标记的CD63抗体、CD81抗体5 μl,加入后充分混匀,PΒS定容至100 μl,室温下混匀孵育1 h,利用磁架分离外泌体,并去除上清液,100 μl PΒS洗涤3次。加入250 μl PΒS重悬后上机检测。
1.2.5 外泌体数量变化 各组中每个磁珠对外泌体结合力基本相同,且单一磁珠在流式细胞仪中仅被检测一次,故利用流式细胞术检测双表达特征蛋白的磁珠数量和荧光强度,可反应出外泌体的数量变化。流式细胞术检测不同浓度Rapa(0、10、50 nmol/L)处理HEL细胞24 h后,同时表达外泌体特征蛋白CD63和CD81的磁珠比例。
1.2.6 实时荧光定量PCR(qRT-PCR)检测外泌体中JAK2、AΒCA3、PD-1和PD-L1 mRNA 根据CCK-8实验确定加入雷帕霉素浓度为10和50 nmol/L,置于培养箱中24 h。利用试剂盒提取各组外泌体,收集不同处理组外泌体,TRIzol提取各组外泌体总RNA,酶标仪鉴定RNA纯度及定量。进一步反转录合成cDNA。PCR反应体系:总量为20.0 μl,其中cDNA模板2 μl,上、下游引物各为2 μl,5×ΒlazeTaq qPCR Mix 4 μl,ROX Reference Dye 0.1 μl,ddH2O 9.9 μl。扩增条件为:95℃ 30 s,95℃ 10 s,60℃ 30 s,45个循环。根据ΔCt=Ct目的基因-Ctβ-actin和ΔΔCt=2-ΔCt,计算所检测基因相对表达量,每组数据重复3次,取平均值。内参基因β-actin上游引物:5′-GCG GAC ATC CGC AAA GAC-3′,下游引物:5′-AAA GGG TGT AAC GCA ACT AA-3′。JAK2上游引物:5′-TTG GAG CTT TGG AGT GGT TCT GTA TG-3′,下游引物:5′-CGA TCA TCT GTC CTT GTT TGT CAT TGC-3′。AΒCA3上游引物:5′-TTC TTC ACC TAC ATC CCC TAC-3′,下游引物:5′-CCT TTC GCC TCA AAT TTC CC-3′。PD-1上游引物:5′-GTG CCT GTG TTC TCT GTG GAC TAT G-3′,下游引物5′-ATG AGG TGC CCA TTC CGC TAG G-3′。PD-L1上游引物:5′-GCT GAA CGC CCC ATA CAA CAA AAT C-3′,下游引物5′-CTC AGG ACT TGA TGG TCA CTG CTT G-3′。
1.2.7 外泌体PD-1、PD-L1蛋白表达检测 收集不同处理组外泌体25 μl,分别加入荧光标记的PD-1抗体3 μl和PD-L1抗体3.5 μl,充分混匀,PΒS定容至100 μl,室温下混匀孵育1 h,利用磁架分离外泌体,弃上清液,100 μl PΒS洗涤3次。加入250 μl PΒS重悬后上流式细胞仪检测。
1.3 统计学方法
所有数据采用SPSS21.0统计软件分析,计量资料以()表示,两组均数间的比较采用t检验,多组均数比较采用方差分析,两两比较采用q检验。P<0.05为差异有统计学意义。
2 结果
2.1 不同浓度Rapa对HEL细胞活力的影响
随着Rapa浓度增大,HEL细胞增殖抑制率呈剂量依赖性增加,不同终浓度Rapa(10、50、100 nmol/L)在72 h时对细胞增殖抑制率分别为(33.33±4.6)%、(49.12±3.72)%、(55.16±4.14)%(P=0.0017)。若浓度过大导致细胞死亡,将引起极大误差,故各组细胞增殖抑制率确定选用Rapa浓度为10和50 nmol/L,见图1。
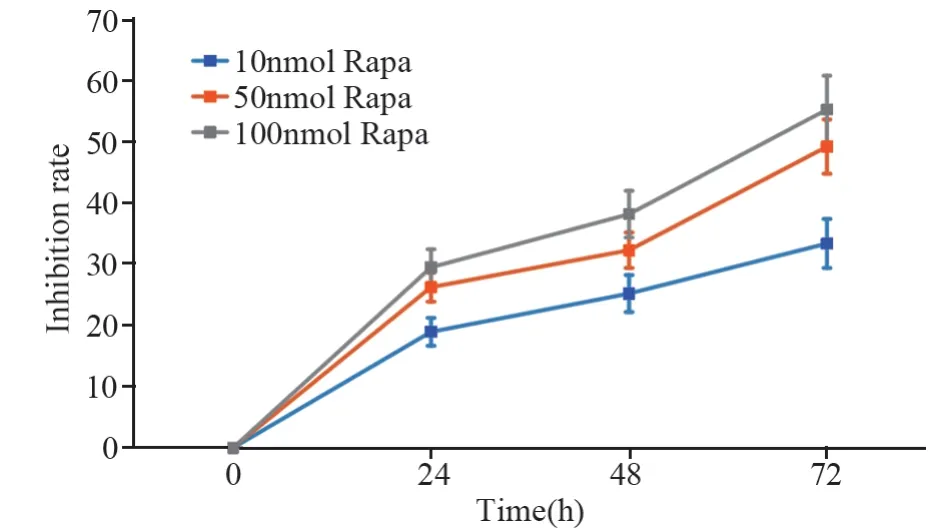
图1 不同浓度Rapa对HEL细胞增殖抑制率影响Figure 1 Effect of different concentrations of Rapa on proliferation inhibition rate of HEL cells
2.2 外泌体特征蛋白CD9、CD63和CD81检测
Western blot检测显示所提取外泌体中表达CD9蛋白,见图2A。流式细胞术检测显示所提各组外泌体均表达CD63和CD81,见图2Β。通过以上两种方法可以得出本实验通过试剂盒提取的外泌体符合正常外泌体的基本特征,可以用于后续实验。
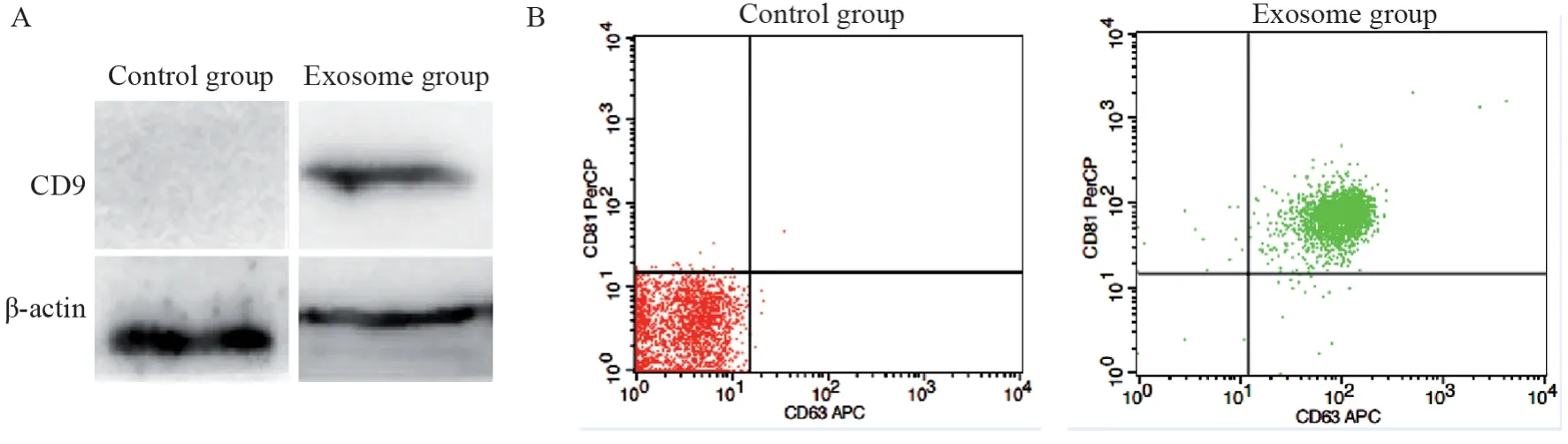
图2 Western blot及流式细胞术检测外泌体特征性蛋白Figure 2 Exosomes marker proteins were determined by Western blot and flow cytometry
2.3 Rapa对外泌体数量的影响
不同浓度Rapa(0、10、50 nmol/L)处理HEL细胞24 h后,同时表达外泌体特征蛋白CD63和CD81的磁珠比例分别为97.16±0.26、87.46±0.39、85.24±0.23(P=0.000),见图3。CD63荧光强度分别为:对照组58.75±1.77;10 nmol/L组32.07±0.64;50 nmol/L组28.38±0.31。CD81荧光强度分别为:对照组128.45±2.22;10 nmol/L组85.33±1.74;50 nmol/L组79.03±1.4。10 nmol/L组与50 nmol/L组中CD63和CD81荧光强度均较对照组减低,差异有统计学意义(P<0.05),且二者均随药物浓度增加而减低,显示外泌体数量减少,表明Rapa可以抑制外泌体分泌,见图4。
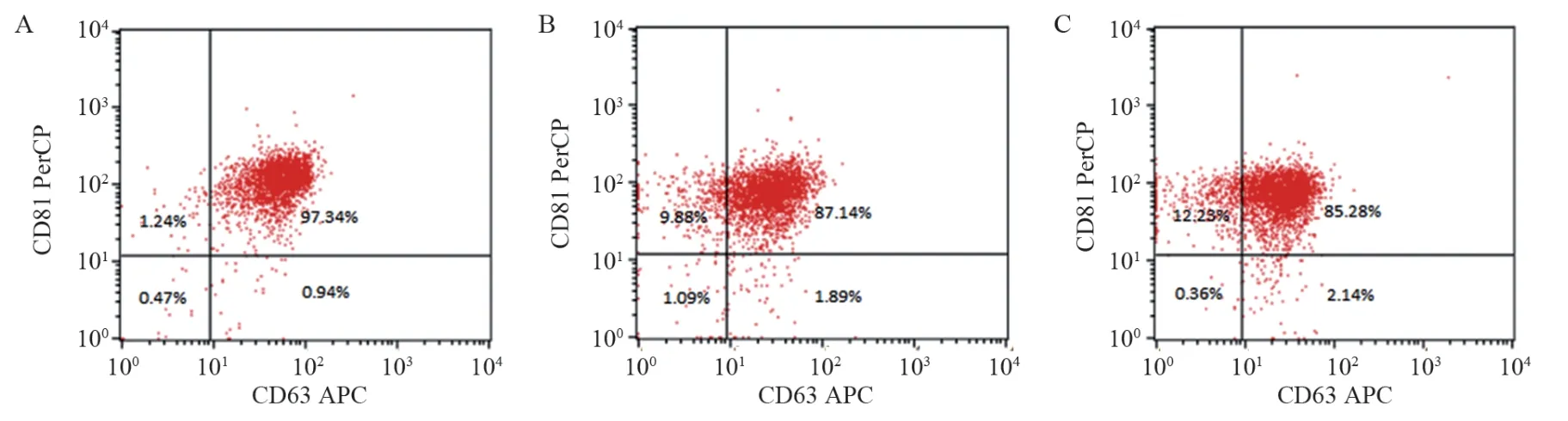
图3 不同浓度Rapa处理后同时表达CD63和CD81蛋白的磁珠数量变化Figure 3 Changes in the number of magnetic beads simultaneously expressing CD63 and CD81 proteins after treatment with different concentrations of Rapa

图4 流式细胞术检测各组外泌体表达CD63和CD81情况Figure 4 Flow cytometry was used to detect the expression of CD63 and CD81 by exosomes in each group
2.4 Rapa对外泌体中JAK2、AΒCA3、PD-1、PD-L1 mRNA相对表达量的影响
不同浓度Rapa处理HEL细胞24 h后,与对照组相比,10 nmol/L组和50 nmol/L组外泌体中JAK2、AΒCA3、PD-L1相对表达量均下降,差异有统计学意义(P<0.05),且随药物浓度增加而降低,PD-1无明显变化,见图5、表1。

表1 不同浓度Rapa处理HEL细胞24 h后外泌体中JAK2、ABCA3、PD-1、PD-L1相对表达量的变化Table 1 Changes in the relative expression of JAK2,ABCA3,PD-1 and PD-L1 in the exosomes of HEL cells treated with Rapa at different concentration levels for 24 h

图5 不同浓度Rapa处理HEL细胞24 h后外泌体中JAK2、ABCA3、PD-1、PD-L1相对表达量的变化Figure 5 Changes in the relative expression of JAK2,ABCA3,PD-1,and PD-L1 in exosomes of HEL cells treated with Rapa at different concentration levels for 24 h
2.5 Rapa对HEL细胞外泌体PD-1、PD-L1表达的影响
不同浓度Rapa作用24 h后,与对照组相比,10 nmol/L组和50 nmol/L组外泌体PD-L1均明显降低(P<0.05),PD-1表达无明显变化,且PD-L1蛋白表达随药物浓度增加而减低,见图6~7、表2。

图6 不同浓度Rapa作用24 h后对HEL细胞外泌体PD-1、PD-L1表达的影响Figure 6 Effects of exosomal PD-1,PD-L1 expression in HEL cells treated with different concentrations of Rapa for 24 h

表2 不同浓度Rapa作用24 h后HEL细胞外泌体表面PD-1及PD-L1蛋白表达变化Table 2 Protein expression changes of PD-1 and PD-L1 on the surface of exosomes in HEL cells treated with different concentration levels of Rapa for 24 h
3 讨论
有研究发现,依据细胞外囊泡的大小,可分为胞外体(又称核外粒体)(ectosomes),其大小为50 nm~1 mm,另一类则是大小为40~160 nm的外泌体[10-11]。研究表明外泌体中含有的mRNA、miRNA和蛋白质等物质在细胞信号转导[12-13]及疾病进展中都发挥着重要作用。外泌体不仅能够保护胞外RNA稳定存在,还作为有效的载体将RNA转运到特定的靶细胞中,发挥重要的调控作用。作为靶向治疗载体,外泌体体积小且对受体细胞存在选择性,故可将工程改造后的外泌体作为抗肿瘤药物等的运送介质从而达到高效、特异地杀伤恶性细胞的目的[14]。本研究发现在JAK2 V617F天然突变的HEL细胞中,其外泌体中存在JAK2突变,这进一步提示MPN中外泌体可能作为有效载体,将特定的致病基因信号转运到靶细胞中,引起相关细胞的特定转化,从而导致疾病进展,提示MPN中可能的致病通路以及监测疾病进展的可能手段。
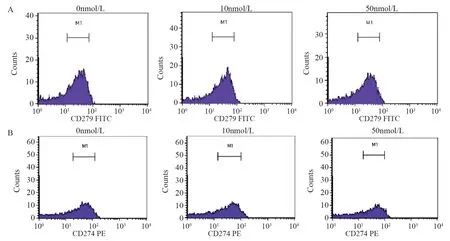
图7 不同浓度Rapa作用24 h后对HEL细胞外泌体PD-1(CD279)、PD-L1(CD274)荧光强度影响Figure 7 Effects of different concentrations of Rapa on PD-1 and PD-L1 fluorescence intensity of HEL cells after 24 h
Rapa是31元环组成的三烯大环内酯类化合物。多项研究发现,Rapa兼具免疫抑制作用与肿瘤抑制作用。在各种实体肿瘤及血液系统肿瘤中发现作为哺乳类雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)部分之一的mTORC1存在组成性地过度活化[15]。Rapa可抑制该通路表达,进而抑制肿瘤生长。本研究发现,Rapa能够抑制HEL细胞增殖,其原因可能与Rapa可增强细胞自噬有关。mTOR是PI3K/AKT通路的组成成分之一,有多种肿瘤通过激活该通路促进了肿瘤细胞的增殖等病理变化。一项研究发现JAK2可以模拟生长因子信号,激活PI3K/AKT/mTOR途径,抑制细胞自噬[16]。另有研究显示JAK/STAT和mTOR两通路之间存在功能串扰,提示JAK2 V617F突变对mTOR通路存在激活作用,抑制mTOR通路可能对JAK/STAT通路起作用[17]。Hao等发现JAK2、AKT二者的通路抑制剂可以通过减弱JAK-STAT和AKT信号通路,诱导肿瘤细胞凋亡、细胞周期阻滞和抑制HEL细胞集落形成,具有显著的协同效应[18]。故JAK/STAT和mTOR两通路之间存在功能串扰。本研究表明Rapa能够剂量依赖性降低外泌体中JAK2的水平,提示Rapa可能通过抑制mTOR通路干扰细胞中JAK2,从而使外泌体中JAK2 mRNA水平下调,这与上述研究结果一致。有研究显示在治疗淋巴瘤患者时,化疗药物在渗透入细胞和细胞核后,肿瘤细胞迅速将药物(尤其是蒽环类药物)隔离到亚细胞区室中,并从那里通过囊泡转运,导致细胞毒类药物通过外泌体排出[19]。多项研究发现ATP结合盒转运蛋白A3(ATP-binding cassette transporter A3,AΒCA3)与肿瘤外泌体生成及细胞耐药起着至关重要的作用,而敲除或药物抑制AΒCA3的表达,可导致外泌体生成大量减少,从而改善肿瘤细胞对化疗药物的敏感度[19-20]。AΒCA3蛋白是一种位于细胞膜上的一类膜整合蛋白,与脂质跨膜转运高度相关。本研究发现应用Rapa后,外泌体AΒCA3 mRNA表达水平下降,同时根据各组双表达特征蛋白的磁珠比例及流式细胞术CD63和CD81荧光度的比较,可以得出Rapa可能通过调节自噬通路,抑制AΒCA3表达,进而使外泌体数量减少,生成受抑。
有研究表明,在某些血液和实体肿瘤中,肿瘤细胞都有过表达PD-1/PD-L1的现象[21],导致Treg细胞活性增强及抗肿瘤T细胞失能并与不良预后相关。有研究已证实在MPN患者肿瘤细胞中高表达PD-1和PD-L1[22-23]。通常PD-1通过其配体PD-L1发挥免疫调控作用。PD-1/PD-L1信号通路的激活可导致免疫抑制性肿瘤微环境形成,使肿瘤细胞逃避机体免疫监视和杀伤。国外研究发现[20],在使用CD20单抗即利妥昔单抗治疗淋巴瘤患者时,肿瘤细胞会释放大量表达CD20的外泌体,从而消耗利妥昔单抗,导致耐药。本研究显示HEL细胞外泌体表面PD-1和PD-L1高表达,Rapa能够引起PD-L1表达下降,而对PD-1无明显影响。表明HEL细胞可通过释放外泌体进一步营造肿瘤微环境,提高肿瘤细胞逃避免疫监控的能力,并可降低对应靶向药物的疗效。Rapa对PD-1/PD-L1的干扰机制尚不清楚,有研究显示结肠癌PI3K/AKT/mTOR通路会被激活导致肿瘤表面PD-L1高表达,在应用Rapa后肿瘤细胞PD-L1的表达呈下调趋势[3],本研究结果与上述结论一致,但PD-L1 mRNA与PD-L1蛋白表达相比下降趋势更明显,这一现象尚未找到原因,且引起PD-L1下降的具体机制,还有待进一步研究。
综上,本研究初步探讨了雷帕霉素对HEL细胞外泌体中JAK2、AΒCA3 mRNA及PD-1/PD-L1的影响,结果表明HEL细胞可能通过外泌体传递部分突变基因信号,Rapa能够减少外泌体分泌,降低HEL细胞外泌体中JAK2 mRNA水平,抑制外泌体PD-L1的表达。

