不同pH条件下锑对水稻幼苗的毒害效应
姚丽华,查建军,李亚丽,潘小翠,于红梅,束良佐*
(1.浙江师范大学地理与环境科学学院,浙江 金华 321000;2.南方科技大学台州研究院,浙江 台州 318000;3.台州学院生命科学学院,浙江 台州 318000)
锑(Sb)是一种有毒的类金属元素,在地壳中的自然含量约为0.2~0.3 mg·kg-1,土壤中锑的背景含量约为0.3~2.3 mg·kg-1[1]。我国是产锑大国,锑矿储量位居世界第一,产量约占世界总产量的79%[2]。近年来,由于锑矿开采以及含锑产品的不合理利用,导致环境中锑的含量急剧上升[3-4],尤其是湖南、贵州、广西等锑矿较集中的地区土壤锑含量远超过其土壤背景值[5-8]。宋书巧等[9]在广西刁江沿岸农田土壤的调查分析中发现,该地土壤中的锑含量高达1 000 mg·kg-1。何孟尝等[1]对湖南锡矿山锑矿附近不同地点取样调查发现,该区域土壤的锑浓度为100.6~5 045.0 mg·kg-1。环境中高含量的锑会影响作物生长,进而通过食物链被人体吸收,危害人体健康。
水稻(Oryza sativa)是世界第二大粮食作物,在我国三大粮食作物中产量居首位,其播种面积约占粮食作物播种总面积的30%,产量约占粮食总产量的40%[10-11]。香港食品安全指南限制了水稻中允许的最大锑含量为1 mg·kg-1[12]。然而,在锑污染地区种植的水稻中锑含量可高达5.79 mg·kg-1[13]。何孟尝等[14]对湖南省锡矿山锑冶炼厂周边生长的水稻进行调查研究,发现水稻体内富集了大量锑,其含量具体表现为根>茎>叶。水稻对锑具有一定的吸收富集能力,且水稻是锑矿富集区主要的粮食作物。对锑矿山周边居民日常摄入食物中锑来源调查表明,摄入的锑中有33%来源于稻米,因此,种植和食用水稻已成为矿区居民接触锑的主要途径[15],这对矿区居民的健康造成很大的危害。
环境的pH值对植物吸收利用土壤养分有着重要影响,同时也是影响土壤中重金属存在形态与活性的关键因素[16]。WILSON等[17]绘制了不同系统下的pe-pH图,表明不同的pH值使得锑有着不同的沉淀形态和离子形态。酸性环境下,矿石中的碳酸盐、碳酸氢盐和氧化物会不断溶解,使得锑从沉淀形态转换为离子形态,并且矿石结构会变得十分疏松,进一步促进锑的释放[18-19]。此外土壤吸附重金属的能力以及重金属的迁移能力在很大程度上也受土壤pH值影响。TIGHE等[20]研究发现土壤中非结晶Fe氢氧化物对Sb(Ⅴ)的吸附量在pH为4时最大。CAI等[21]研究也发现锑在钙质土壤中的迁移性和pH有关,钙质土壤的pH大于7是锑迁移性高的重要原因。因此,不同的pH在不同的土壤环境中对锑的影响存在差异。由于土壤中重金属的存在形态和迁移能力会严重影响植物对重金属的吸收量,且我国锑污染区域土壤pH差异较大[22-23],但是pH对水稻吸收锑的影响机制尚不明确。
本研究以水稻为研究对象,通过水培试验,探究不同pH条件下锑污染对水稻幼苗生长及生理机制的影响,为锑污染区水稻的安全生产提供参考依据。
1 材料与方法
1.1 试验材料
化学试剂:酒石锑酸钾(C8H4K2O12Sb2),分析纯;供试材料选取水稻(Oryza sativaL.),品种为籼粳杂交稻嘉优中科3号(浙江省台州市台农种业有限公司)。
1.2 试验方法与处理
挑选籽粒饱满的种子用5%NaClO溶液消毒20 min后,用去离子水清洗干净,将消毒洗净的种子放入32℃的恒温恒湿培养箱中避光催芽,催芽期间每日更换3次蒸馏水,3 d后将露白萌发的种子均匀洒在育苗盘(含1/2强度营养液)中培养,育苗盘中的营养液以刚好浸没种子为宜。待幼苗长至两片真叶时,挑选6株长势基本一致的幼苗(用海绵固定在带孔的盖子上)移栽到2 L黑色塑料水培桶,水培桶中含有全强度的木村B营养液[24],每桶设置3穴,每穴2株。营养液 配 方为0.36 mmol·L-1(NH4)2SO4,0.55 mmol·L-1MgSO4·7H2O,0.36 mmol·L-1Ca(NO3)2·4H2O,0.27 mmol·L-1K2SO4,0.18 mmol·L-1KH2PO4,9.10 μmol·L-1MnCl2,20 μmol·L-1H3BO3,0.77 μmol·L-1ZnSO4·7H2O,0.32 μmol·L-1CuSO4·7H2O,0.15 μmol·L-1(NH4)6Mo7O24·4H2O,20 μmol·L-1Fe-EDTA。幼苗生长前期每隔1 d换一次营养液,待苗培养至30 d后每日更换营养液。用0.1 mol·L-1NaOH或HCl调节pH值,每日3次,保持pH值处于设定梯度,期间pH值变化不超过0.5。试验在人工培养室中进行,光源由LED灯提供,光照时间设置为12 h·d-1,光照强度为200 μmol·m-2·s-1[25-26],温度为26.0±1℃,相对湿度为60%~70%。
待幼苗在全强度营养液中适应一周后,以酒石锑酸钾的形式向营养液中加入锑,锑浓度分别为0、0.016 mmol·L-1,该浓度的设置基于向猛等[26]和LONG等[27]的研究。锑处理40 d后收样。用NaOH或HCl将营养液的pH值调节至4.0、5.0、6.0、7.0共4个梯度,因此试验共8个处理:(1)pH=4 Sb0(营养液内不加Sb);(2)pH=5 Sb0;(3)pH=6 Sb0;(4)pH=7 Sb0;(5)pH=4 Sb(营养液内含0.016 mmol·L-1Sb,下同);(6)pH=5 Sb;(7)pH=6 Sb;(8)pH=7 Sb。每个处理重复4次,共32盆。在幼苗生长期内每日随机调整桶的位置。
1.3 测定项目及方法
1.3.1 叶绿素含量的测定
选取植株第3片叶的中上部位(避开大叶脉),采用SPAD-502型便携式叶绿素仪多点测定SPAD值。每盆测定4株,取各株平均值代替该盆水稻叶片叶绿素含量。
1.3.2 叶绿素荧光参数的测定
在水稻幼苗培养至第40天时,选取第3片叶片用暗适应叶夹对叶片进行充分的暗适应,30 min后,用叶绿素荧光仪MINI-PAM-II(Walz,德国)测定不同处理下水稻叶片叶绿素荧光参数,包括PSⅡ电子传递速率(ETR)、光化学猝灭系数(qP)和非光化学猝灭系数(NPQ)、最大光化学效率(Fv/Fm)。每盆选取4株水稻叶片测量并取其平均值代表该重复。
1.3.3 叶绿素荧光快速光响应曲线的测定
待幼苗培养至第41天,利用叶绿素荧光仪MINIPAM-II(Walz,德国)测定不同处理下水稻叶片的快速光响应曲线。仪器内置光强(PAR)梯度分别为0、63、86、120、184、276、406、607、793、1 110、1 447 μmol·m-2·s-1,每个光强梯度持续20 s,每盆以不同水稻叶片重复测量5次,取平均值。
1.3.4 幼苗生长特性的测定
每盆选4株水稻植株用卷尺测量其株高,并用直尺测定中上部充分展开叶片的叶宽、叶长。根据公式计算该叶片面积[28],叶面积(cm2)=长度(cm)×宽度(cm)×K,校正系数K=0.75。
1.3.5 保护酶和丙二醛含量
超氧化物歧化酶(SOD)活性采用抑制氮蓝四唑光还原比色法测定;过氧化物酶(POD)活性采用愈创木酚法测定;过氧化氢酶(CAT)活性采用紫外吸收法测定;丙二醛(MDA)含量采用硫代巴比妥酸比色法[29]测定。均采用鲜样含量。
1.3.6 根系与地上部锑的含量
锑处理40 d后收样,将植株地上部和根部用去离子水洗净后,放置于70℃烘箱中干燥48 h后研磨,称取过200目筛的植物样品0.1 g于聚四氟乙烯管中,并加入2 mL HNO3和1 mL H2O2溶液密封24 h后,在180℃的烘箱中消化12 h,冷却至室温,然后放置在160℃的电热板上加热赶酸,直至液体呈黄豆粒大小,用去离子水将其转移至50 mL容量瓶,定容、过滤。采用电感耦合等离子体质谱仪(ICP-MS)测定水稻各部位锑含量。同时做空白和标准样品进行质量控制。
1.4 数据处理
试验数据采用Excel 2016处理,结果以平均值±标准误差表示,采用SPSS 22.0软件对数据进行统计分析,在95%置信水平下,采用LSD法进行单因素方差分析,复合实验采用双因素方差分析。采用Sigma-Plot 14.0软件制图。
2 结果与讨论
2.1 不同pH处理对锑胁迫下水稻植株锑吸收的影响
锑胁迫下,不同pH处理对水稻植株各器官锑的吸收量存在显著差异(表1)。在pH 7条件下,水稻根部吸收的锑含量分别较pH 4、pH 5、pH 6条件下减少了21.76%、27.30%、25.12%。pH 4处理时,水稻植株地上部吸收的锑含量达到167 mg·kg-1,是中性pH(pH 6、pH 7)处理均值的1.41倍,与pH 5处理之间的差异未达到显著水平。这可能是营养液中酸性条件下锑主要以Sb(Ⅲ)为主,随着pH增加水稻根表的铁斑会将其氧化形成Sb(Ⅴ)[30],水稻对Sb(Ⅴ)的吸收能力弱于Sb(Ⅲ),进而导致水稻中吸收的锑含量减少[31]。
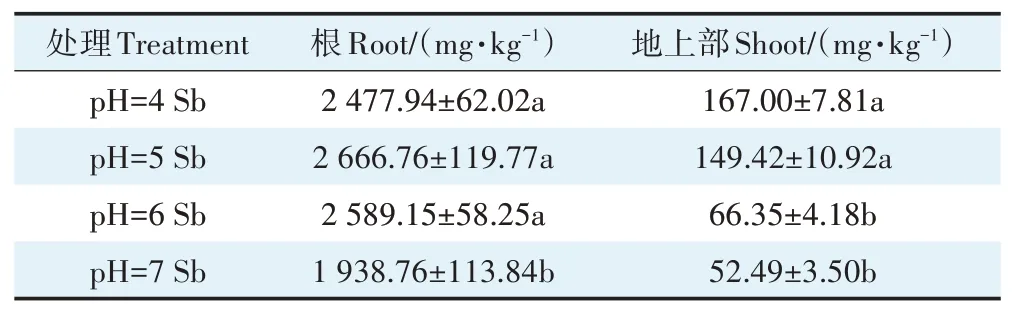
表1 不同pH值条件下锑处理对水稻植株锑含量的影响Table 1 Effects of Sb stress on Sb uptake in rice plants under different pH conditions
2.2 对水稻生长特性的影响
锑对植物是一种非必需元素,当植物体内锑累积到一定含量时会对植物产生毒害效应[32]。具体表现为植株矮小、叶片发黄、生长缓慢以及生物量减少等。经锑处理的植株,其株高均显著低于无锑处理组(表2),pH 7、pH6、pH5、pH 4分别下降了4.3%、4.98%、11.72%和9.16%。但锑处理后的叶片长、水稻叶宽和叶面积受毒害作用的大小随pH变化存在较大差异。从pH 7降到pH 4,地上部株高和叶片长分别降低了4.09%、4.42%,叶宽、叶面积未产生显著性变化。低pH条件和锑处理均会显著降低水稻地上部及根部的生物量(图1)。这与前人在水稻、玉米和小麦中的研究结果相似[33-36]。植物吸收的锑会占用必需元素Fe2+、Zn2+、Ca2+等转运离子通道并与锌、钙转运蛋白结合,从而影响蛋白质结构及功能,破坏植物体内离子平衡,引起植株营养失衡[36],同时又会抑制可溶性蛋白质、可溶性糖和淀粉的合成进而影响植物的生长[37]。由表2可知,pH和锑对水稻地上部生长特性均有极显著的交互作用(P<0.01),两者的交互作用使低pH条件(pH 4、pH 5)下水稻的株高、叶长下降均值是中性pH条件(pH 6、pH 7)的2.25倍和2.29倍;水稻叶宽、叶面积也较中性pH下减少了18.32%和23.95%。随着pH降低,水稻植株地上部和根部的生物量下降幅度也逐渐增加。这表明重金属胁迫和低pH可能产生复合胁迫,进一步抑制水稻的生长。一方面在低pH条件下,水稻幼苗根系细胞膜透性增大,促进锑的跨膜运输,增加细胞内锑的含量,加重锑对根系的伤害,另一方面锑胁迫下,水稻植株根系的细胞膜被破坏,H+-ATP酶活性受到抑制,增加细胞外H+进入,减少细胞内H+流出,进而导致细胞质酸化加剧,使根系损伤加重[38-39]。
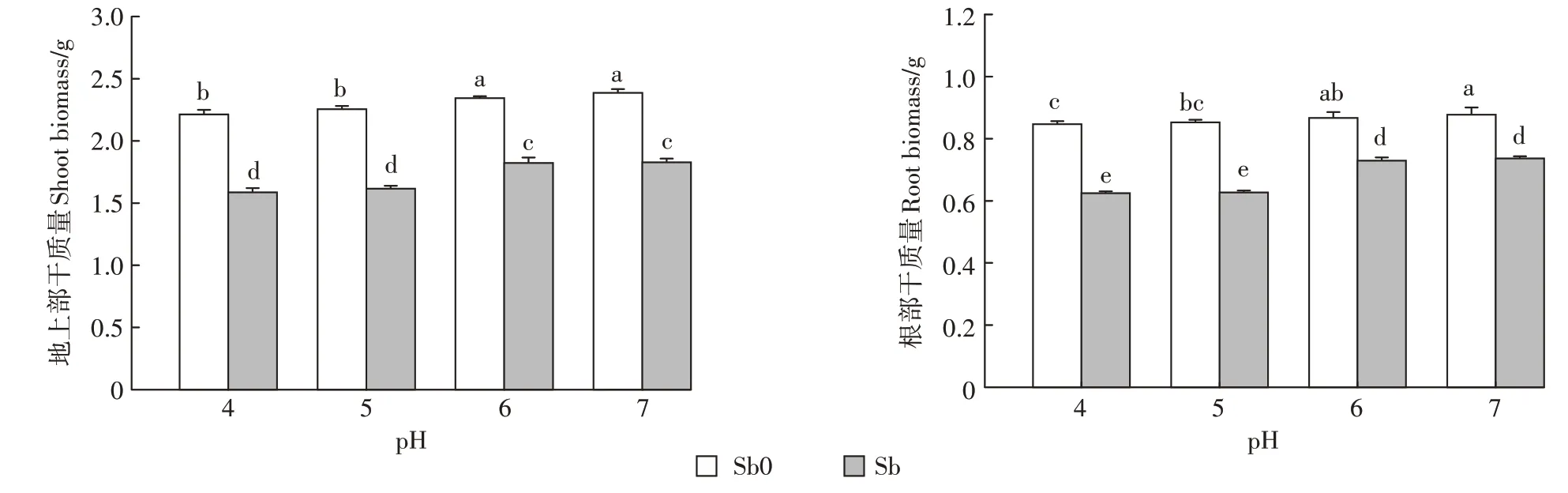
图1 不同pH条件下锑对水稻生物量的影响Figure 1 Effects of antimony on biomass accumulation of rice seedlings under different pH conditions
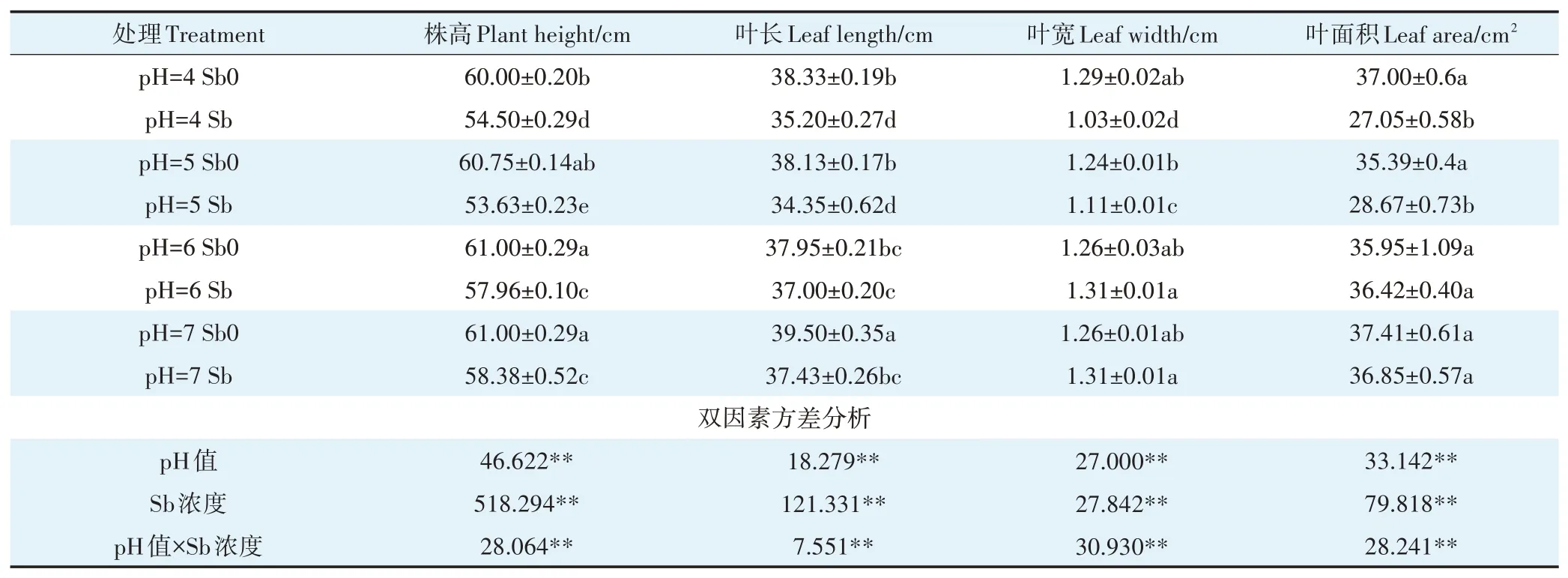
表2 不同pH条件下锑对水稻地上部生长的影响Table 2 Effects of Sb on shoot growth of rice seedlings under different pH conditions
2.3 对水稻叶片SPAD值的影响
叶绿素是植物光合作用的物质基础,其含量高低在一定程度上能够反映植物叶片光合作用功能强弱。本研究中经锑处理的植株,pH 4、pH 5、pH 6和pH 7条件下叶片SPAD值较无锑处理的植株分别下降了14.64%、15.15%、12.73%和12.23%(图2)。一方面锑胁迫可能会抑制有关叶绿素合成酶的活性,使叶绿素的合成受阻;另一方面会大量诱导产生的活性氧破坏细胞膜的结构与功能,使叶绿体膜膨胀破裂,进而导致叶绿素被降解[40-41]。pH 6和pH 7条件下水稻叶片SPAD值无显著性差异,但其均值较低pH条件(pH 4、pH 5)显著增加。由方差分析结果可知,锑处理和pH值对水稻叶片SPAD值存在极显著的交互作用(P<0.01),在低pH条件下(pH 4、pH 5)降幅高于中性pH处理。这和前人在花椰菜、菹草上的研究结果相似[16,42],其研究表明植物在酸性条件下易失绿,叶绿素转变为叶褐素,进而影响植物的光合作用。本研究结果也表明在相同锑浓度下,pH 6、pH 7条件下水稻叶片光合色素遭受的损伤较小,受锑胁迫影响较轻。磷、镁、钾等营养元素在保证叶绿体膜的结构和功能上至关重要,而在pH处于中性条件时大多数营养元素有效性高,促进水稻植株对营养元素的吸收[43],从而在一定程度上缓解了锑胁迫造成的水稻吸收营养元素减少带来的毒害效应[44]。
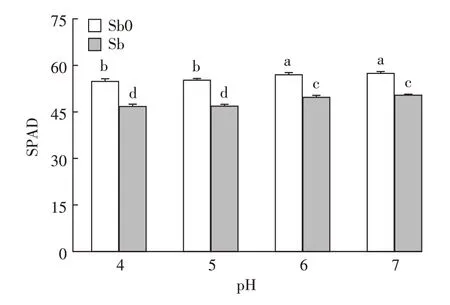
图2 不同pH条件下锑对水稻叶绿素SPAD值的影响Figure 2 Effects of antimony on chlorophyll SPAD values of rice seedlings under different pH conditions
2.4 对水稻叶绿素荧光特性的影响
叶绿素荧光参数是探讨植物光合性能的重要探针[41]。Fv/Fm能够反映PSⅡ原初光能转化效率,Y(Ⅱ)反映植物叶片实际光合效率,qP表征PSⅡ反应中心吸收的光能用于光化学电子传递的份额,ETR反映实际光反应过程中的表观电子传递效率[45-46]。PSⅡ是植物光合作用的重要部位,同时也是重金属胁迫的重要位点[45]。研究表明重金属胁迫会影响水裂解端的电子流,抑制PSⅡ活性,降低PSⅡ的原初光能捕获能力和电子传输能力,从而抑制植物光合作用[46-47]。本试验中经锑处理的植株,Fv/Fm、Y(Ⅱ)、ETR、qP值均显著下降(表3),其中ETR值在pH 4、pH 5、pH 6和pH 7条件下较无锑处理分别下降了17.32%、17.32%、14.65%和14.11%;而表征热耗散引起的荧光猝灭qN、NPQ表现出的规律正好相反,即锑处理后,qN、NPQ值均显著上升,其在各pH下的均值分别上升了25.67%、16.83%。Fv/Fm、Y(Ⅱ)、ETR和qP值均随pH的降低而降低,其中在pH 7和pH 6之间无显著性差异,但均高于pH 5和pH 4处理;而qN值和NPQ值则在低pH下增加。这说明锑胁迫破坏了光合机构,使PSⅡ反应中心光能转换效率和电子传递能力降低,进而抑制了植物的光合作用;而幼苗能够通过自身的调节机制将过多激发能以热能的方式耗散,从而降低对PSⅡ反应中心的破坏程度,实现植株的自我保护。据双因素方差分析可知锑处理和pH值对Fv/Fm、Y(Ⅱ)、qP、qN和NPQ值均有显著的交互作用,使Fv/Fm、Y(Ⅱ)、qP值在低pH条件下的下降均值是中性pH条件下的2.22、1.48倍和1.65倍,而二者交互作用对ETR值未产生显著性影响。这说明锑胁迫对水稻幼苗光合作用的破坏程度在低pH条件下最重,可能是在低pH条件下,叶片内蛋白酶活性降低,相关电子传递受阻,光能转换效率随之降低[48];且幼苗在低pH和锑胁迫下qN和NPQ值增幅最大,一方面反映了叶片的自我保护机制,另一方面也表明了幼苗吸收的大量能量以热能形式耗散,只有小部分能量被利用,从而导致其不能更好地进行光合作用。

表3 不同pH条件下锑对水稻叶绿素荧光的影响Table 3 Effects of Sb on chlorophyll fluorescence of rice seedlings under different pH conditions
2.5 对水稻叶绿素快速光响应曲线的影响
α值、ETRm值、IK值是反映植物光合能力的重要指标。不同pH下(pH 4~pH 7)锑处理使得水稻叶片的α值、ETRm值、IK值均较无锑处理分别下降了19.75%、24.15%和15.80%(表4);α值、ETRm值、IK值均随pH值升高而上升(表4),与pH 4相比,α值、ETRm值、IK值在pH 7条件下分别增加了0.07、0.15、0.05倍。pH值和锑浓度的交互作用对α、ETRm和IK的影响虽未达到显著水平(P<0.01),但均在低pH时下降幅度最大,其下降均值分别是中性pH条件下的1.15、1.14、1.07倍。这表明锑胁迫和低pH均会破坏植物的光合中心,降低植物的光合能力;且锑胁迫下,低pH值会加重破坏程度。
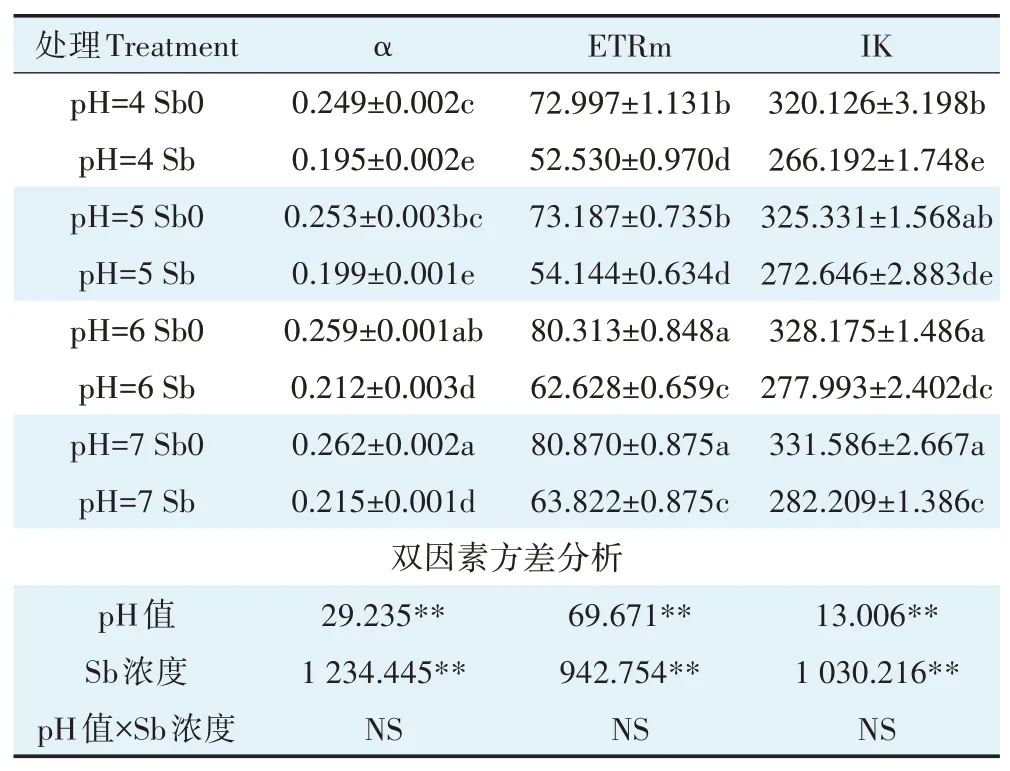
表4 不同pH值条件下Sb对水稻叶绿素荧光光响应曲线参数的影响Table 4 Effects of Sb on parameters of chlorophyll fluorescence photoresponse curve of rice under different pH conditions
2.6 对水稻抗氧化酶和MDA含量的影响
逆境胁迫会大量诱导植株产生活性氧自由基,产生过氧化反应,使细胞膜系统受损,进而影响植物的生长[49],其产物MDA含量常作为反映细胞脂质过氧化强度和质膜受破坏程度的重要参数[50]。本试验中在锑处理后MDA含量显著增加了28.27%,表明细胞膜受到破坏。植株为了抵抗这种逆境胁迫,自身会产生一种抗氧化酶保护系统来清除过多的自由基并维持正常生长[51]。本试验中锑处理下水稻叶片的SOD、POD、CAT活性显著增加,其均值较无锑处理分别增加了13.20%、20.28%和21.73%(表5),相较于pH 4,pH 7条件下水稻叶片的SOD、POD、CAT活性分别降低了5.60%、8.33%、12.50%。抗氧化酶(SOD、CAT、POD)活性的增加(表5),提高了清除自由基的能力,从而缓解了活性氧对细胞膜的伤害,但这是防止活性氧自由基累积从而导致植株死亡的刺激性机制[52],故逆境胁迫造成的生长抑制作用仍旧难以避免。方差分析结果可知pH值和锑处理对SOD和POD活性具有显著的交互作用,而两者的交互作用对MDA含量、CAT活性未产生显著性影响,但其均使三种抗氧化酶活性在低pH条件下增长最为明显,分别是中性pH条件的1.51、1.32倍和1.05倍。这表明在pH 6、pH 7条件下,水稻受锑胁迫引起的氧化损伤较小,在pH 6、pH 7处理组中过氧化反应产物MDA含量增幅较小也可证明这一点。

表5 不同pH值条件下锑胁迫对水稻植株抗氧化酶和MDA含量的影响Table 5 Effects of Sb stress on antioxidant enzymes and MDA content of rice plants under different pH conditions
3 结论
(1)锑处理后,水稻幼苗地上部和根部均大量吸收锑造成锑胁迫,其虽然能够诱导水稻体内的过氧化氢酶、过氧化物酶和超氧化物歧化酶活性增加,但仍然使丙二醛含量升高,抑制水稻地上部生长,降低干物质质量。
(2)锑处理显著降低水稻叶片叶绿素相对含量,降低PSⅡ原初光能转化效率、最大相对电子传递效率和半饱和光强等叶绿素荧光参数,同时叶片非荧光猝灭系数显著提高。锑胁迫通过破坏水稻的细胞膜系统和光合中心来降低水稻光合能力。
(3)营养液在pH=4、pH=5条件下会促进水稻地上部和根部吸收锑,同时加剧锑对水稻的生长、光合性能以及细胞膜的破坏,而在pH=6、pH=7条件下减轻了锑胁迫对水稻的毒害作用。综上,对存在锑污染风险地区可通过适当改变土壤pH值来缓解锑的毒害作用。

